आणविक सिद्धांत: Difference between revisions
No edit summary |
m (18 revisions imported from alpha:आणविक_सिद्धांत) |
||
| (13 intermediate revisions by 3 users not shown) | |||
| Line 1: | Line 1: | ||
{{short description|Model for understanding elemental particles}} | {{short description|Model for understanding elemental particles}}[[File:Helium atom QM.svg|right|thumb|200px|परमाणु के वर्तमान सैद्धांतिक मॉडल में इलेक्ट्रॉनों के संभाव्य पश्चात्ल से घिरा एक घना नाभिक सम्मिलित है]] | ||
[[ | '''आणविक सिद्धांत''' वह [[वैज्ञानिक सिद्धांत]] है जिसके अनुसार पदार्थ परमाणु नामक कणों से बना होता है। परमाणु सिद्धांत की उत्पत्ति परमाणुवाद नामक एक प्राचीन [[दार्शनिक]] परंपरा से हुई है। इस विचार के अनुसार, यदि कोई पदार्थ का एक टुकड़ा लेकर उसे छोटे-छोटे टुकड़ों में काटता है, तब वह अंततः एक ऐसे बिंदु पर पहुंच जाएगा जहां टुकड़ों को और छोटे टुकड़ों में नहीं काटा जा सकता है। [[प्राचीन यूनानी दर्शन]] ने पदार्थ के इन काल्पनिक अंतिम कणों को 'परमाणु' कहा था, जिसका अर्थ अविभाजित होता है। | ||
1800 के दशक के प्रारंभ में, वैज्ञानिक [[जॉन डाल्टन]] ने देखा कि [[रासायनिक पदार्थ]] भार के अनुपात में अन्य पदार्थों में जुड़ते और टूटते हैं, जिससे पता चलता है कि प्रत्येक [[रासायनिक तत्व]] अंततः निरंतर भार के छोटे अविभाज्य कणों से बना होता है। 1850 के कुछ समय पश्चात्, कुछ भौतिकविदों ने गैसों और ऊष्मा के गतिज सिद्धांत को विकसित किया, जिसने गणितीय रूप से गैसों के व्यवहार को यह मानते हुए प्रतिरूपित किया कि वह कणों से बने हैं। 20वीं सदी की प्रारंभ में, [[अल्बर्ट आइंस्टीन]] और [[जॉन पेरिन]] ने सिद्ध किया कि [[एक प्रकार कि गति|ब्राउनी गति]] (जल में परागकणों की अनियमित गति) जल के [[अणु|अणुओं]] की क्रिया के कारण होती है; साक्ष्य की इस तीसरी पंक्ति ने वैज्ञानिकों के मध्य शेष संदेह को शांत कर दिया कि क्या परमाणु और अणु वास्तविक थे। उन्नीसवीं शताब्दी के समय, कुछ वैज्ञानिकों ने आगाह किया था कि परमाणुओं के लिए साक्ष्य अप्रत्यक्ष थे, और इसलिए परमाणु वास्तव में वास्तविक नहीं हो सकते हैं, किन्तु केवल वास्तविक प्रतीत होते हैं। | |||
20वीं शताब्दी के प्रारंभ तक, वैज्ञानिकों ने पदार्थ की संरचना के लिए अधिक विस्तृत और त्रुटिहीन मॉडल विकसित कर लिए थे, जिसके कारण सामान्य पदार्थ बनाने वाले छोटे अदृश्य कणों के लिए अधिक कठोर-परिभाषित वर्गीकरण हुआ। एक ''परमाणु'' को अब मूल कण के रूप में परिभाषित किया जाता है जो एक रासायनिक तत्व का निर्माण करता है। 20वीं शताब्दी के अंत में, भौतिकविदों ने पाया कि जिन कणों को रसायनशास्त्री परमाणु कहते हैं, वह वास्तव में और भी छोटे कणों (''उपपरमाण्विक'' कण) के समूह हैं, किन्तु वैज्ञानिकों ने इस नाम को परंपरा से बाहर रखा। 'प्रारंभिक कण' शब्द का उपयोग अब उन कणों को संदर्भित करने के लिए किया जाता है जो वास्तव में अविभाज्य हैं। | |||
20वीं शताब्दी के प्रारंभ तक, वैज्ञानिकों ने पदार्थ की संरचना के लिए अधिक विस्तृत और त्रुटिहीन मॉडल विकसित कर लिए थे, जिसके कारण सामान्य पदार्थ बनाने वाले छोटे अदृश्य कणों के लिए अधिक कठोर-परिभाषित वर्गीकरण हुआ। एक ''परमाणु'' | |||
== इतिहास == | == इतिहास == | ||
| Line 15: | Line 11: | ||
=== दार्शनिक परमाणुवाद === | === दार्शनिक परमाणुवाद === | ||
{{main|परमाणु सिद्धान्त}} | {{main|परमाणु सिद्धान्त}} | ||
यह विचार कि पदार्थ भिन्न-भिन्न इकाइयों से बना है, एक अधिक पुराना विचार है, जो ग्रीस और भारत सहित अनेक प्राचीन संस्कृतियों में दिखाई देता है। परमाणु शब्द ({{lang-grc-gre|[[:wikt:ἄτομος|ἄτομος]]}};{{lang|grc-Latn|atomos}}), जिसका अर्थ है अकाट्य, पूर्व-सुकराती यूनानी दार्शनिक [[ल्यूसिपस]] और उनके शिष्य [[डेमोक्रिटस]] ({{circa}}460–{{circa}}370 ईसा पूर्व) द्वारा रखा गया था।<ref>{{cite book|last1=Pullman|first1=Bernard|title=The Atom in the History of Human Thought|date=1998|publisher=Oxford University Press|location=Oxford, England|isbn=978-0-19-515040-7|pages=31–33|url=https://books.google.com/books?id=IQs5hur-BpgC&q=Leucippus+Democritus+atom&pg=PA56}}</ref><ref name="Kenny2004">{{cite book|last=Kenny|first=Anthony|author-link=Anthony Kenny|date=2004|title=Ancient Philosophy|url=https://books.google.com/books?id=cpYUDAAAQBAJ&q=Democritus|series=A New History of Western Philosophy|volume=1|location=Oxford, England|publisher=Oxford University Press|isbn=0-19-875273-3|pages=26–28}}</ref><ref name="GraftonMostSettis2010">{{cite book|last=Pyle|first=Andrew|author-link=Andrew Pyle (philosopher)|date=2010|chapter=Atoms and Atomism|title=The Classical Tradition|url=https://books.google.com/books?id=LbqF8z2bq3sC&q=Atoms|editor1-last=Grafton|editor1-first=Anthony|editor1-link=Anthony Grafton|editor2-last=Most|editor2-first=Glenn W.|editor2-link=Glenn W. Most|editor3-last=Settis|editor3-first=Salvatore|publisher=The Belknap Press of Harvard University Press|location=Cambridge, Massachusetts and London, England|isbn=978-0-674-03572-0|pages=103–104}}</ref><ref name="CohenLefebvre2017">{{cite book|editor1-last=Cohen|editor1-first=Henri|editor2-last=Lefebvre|editor2-first=Claire|title=Handbook of Categorization in Cognitive Science|date=2017|publisher=Elsevier|location=Amsterdam, The Netherlands|isbn=978-0-08-101107-2|page=427|edition=Second|url=https://books.google.com/books?id=zIrCDQAAQBAJ&q=Leucippus+Democritus+atom&pg=PA427}}</ref> डेमोक्रिटस ने सिखाया कि परमाणु संख्या में अनंत, अनुपचारित और शाश्वत थे, और यह कि किसी वस्तु के गुण उस प्रकार के परमाणुओं से उत्पन्न होते हैं जो इसे बनाते हैं।<ref name="Kenny2004" /><ref name="GraftonMostSettis2010" /><ref name="CohenLefebvre2017" /> डेमोक्रिटस के परमाणुवाद को पश्चात् के ग्रीक दार्शनिक [[एपिकुरस]] (341-270 ईसा पूर्व) और रोमन एपिक्यूरियन कवि [[ल्यूक्रेटियस]] ({{circa}}99–{{circa}}55 ईसा पूर्व) द्वारा परिष्कृत और विस्तृत किया गया था।<ref name="GraftonMostSettis2010" /><ref name="CohenLefebvre2017" /> [[प्रारंभिक मध्य युग]] के समय, पश्चिमी यूरोप में परमाणुवाद को अधिकतर भुला दिया गया था। 12वीं शताब्दी के समय, [[अरस्तू]] के नए-नए खोजे गए लेखों में इसके संदर्भ के माध्यम से पश्चिमी यूरोप में इसे फिर से जाना जाने लगा।<ref name="GraftonMostSettis2010" /> अरस्तू द्वारा समर्थित स्थितियों का विरोधी दृष्टिकोण यह था कि पदार्थ निरंतर और अनंत था और इसे असीमित रूप से उप-विभाजित किया जा सकता था।<ref>{{Cite web|url=https://www.ck12.org/section/evolution-of-the-atomic-model/|title=Welcome to CK-12 Foundation | CK-12 Foundation}}</ref><ref>Berryman, Sylvia, "Democritus", The Stanford Encyclopedia of Philosophy (Fall 2008 Edition), Edward N. Zalta (ed.), http://plato.stanford.edu/archives/fall2008/entries/democritus</ref> | |||
14वीं शताब्दी में, ल्यूक्रेटियस के [[प्रकृति|डी रेरम नेचुरा]] और डायोजनीज लार्टियस के जीवन और [[प्रख्यात दार्शनिकों के जीवन और राय|प्रख्यात दार्शनिकों की राय]] सहित परमाणुवादी शिक्षाओं का वर्णन करने वाले प्रमुख प्राचीन कार्यों की पुनः खोज ने इस विषय पर विद्वानों का ध्यान बढ़ाया। फिर भी, क्योंकि परमाणुवाद [[महाकाव्यवाद]] के दर्शन से जुड़ा था, जो रूढ़िवादी ईसाई शिक्षाओं का खंडन करता था, जिस कारण अधिकांश यूरोपीय दार्शनिकों द्वारा परमाणुओं में विश्वास को स्वीकार्य नहीं माना जाता था।<ref name="GraftonMostSettis2010" /> फ्रांसीसी कैथोलिक पादरी [[पियरे गैसेंडी]] (1592-1655) ने एपिक्यूरियन परमाणुवाद को संशोधनों के साथ पुनर्जीवित किया, यह तर्क देते हुए कि परमाणु भगवान द्वारा बनाए गए थे और चूंकि अधिक अधिक हैं, किन्तु अनंत नहीं हैं। वह पहले व्यक्ति थे जिन्होंने परमाणुओं के एकत्रीकरण का वर्णन करने के लिए अणु शब्द का प्रयोग किया था।<ref name="GraftonMostSettis2010" /><ref name="CohenLefebvre2017" /> फ्रांस्वा बर्नियर (1620-1688) और इंग्लैंड में प्राकृतिक दार्शनिक [[वाल्टर चार्लटन]] (1619-1707) द्वारा गैसेंडी के परमाणुओं के संशोधित सिद्धांत को फ्रांस में लोकप्रिय बनाया गया था। रसायनज्ञ [[रॉबर्ट बॉयल]] (1627-1691) और भौतिक विज्ञानी [[आइजैक न्यूटन]] (1642-1727) दोनों ने परमाणुवाद का बचाव किया और 17वीं शताब्दी के अंत तक, वैज्ञानिक समुदाय के कुछ भागों द्वारा इसे स्वीकार कर लिया गया।<ref name="GraftonMostSettis2010" /> | |||
=== डाल्टन का बहु अनुपात का नियम === | |||
[[File:Daltons symbols.gif|thumb|right|रासायनिक दर्शन की एक नई प्रणाली से, 1808।]]18वीं शताब्दी के अंत में, परमाणु सिद्धांत की धारणा का उल्लेख किए बिना रासायनिक प्रतिक्रियाओं के बारे में दो नियम सामने आए। पहला द्रव्यमान के संरक्षण का नियम था, जो [[एंटोनी लेवोइसियर]] के काम से निकटता से जुड़ा हुआ था, जिसमें कहा गया है कि रासायनिक प्रतिक्रिया में कुल द्रव्यमान स्थिर (अर्थात, अभिकारकों का द्रव्यमान उत्पादों के समान होता है) रहता है।<ref name="Lavoisier">{{cite web|author=Weisstein, Eric W. |url=http://scienceworld.wolfram.com/biography/Lavoisier.html |title=Lavoisier, Antoine (1743-1794) |publisher=scienceworld.wolfram.com |access-date=2009-08-01}}</ref> दूसरा [[निश्चित अनुपात का नियम]] था। सबसे पहले 1797 में फ्रांसीसी रसायनज्ञ [[जोसेफ प्राउस्ट]] द्वारा स्थापित इस नियम में कहा गया है कि यदि किसी यौगिक को उसके घटक रासायनिक तत्वों में तोड़ दिया जाता है तब मूल पदार्थ की मात्रा या स्रोत की चिन्ता किए बिना, घटकों के द्रव्यमान का भार सदैव समान अनुपात में होगा।<ref>{{Cite web|title=Law of definite proportions {{!}} chemistry|url=https://www.britannica.com/science/law-of-definite-proportions|access-date=2020-09-03|website=Encyclopedia Britannica|language=en}}</ref> | |||
जॉन डाल्टन ने स्वयं और अन्य वैज्ञानिकों द्वारा एकत्र किए गए डेटा का अध्ययन किया और एक पैटर्न देखा जो पश्चात् में अनेक अनुपातों के नियम के रूप में जाना जाने लगा। यौगिकों में जिनमें सभी में एक विशेष तत्व होता है, उस तत्व की सामग्री इन यौगिकों में छोटी पूर्ण संख्याओं के अनुपात से भिन्न होगी। इन सब से डाल्टन ने निष्कर्ष निकाला कि तत्व एक दूसरे के साथ असतत और भार की सुसंगत इकाइयों में प्रतिक्रिया करते हैं। डाल्टन ने इन इकाइयों को परमाणु कहने का फैसला किया। | |||
'''''उदाहरण 1 — टिन ऑक्साइड:''''' डाल्टन ने टिन के दो ऑक्साइड की पहचान की। एक ग्रे चूर्ण (जिसे डाल्टन ने प्रोटोऑक्साइड कहा है) है जिसमें टिन के प्रत्येक 100 भागों के लिए ऑक्सीजन का 13.5 भाग होता है। अन्य ऑक्साइड एक सफेद चूर्ण (जिसे डाल्टन ने ड्यूटॉक्साइड कहा है) है जिसमें टिन के प्रत्येक 100 भागों के लिए ऑक्सीजन के 27 भाग होते हैं।<ref>[[#refDalton1817|Dalton (1817). ''A New System of Chemical Philosophy'' vol. 2, p. 36]]</ref> 13.5 और 27 जो 1:2 का अनुपात बनाते हैं। डाल्टन ने निष्कर्ष निकाला कि ग्रे ऑक्साइड में प्रत्येक टिन परमाणु के लिए एक ऑक्सीजन परमाणु होता है, और सफेद ऑक्साइड में प्रत्येक टिन परमाणु के लिए दो ऑक्सीजन परमाणु होते हैं। इन ऑक्साइडों को आज क्रमशः '''टिन(II) ऑक्साइड (S<sub>n</sub>O)''' और '''टिन(IV) ऑक्साइड (SnO<sub>2</sub>)''' के नाम से जाना जाता है। | |||
'''''उदाहरण 2 — आयरन ऑक्साइड्स:''''' डाल्टन ने आयरन के दो ऑक्साइडों की पहचान की। एक काला चूर्ण होता है जिसमें आयरन के प्रत्येक 100 भाग में लगभग 28 भाग ऑक्सीजन होता है। दूसरा एक लाल चूर्ण है जिसमें आयरन के प्रत्येक 100 भाग के लिए 42 भाग ऑक्सीजन होता हैं।<ref>[[#refDalton1817|Dalton (1817). ''A New System of Chemical Philosophy'' vol. 2, p. 28]]</ref> 28 और 42 का अनुपात 2:3 है। इन ऑक्साइड को आज आयरन (II) ऑक्साइड (जिसे वुस्टाइट के रूप में जाना जाता है) और [[आयरन (III) ऑक्साइड]] (जंग का प्रमुख घटक) के रूप में जाना जाता है। इनके आधुनिक सूत्र क्रमशः Fe<sub>2</sub>O<sub>2</sub> और Fe<sub>2</sub>O<sub>3</sub> हैं। | |||
'''''उदाहरण 3 - नाइट्रोजन ऑक्साइड:''''' डाल्टन ने नाइट्रोजन के तीन ऑक्साइड का उल्लेख किया: नाइट्रस ऑक्साइड, नाइट्रस गैस और नाइट्रिक एसिड<ref>[[#refDalton1808|Dalton (1808). ''A New System of Chemical Philosophy'' vol. 1, pp. 316-319]]</ref> (इन यौगिकों को आज क्रमशः [[नाइट्रस ऑक्साइड]], [[नाइट्रिक ऑक्साइड]] और [[नाइट्रोजन डाइऑक्साइड]] के रूप में जाना जाता है)। डाल्टन ने समझा कि "नाइट्रस ऑक्साइड" में 63.3% नाइट्रोजन और 36.7% ऑक्सीजन है, जिसका अर्थ है कि इसमें प्रत्येक 140 ग्राम नाइट्रोजन के लिए 80 ग्राम ऑक्सीजन है। "नाइट्रस गैस" में 44.05% नाइट्रोजन और 55.95% ऑक्सीजन है, जिसका अर्थ है कि प्रत्येक 140 ग्राम नाइट्रोजन में 160 ग्राम ऑक्सीजन होती है। "नाइट्रिक एसिड" में 29.5% नाइट्रोजन और 70.5% ऑक्सीजन है, जिसका अर्थ है कि इसमें प्रत्येक 140 ग्राम नाइट्रोजन के लिए 320 ग्राम ऑक्सीजन है। 80 ग्राम, 160 ग्राम, और 320 ग्राम का अनुपात 1:2:4 है। इन यौगिकों के लिए डाल्टन के सूत्र N<sub>2</sub>O, NO, और NO<sub>2</sub> थे, जो मूलतः आज के समान ही थे। | |||
=== परमाणु भार का निर्धारण === | |||
किसी तत्व का परमाणु भार मापता है कि उस तत्व का परमाणु अन्य तत्वों के परमाणुओं की तुलना में कितना भारी है। डाल्टन और उनके समकालीन परमाणुओं का पूर्ण भार, अर्थात् ग्राम में उनका भार नहीं माप सकते थे। | |||
1803 में डाल्टन ने जल में कार्बन डाइऑक्साइड और नाइट्रोजन जैसी विभिन्न गैसों की घुलनशीलता पर मैनचेस्टर लिटरेरी एंड फिलोसोफिकल सोसाइटी के सामने एक वार्ता में अनेक पदार्थों के सापेक्ष परमाणु भारों की एक सूची का उल्लेख किया। डाल्टन ने यह संकेत नहीं दिया कि उन्होंने सापेक्ष भार कैसे प्राप्त किया, किन्तु उन्होंने प्रारंभ में परिकल्पना की कि घुलनशीलता में भिन्नता द्रव्यमान और गैस कणों की सम्मिश्रता में अंतर के कारण थी - एक विचार जिसे उन्होंने 1805 में पेपर के अंत में प्रकाशित होने तक छोड़ दिया था।<ref name="Dalton_1803_paper">डाल्टन, जॉन। [http://web.lemoyne.edu/~GIUNTA/dalton52.html पानी और अन्य तरल पदार्थों द्वारा गैसों के अवशोषण पर], मैनचेस्टर के साहित्यिक और दार्शनिक समाज के संस्मरण में। 1803. 29 अगस्त, 2007 को पुनःप्राप्त। </ref> वर्षों से, अनेक इतिहासकारों ने डाल्टन के परमाणु सिद्धांत के विकास का श्रेय उनके गैसीय विलेयता के अध्ययन को दिया है, किन्तु उनकी प्रयोगशाला नोटबुक प्रविष्टियों के एक नवीनतम अध्ययन ने निष्कर्ष निकाला कि उन्होंने रासायनिक परमाणु सिद्धांत विकसित किया। 1803 में नाइट्रिक एसिड की संरचना पर कैवेंडिश और लेवोज़ियर के विश्लेषणात्मक डेटा को समेटने के लिए, जल में गैसों की घुलनशीलता की व्याख्या नहीं की गई थी।<ref>{{Cite journal|last=Grossman|first=Mark I.|date=2021-01-02|title=जॉन डाल्टन का "अहा" क्षण: रासायनिक परमाणु सिद्धांत की उत्पत्ति|url=https://doi.org/10.1080/00026980.2020.1868861|journal=Ambix|volume=68|issue=1|pages=49–71|doi=10.1080/00026980.2020.1868861|issn=0002-6980|pmid=33577439|s2cid=231909410}}</ref> | |||
थॉमसन (रसायनज्ञ) ने अपनी पुस्तक ए सिस्टम ऑफ केमिस्ट्री के तीसरे संस्करण में डाल्टन के परमाणु सिद्धांत का पहला संक्षिप्त विवरण प्रकाशित किया।<ref>{{Cite web|title=डाल्टन की परमाणु परिकल्पना पर थॉमसन|url=https://www.chemteam.info/Chem-History/Thomson-on-Dalton-1807/Thomson-on-Dalton-1807.html|access-date=2021-02-20|website=www.chemteam.info}}</ref> 1808 में डाल्टन ने ए न्यू सिस्टम ऑफ केमिकल फिलॉसफी के पहले भाग में एक विस्तृत विवरण प्रकाशित किया।<ref>{{Cite book|last=Dalton|first=John|url=https://books.google.com/books?id=Wp7QAAAAMAAJ|title=रासायनिक दर्शन की एक नई प्रणाली ...|date=1808|publisher=S. Russell|pages=211–216|language=en}}</ref> चूंकि, 1811 तक डाल्टन ने बहु अनुपात के अपने सिद्धांत के लिए अपना तर्क प्रदान नहीं किया था।<ref>{{Cite book|last=Nicholson|first=William|url=https://books.google.com/books?id=0Os3AQAAIAAJ&q=%E2%80%98Observations+on+Dr.+Bostock's+review+of+the+atomic+principles+of+chemistry%E2%80%99&pg=PA143|title=ए जर्नल ऑफ नेचुरल फिलॉसफी, केमिस्ट्री एंड द आर्ट्स|date=1811|publisher=G. G. and J. Robinson|pages=143–151|language=en}}</ref> | |||
डाल्टन ने हाइड्रोजन परमाणु को एकता के रूप में लेते हुए, द्रव्यमान अनुपात के अनुसार परमाणु भार का अनुमान लगाया जिसमें वह संयुक्त थे। चूँकि, डाल्टन को यह नहीं पता था कि कुछ तत्व परमाणु अणुओं के रूप में अपने प्राकृतिक शुद्ध रूप में उपस्थित हैं - जैसे शुद्ध ऑक्सीजन O2 के रूप में उपस्थित होती है। उन्होंने यह भी गलती से मान लिया कि किन्हीं दो तत्वों के मध्य के सबसे सरल यौगिक में सदैव प्रत्येक (इसलिए उन्होंने सोचा कि जल HO है H<sub>2</sub>O नही है) का एक परमाणु होता है।<ref>{{cite news|author=Johnson, Chris |url=http://www.bulldog.u-net.com/avogadro/avoga.html |archive-url=https://web.archive.org/web/20020710224229/http://www.bulldog.u-net.com/avogadro/avoga.html |url-status=dead |archive-date=2002-07-10 |title=Avogadro - his contribution to chemistry |access-date=2009-08-01 }}</ref> यह, उसके उपकरणों की अशिष्टता के अतिरिक्त, उसके परिणामों में त्रुटिपूर्ण था। उदाहरण के लिए, 1803 में उनका मानना था कि ऑक्सीजन परमाणु हाइड्रोजन परमाणुओं से 5.5 गुना भारी थे, क्योंकि जल में उन्होंने प्रत्येक 1 ग्राम हाइड्रोजन के लिए 5.5 ग्राम ऑक्सीजन मापा और माना कि जल का सूत्र HO था। योग्य डेटा को अपनाते हुए, 1806 में उन्होंने निष्कर्ष निकाला कि ऑक्सीजन का परमाणु भार वास्तव में 5.5 के अतिरिक्त 7 होना चाहिए, और उन्होंने अपने शेष जीवन के लिए इस भार को बनाए रखा। इस समय अन्य लोगों ने पहले से ही अधिक त्रुटिहीन माप से यह निष्कर्ष निकाला था कि यदि कोई जल के अणु (HO) के लिए डाल्टन के सूत्र को मानता है तब ऑक्सीजन परमाणु का वजन हाइड्रोजन के सापेक्ष 8 के सामान्तर होना चाहिए या यदि कोई आधुनिक जल सूत्र (H<sub>2</sub>O) को मानता है तब 16 होना चाहिए।<ref name="Chemical Atomism in the Nineteenth Century">{{cite book|author=Alan J. Rocke |year=1984 |title=Chemical Atomism in the Nineteenth Century |publisher=Ohio State University Press |location=Columbus}}</ref> | |||
=== अवोगाद्रो === | |||
डाल्टन के सिद्धांत में दोष को 1811 में [[एमेडियो अवोगाद्रो]] द्वारा सैद्धांतिक रूप से ठीक किया गया था। अवोगाद्रो ने प्रस्तावित किया था कि समान तापमान और दबाव पर किन्हीं दो गैसों के समान आयतन में समान संख्या में अणु (दूसरे शब्दों में, गैस के कणों का द्रव्यमान उस आयतन को प्रभावित नहीं करता है जो इसे घेरे हुए है) होते हैं।<ref name="avogadro">{{cite journal|author=Avogadro, Amedeo|url=http://web.lemoyne.edu/~giunta/avogadro.html |title=Essay on a Manner of Determining the Relative Masses of the Elementary Molecules of Bodies, and the Proportions in Which They Enter into These Compounds|year=1811 |journal=Journal de Physique|volume=73|pages=58–76}}</ref> अवोगाद्रो के नियम ने उन्हें उन मात्राओं का अध्ययन करके अनेक गैसों की डायटोमिक प्रकृति को कम करने की अनुमति दी, जिस पर उन्होंने प्रतिक्रिया की। उदाहरण के लिए: यह तथ्य कि दो लीटर हाइड्रोजन केवल एक लीटर ऑक्सीजन के साथ प्रतिक्रिया करके दो लीटर जलवाष्प (स्थिर दबाव और तापमान पर) उत्पन्न करेगा, यह सुझाव देता है कि पानी के दो अणु बनाने के लिए एक ऑक्सीजन अणु को दो भागों में विभाजित होना चाहिए। इसका अर्थ यह भी था कि पानी का अणु H<sub>2</sub>O होना चाहिए। इस प्रकार, अवोगाद्रो ऑक्सीजन और विभिन्न अन्य तत्वों के परमाणु द्रव्यमान का अधिक त्रुटिहीन अनुमान लगाने में सक्षम था, और अणुओं और परमाणुओं के मध्य स्पष्ट अंतर किया।<ref>{{Cite journal |last=Hinshelwood |first=Cyril N. |author-link=Cyril Norman Hinshelwood |last2=Pauling |first2=Linus |author-link2=Linus Pauling |date=1956-10-19 |title=Amedeo Avogadro |url=https://www.science.org/doi/10.1126/science.124.3225.708 |journal=Science |language=en |volume=124 |issue=3225 |pages=708–713 |doi=10.1126/science.124.3225.708 |issn=0036-8075}}</ref> जिसे अब हम परमाणु कहते हैं अवोगाद्रो उसे "प्राथमिक अणु" कहता है, और जिसे अब हम अणु कहते हैं उसे अवोगाद्रो "यौगिक अणु" कहता है। | |||
=== आइसोमेरिज्म === | |||
वैज्ञानिकों ने जल्द ही ऐसे पदार्थों के स्थितियों की खोज की जिनकी आनुपातिक तात्विक संरचना समान है किन्तु गुण भिन्न हैं। उदाहरण के लिए, 1827 में, फ्रेडरिक वॉहलर ने पाया कि सिल्वर फुलमिनेट और सिल्वर साइनेट दोनों 107 भाग सिल्वर, 12 भाग कार्बन, 14 भाग नाइट्रोजन और 12 भाग ऑक्सीजन (अब हम उनके सूत्रों को AgCNO दोनों के रूप में जानते हैं) हैं। वॉहलर ने यह भी पता लगाया कि यूरिया और अमोनियम साइनेट दोनों की संरचना समान (अब हम जानते हैं कि उनके सूत्र CH<sub>4</sub>N<sub>2</sub>O हैं) है किन्तु गुण भिन्न-भिन्न हैं। 1830 में, जॉन्स जैकब बर्ज़ेलियस ने इस घटना का वर्णन करने के लिए आइसोमेरिज्म शब्द का प्रारंभ किया था। 1830 के दशक और बाद के अधिकांश रसायनज्ञों ने इस सुझाव को स्वीकार कर लिया कि समरूपता समान संख्या और प्रकार के परमाणुओं की भिन्न-भिन्न व्यवस्था के परिणामस्वरूप हुई, जिसके परिणामस्वरूप भिन्न-भिन्न पदार्थ बने। कार्बनिक रसायन विज्ञान के विकास के साथ आइसोमर्स की संख्या तेजी से बढ़ी, सामान्यतः 1860 के दशक में परमाणु संयोजकता और संरचनात्मक सिद्धांत के प्रारंभ के बाद तेजी से बढ़ी थी। उदाहरण के लिए, पेंटेन (C5H12) पर विचार करें। संयोजकता और संरचना के सिद्धांतों के अनुसार, पेंटेन अणु के लिए तीन संभावित परमाणु विन्यास हैं, और वास्तव में तीन भिन्न-भिन्न पदार्थ हैं जिनकी संरचना पेंटेन के समान है किन्तु भिन्न-भिन्न गुण हैं। | |||
आइसोमेरिज्म कुछ ऐसा नहीं था जिसे परमाणु सिद्धांत के वैकल्पिक सिद्धांतों, जैसे कि कट्टरपंथी सिद्धांत और प्रकारों के सिद्धांत द्वारा पूरी तरह से समझाया जा सकता था। | |||
1860 में, लुई पाश्चर ने परिकल्पना की कि आइसोमर्स के अणुओं की संरचना समान हो सकती है किन्तु उनके परमाणुओं की तीन आयामों में भिन्न-भिन्न व्यवस्था हो सकती है। 1874 में, जेकोबस हेनरिकस वैन टी हॉफ ने प्रस्तावित किया कि कार्बन परमाणु टेट्राहेड्रल व्यवस्था में अन्य परमाणुओं के साथ बंधन बनाता है। इस परिकल्पना से काम करते हुए, वह आइसोमेरिज्म के स्थितियों की व्याख्या कर सकते थे जहां प्रासंगिक अणुओं की मूल कंकाल संरचना समान प्रतीत होती थी; दोनों अणु केवल अपने त्रि-आयामी स्थानिक विन्यास में भिन्न थे, जैसे दो अन्यथा समान बाएँ और दाएँ हाथ, या दो समान सर्पिल जो दक्षिणावर्त और वामावर्त घूमते हैं। | |||
=== मेंडेलीव की आवर्त सारणी === | === मेंडेलीव की आवर्त सारणी === | ||
[[File:Mendelejevs periodiska system 1871.png|right|thumb|upright=4|मेंडेलीव की [[आवर्त सारणी]] 1871 से।]] | [[File:Mendelejevs periodiska system 1871.png|right|thumb|upright=4|मेंडेलीव की [[आवर्त सारणी]] 1871 से।]] | ||
{{main| | {{main|आवर्त सारणी}} | ||
[[दिमित्री मेंडेलीव]] ने देखा कि जब उन्होंने तत्वों को उनके परमाणु भार के अनुसार एक पंक्ति में व्यवस्थित किया, | [[दिमित्री मेंडेलीव]] ने देखा कि जब उन्होंने तत्वों को उनके परमाणु भार के अनुसार एक पंक्ति में व्यवस्थित किया, तब उनमें एक निश्चित आवधिकता थी।<ref name="Scerri">{{cite book|author-link=Eric Scerri |last=Scerri |first=Eric R. |year=2020 |title=The Periodic Table, Its Story and Its Significance |edition=2nd |publisher=Oxford University Press |location=New York |isbn=978-0-190-91436-3}}</ref>{{rp|117}} उदाहरण के लिए, दूसरा तत्व, [[लिथियम]], के गुण नौवें तत्व से, [[सोडियम]], और सोलहवें तत्व, [[पोटैशियम]] - सात की अवधि के समान गुण थे। इसी प्रकार, [[फीरोज़ा|बेरिलियम]], [[मैगनीशियम]] और [[कैल्शियम]] समान थे और सभी मेंडेलीव की सारणी (आधुनिक तालिका में आठ स्थान भिन्न) पर सभी एक दूसरे से सात स्थानों की दूरी पर थे। इन प्रारूपों का उपयोग करते हुए, मेंडेलीव ने नए तत्वों के अस्तित्व और गुणों की पूर्वानुमान की, जो पश्चात् में प्रकृति में [[स्कैंडियम]], [[गैलियम]] और [[जर्मेनियम]] में खोजे गए।<ref name="Scerri"/>{{rp|118}} इसके अतिरिक्त, आवर्त सारणी यह अनुमान लगा सकती है कि एक परमाणु अन्य तत्वों के कितने परमाणुओं के साथ बंध सकता है - उदाहरण के लिए, जर्मेनियम और [[कार्बन समूह|कार्बन सारणी]] पर एक ही समूह में हैं और उनके परमाणु प्रत्येक दो ऑक्सीजन परमाणुओं (GeO<sub>2</sub> और CO<sub>2</sub>) के साथ जुड़ते हैं। मेंडेलीव ने इन प्रारूपों को परिकल्पना की पुष्टि करने के लिए पाया कि पदार्थ परमाणुओं से बना है। क्योंकि इससे पता चला कि तत्वों को उनके परमाणु भार के आधार पर वर्गीकृत किया जा सकता है। एक अवधि के मध्य में एक नया तत्व डालने से उस अवधि और अगले अवधि के मध्य समानता टूट जाएगी, और डाल्टन के एकाधिक अनुपात के नियम का भी उल्लंघन होगा।<ref>{{cite journal|title=A Reconstruction of Development of the Periodic Table Based on History and Philosophy of Science and Its Implications for General Chemistry Textbooks |first1=Angmary |last1=Brito |first2=María A. |last2=Rodríguez |first3=Mansoor |last3=Niaz |journal=Journal of Research in Science Teaching |volume=42 |number=1 |pages=84–111 |doi=10.1002/tea.20044}}</ref> | ||
=== ब्राउनियन गति === | === ब्राउनियन गति === | ||
1827 में, ब्रिटिश वनस्पतिशास्त्री रॉबर्ट ब्राउन (वनस्पतिशास्त्री, जन्म 1773) ने देखा कि | 1827 में, ब्रिटिश वनस्पतिशास्त्री रॉबर्ट ब्राउन (वनस्पतिशास्त्री, जन्म 1773) ने देखा कि जल में तैरते परागकणों के अंदर धूल के कण बिना किसी स्पष्ट कारण के निरंतर हिलते-डुलते रहते हैं। 1905 में, अल्बर्ट आइंस्टीन ने सिद्धांत दिया कि यह ब्राउनियन गति जल के अणुओं द्वारा कण को निरंतर टकराने के कारण हुई, और इसका वर्णन करने के लिए एक गणितीय मॉडल विकसित किया।<ref name="einstein">{{cite journal|last1=Einstein|first1=A.|title=Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen|journal=Annalen der Physik|volume=322|pages=549–560|year=1905|doi=10.1002/andp.19053220806|bibcode = 1905AnP...322..549E|issue=8 |hdl=10915/2785|url=http://sedici.unlp.edu.ar/bitstream/handle/10915/2785/Documento_completo__.pdf?sequence=1|doi-access=free}}</ref> इस मॉडल को 1908 में फ्रांसीसी भौतिक विज्ञानी जीन पेरिन द्वारा प्रयोगात्मक रूप से मान्य किया गया था, जिन्होंने परमाणुओं के आकार को निर्धारित करने के लिए आइंस्टीन के समीकरणों का उपयोग किया था। इस प्रकार परमाणु सिद्धांत के लिए अतिरिक्त सत्यापन और अणुओं के आकार का एक मात्रात्मक माप प्रदान किया गया।<ref>{{Cite web |title=The Nobel Prize in Physics 1926 |url=https://www.nobelprize.org/prizes/physics/1926/perrin/lecture/ |access-date=2023-02-08 |website=NobelPrize.org |language=en-US}}</ref> | ||
{| class="wikitable" | |||
|+विभिन्न सरल अणुओं के गतिज व्यास | |||
!अणु | |||
!पेरियर की माप | |||
!आधुनिक माप | |||
|- | |||
|हीलियम | |||
|1.7 × 10<sup>−10</sup> m | |||
|2.6 × 10<sup>−10</sup> m | |||
|- | |||
|आर्गन | |||
|2.7 × 10<sup>−10</sup> m | |||
|3.4 × 10<sup>−10</sup> m | |||
|- | |||
|पारा | |||
|2.8 × 10<sup>−10</sup> m | |||
|3 × 10<sup>−10</sup> m | |||
|- | |||
|हाइड्रोजन | |||
|2 × 10<sup>−10</sup> m | |||
|2.89 × 10<sup>−10</sup> m | |||
|- | |||
|ऑक्सीजन | |||
|2.6 × 10<sup>−10</sup> m | |||
|3.46 × 10<sup>−10</sup> m | |||
|- | |||
|नाइट्रोजन | |||
|2.7 × 10<sup>−10</sup> m | |||
|3.64 × 10<sup>−10</sup> m | |||
|- | |||
|क्लोरीन | |||
|4 × 10<sup>−10</sup> m | |||
|3.20 × 10<sup>−10</sup> m | |||
|} | |||
=== [[सांख्यिकीय यांत्रिकी]] === | === [[सांख्यिकीय यांत्रिकी]] === | ||
[[आदर्श गैस कानून]] और भौतिकी के सांख्यिकीय रूपों को | [[आदर्श गैस कानून|आदर्श गैस नियम]] और भौतिकी के सांख्यिकीय रूपों को प्रस्तुत करने के लिए, परमाणुओं के अस्तित्व की पुष्टि करना आवश्यक था। 1738 में, स्विस भौतिक विज्ञानी और गणितज्ञ [[डेनियल बर्नौली]] ने माना कि गैसों का दबाव और ऊष्मा दोनों ही अणुओं की अंतर्निहित गति के कारण होते हैं। | ||
1860 में, [[जेम्स क्लर्क मैक्सवेल]], जो परमाणुवाद के मुखर समर्थक थे, भौतिकी में सांख्यिकीय यांत्रिकी का उपयोग करने वाले पहले व्यक्ति थे।<ref>See: | 1860 में, [[जेम्स क्लर्क मैक्सवेल]], जो परमाणुवाद के मुखर समर्थक थे,वह भौतिकी में सांख्यिकीय यांत्रिकी का उपयोग करने वाले पहले व्यक्ति थे।<ref>See: | ||
*Maxwell, J.C. (1860) [https://books.google.com/books?id=-YU7AQAAMAAJ&pg=PA19#v=onepage&q&f=false "Illustrations of the dynamical theory of gases. Part I. On the motions and collisions of perfectly elastic spheres,"] ''Philosophical Magazine'', 4th series, '''19''' : 19–32. | *Maxwell, J.C. (1860) [https://books.google.com/books?id=-YU7AQAAMAAJ&pg=PA19#v=onepage&q&f=false "Illustrations of the dynamical theory of gases. Part I. On the motions and collisions of perfectly elastic spheres,"] ''Philosophical Magazine'', 4th series, '''19''' : 19–32. | ||
*Maxwell, J.C. (1860) [https://books.google.com/books?id=DIc7AQAAMAAJ&pg=PA21#v=onepage&q&f=false "Illustrations of the dynamical theory of gases. Part II. On the process of diffusion of two or more kinds of moving particles among one another,"] ''Philosophical Magazine'', 4th series, '''20''' : 21–37.</ref> [[लुडविग बोल्ट्जमैन]] और [[रुडोल्फ क्लॉसियस]] ने गैसों और [[ऊष्मप्रवैगिकी]] के नियमों | *Maxwell, J.C. (1860) [https://books.google.com/books?id=DIc7AQAAMAAJ&pg=PA21#v=onepage&q&f=false "Illustrations of the dynamical theory of gases. Part II. On the process of diffusion of two or more kinds of moving particles among one another,"] ''Philosophical Magazine'', 4th series, '''20''' : 21–37.</ref> [[लुडविग बोल्ट्जमैन]] और [[रुडोल्फ क्लॉसियस]] ने गैसों और [[ऊष्मप्रवैगिकी]] के नियमों, विशेष रूप से एन्ट्रापी से संबंधित दूसरे नियम पर अपने काम का विस्तार किया। 1870 के दशक में, [[योशिय्याह विलार्ड गिब्स]] ने एंट्रॉपी और ऊष्मप्रवैगिकी के नियमों का विस्तार किया और सांख्यिकीय यांत्रिकी शब्द रखा। आइंस्टीन ने पश्चात् में स्वतंत्र रूप से गिब्स के नियमों को फिर से खोजा, क्योंकि वह केवल एक अस्पष्ट अमेरिकी पत्रिका में छपे थे।<ref>Navarro, Luis. “Gibbs, Einstein and the Foundations of Statistical Mechanics.” Archive for History of Exact Sciences, vol. 53, no. 2, Springer, 1998, pp. 147–80, http://www.jstor.org/stable/41134058.</ref> आइंस्टीन ने पश्चात् में टिप्पणी की कि यदि उन्हें गिब्स के काम के बारे में पता होता, तब वह उन पत्रों को बिल्कुल भी प्रकाशित नहीं करते, किन्तु स्वयं को कुछ बिंदुओं [जो भिन्न थे] के विवेचन तक ही सीमित रखते।<ref>Stone, A. Douglas, Einstein and the quantum : the quest of the valiant Swabian, Princeton University Press, (2013). {{ISBN|978-0-691-13968-5}} quoted from Folsing, Albert Einstein, 110.</ref> सभी सांख्यिकीय यांत्रिकी और ऊष्मा, गैस और एन्ट्रापी के नियमों ने परमाणुओं के अस्तित्व को एक आवश्यक अवधारणा के रूप में लिया। | ||
===उपपरमाण्विक कणों की खोज=== | ===उपपरमाण्विक कणों की खोज=== | ||
{{Main| | {{Main|इलेक्ट्रॉन|प्लम-पुडिंग मॉडल}} | ||
{{multiple image | {{multiple image | ||
|direction = | |direction = क्षैतिज | ||
|align = | |align = उचित | ||
|width = 300 | |width = 300 | ||
|footer = | |footer = | ||
| Line 79: | Line 108: | ||
|image2 = JJ Thomson Cathode Ray 2 explained.svg | |image2 = JJ Thomson Cathode Ray 2 explained.svg | ||
|alt2 = | |alt2 = | ||
|caption2 = | |caption2 = कैथोड किरणों (नीली) को कैथोड से उत्सर्जित किया गया था, स्लिट्स द्वारा एक बीम में तेज किया गया था, फिर दो विद्युतीकृत प्लेटों के बीच से निकलते समय विक्षेपित किया गया था। | ||
}} | }} | ||
1897 तक परमाणुओं को पदार्थ का सबसे छोटा संभव विभाजन माना जाता था जब जे जे थॉमसन ने कैथोड किरणों पर अपने काम के माध्यम से [[इलेक्ट्रॉन]] की खोज की।<ref name="thomson">{{cite journal|author=Thomson, J. J. |url=http://web.lemoyne.edu/~GIUNTA/thomson1897.html |title=Cathode rays|journal=Philosophical Magazine|volume=44|page=293|year=1897 |format=[facsimile from Stephen Wright, Classical Scientific Papers, Physics (Mills and Boon, 1964)]|doi=10.1080/14786449708621070|issue=269}}</ref> | 1897 तक परमाणुओं को पदार्थ का सबसे छोटा संभव विभाजन माना जाता था जब जे जे थॉमसन ने कैथोड किरणों पर अपने काम के माध्यम से [[इलेक्ट्रॉन]] की खोज की।<ref name="thomson">{{cite journal|author=Thomson, J. J. |url=http://web.lemoyne.edu/~GIUNTA/thomson1897.html |title=Cathode rays|journal=Philosophical Magazine|volume=44|page=293|year=1897 |format=[facsimile from Stephen Wright, Classical Scientific Papers, Physics (Mills and Boon, 1964)]|doi=10.1080/14786449708621070|issue=269}}</ref> | ||
थॉमसन ने सुझाव दिया कि परमाणु विभाज्य हैं, और कणिकाएं उनके निर्माण खंड हैं।<ref name=Whittaker>{{citation|last=Whittaker|first= E. T.|author-link=E. T. Whittaker|title=[[A History of the Theories of Aether and Electricity|A History of the Theories of Aether and Electricity. Vol 1]]| publisher=Nelson, London |year=1951}}</ref> परमाणु के समग्र तटस्थ आवेश की व्याख्या करने के लिए, उन्होंने प्रस्ताव दिया कि कणिकाओं को | [[क्रूक्स ट्यूब]] सीलबंद ग्लास कंटेनर होता है जिसमें दो [[इलेक्ट्रोड]] एक निर्वात द्वारा भिन्न होते हैं। जब इलेक्ट्रोड पर एक [[वोल्टेज]] लगाया जाता है, तब कैथोड किरणें उत्पन्न होती हैं, जिससे एक चमकदार पैच बनता है जहां वह ट्यूब के विपरीत छोर पर कांच से टकराते हैं। प्रयोग के माध्यम से, थॉमसन ने पाया कि किरणों को एक [[विद्युत क्षेत्र]] ([[चुंबकीय क्षेत्र]] के अतिरिक्त, जो पहले से ज्ञात था) द्वारा विक्षेपित किया जा सकता है। उन्होंने निष्कर्ष निकाला कि यह किरणें, प्रकाश का रूप न होकर, अधिक हल्के ऋणात्मक विद्युत आवेशित कणों से बनी थीं। थॉमसन ने इन्हें [[कणिकावाद|अणु कण (कणिका)]] कहा, किन्तु विद्युत आवेश की मूल इकाई के नामकरण के लिए [[जॉर्ज जॉनस्टोन स्टोनी]] के 1894 के सुझाव के पश्चात् अन्य वैज्ञानिकों ने उन्हें इलेक्ट्रॉन कहा।<ref>{{Cite book |last=Olenick |first=Richard P. |title=Beyond the Mechanical Universe: From Electricity to Modern Physics |title-link=The Mechanical Universe |last2=Apostol |first2=Tom M. |last3=Goodstein |first3=David L. |date=1986-12-26 |publisher=Cambridge University Press |isbn=978-0-521-30430-6 |pages=435 |language=en}}</ref> उन्होंने द्रव्यमान-से-आवेश अनुपात को मापा और पाया कि यह सबसे छोटे परमाणु हाइड्रोजन से 1800 गुना छोटा था। यह कणिकाएं पहले से ज्ञात किसी अन्य के विपरीत एक कण थीं। | ||
थॉमसन ने सुझाव दिया कि परमाणु विभाज्य हैं, और कणिकाएं उनके निर्माण खंड हैं।<ref name="Whittaker">{{citation|last=Whittaker|first= E. T.|author-link=E. T. Whittaker|title=[[A History of the Theories of Aether and Electricity|A History of the Theories of Aether and Electricity. Vol 1]]| publisher=Nelson, London |year=1951}}</ref> परमाणु के समग्र तटस्थ आवेश की व्याख्या करने के लिए, उन्होंने प्रस्ताव दिया कि कणिकाओं को धनात्मक आवेश के एक समान समुद्र में वितरित किया गया था।<ref name="thomson2">{{cite journal|author=Thomson, J. J. |url=http://www.chemteam.info/Chem-History/Thomson-Structure-Atom.html|title=On the Structure of the Atom: an Investigation of the Stability and Periods of Oscillation of a number of Corpuscles arranged at equal intervals around the Circumference of a Circle; with Application of the Results to the Theory of Atomic Structure|journal=Philosophical Magazine|year= 1904|volume= 7|page=237|doi=10.1080/14786440409463107|issue=39}}</ref> इसे [[बेर का हलवा मॉडल|प्लम पुडिंग मॉडल]] के रूप में जाना जाता है क्योंकि इलेक्ट्रॉनों को सूखे फल के [[क्रिसमस का हलवा|पुडिंग]] में फलों के टुकड़ों की तरह धनात्मक आवेश में एम्बेडेड किया गया था, चूंकि थॉमसन ने सोचा था कि इलेक्ट्रॉन परमाणु के अन्दर घूमते रहते हैं।<ref>{{cite journal|doi=10.1002/andp.201300732 |first1=Giora |last1=Hon |first2=Bernard R. |last2=Goldstein |title=J. J. Thomson's plum-pudding atomic model: The making of a scientific myth |journal=[[Annalen der Physik]] |date=2013-09-06 |volume=525 |number=8–9 |pages=A129–A133}}</ref> | |||
===नाभिक की खोज=== | ===नाभिक की खोज=== | ||
{{Main| | {{Main|रदरफोर्ड मॉडल}} | ||
[[File:Geiger-Marsden experiment expectation and result.svg|right|400px|thumb|गीजर-मार्सडेन प्रयोग<br/> ''बाएं:'' अपेक्षित परिणाम: अल्फा कण नगण्य विक्षेपण के साथ परमाणु के प्लम पुडिंग मॉडल से गुजरते हैं।<br/> ''दाएं:'' देखे गए परिणाम: का एक छोटा सा भाग कणों को नाभिक के केंद्रित धनात्मक आवेश द्वारा विक्षेपित किया गया था।]]थॉमसन के प्लम पुडिंग मॉडल को 1909 में उनके एक पूर्व छात्र, [[अर्नेस्ट रदरफोर्ड]] द्वारा अस्वीकृत कर दिया गया था, जिन्होंने पाया कि परमाणु का अधिकांश द्रव्यमान और धनात्मक आवेश इसके आयतन के | [[File:Geiger-Marsden experiment expectation and result.svg|right|400px|thumb|गीजर-मार्सडेन प्रयोग<br/> ''बाएं:'' अपेक्षित परिणाम: अल्फा कण नगण्य विक्षेपण के साथ परमाणु के प्लम पुडिंग मॉडल से गुजरते हैं।<br/> ''दाएं:'' देखे गए परिणाम: का एक छोटा सा भाग कणों को नाभिक के केंद्रित धनात्मक आवेश द्वारा विक्षेपित किया गया था।]]थॉमसन के प्लम पुडिंग मॉडल को 1909 में उनके एक पूर्व छात्र, [[अर्नेस्ट रदरफोर्ड]] द्वारा अस्वीकृत कर दिया गया था, जिन्होंने पाया कि परमाणु का अधिकांश द्रव्यमान और धनात्मक आवेश इसके आयतन के अधिक छोटे अंश में केंद्रित होता है, जिसे उन्होंने बिल्कुल केंद्र में माना था। | ||
अर्नेस्ट रदरफोर्ड और उनके सहयोगियों [[हंस गीजर|हंस गीगर]] और [[अर्नेस्ट मार्सडेन]] को थॉमसन मॉडल के बारे में संदेह हुआ क्योंकि जब उन्होंने [[अल्फा कण|अल्फा कणों]] (यह [[रेडियम]] जैसे कुछ रेडियोधर्मी पदार्थों द्वारा उत्सर्जित धनात्मक आवेशित कण हैं) के आवेश-से-द्रव्यमान अनुपात को मापने के लिए एक उपकरण बनाने की कोशिश की तब उन्हें कठिनाइयों का सामना करना पड़ा। डिटेक्शन चैंबर में हवा द्वारा अल्फा कण बिखरे जा रहे थे, जिससे माप अविश्वसनीय हो गए थे। थॉमसन को कैथोड किरणों पर अपने काम में इसी प्रकार की समस्या का सामना करना पड़ा था, जिसे उन्होंने अपने उपकरणों में लगभग पूर्ण निर्वात बनाकर समाधान किया था। रदरफोर्ड ने नहीं सोचा था कि वह इसी समस्या का सामना करेंगे क्योंकि अल्फा कण इलेक्ट्रॉनों की तुलना में अधिक अधिक भारी होते हैं। परमाणु के थॉमसन के मॉडल के अनुसार, परमाणु में धनात्मक आवेश एक अल्फा कण को विक्षेपित करने के लिए पर्याप्त विद्युत क्षेत्र का उत्पादन करने के लिए पर्याप्त रूप से केंद्रित नहीं है, और इलेक्ट्रॉन इतने हल्के होते हैं कि उन्हें अधिक भारी अल्फा कणों द्वारा आसानी से एक तरफ धकेल दिया जाना चाहिए। फिर भी बिखराव हुआ था, इसलिए रदरफोर्ड और उनके सहयोगियों ने इस बिखराव की सावधानी से जांच करने का फैसला किया।<ref name=Heilbron2003p64-68>[[#refHeilbron2003|Heilbron (2003). ''Ernest Rutherford and the Explosion of Atoms'', pp. 64-68]]</ref> | |||
1908 और 1913 के मध्य, रदरफोर्ड और उनके सहयोगियों ने अनेक प्रयोग किए, जिसमें उन्होंने अल्फा कणों के साथ धातु की पतली पन्नी पर बमबारी की। उन्होंने अल्फा कणों को 90° से अधिक कोणों से विक्षेपित होते हुए देखा। इसकी व्याख्या करने के लिए, रदरफोर्ड ने प्रस्ताव दिया कि परमाणु का धनात्मक आवेश परमाणु के पूरे आयतन में वितरित नहीं होता जैसा कि थॉमसन का मानना था, किन्तु केंद्र में एक छोटे से नाभिक में केंद्रित है। आवेश की केवल इतनी सघन सांद्रता ही एक ऐसा विद्युत क्षेत्र उत्पन्न कर सकती है जो अल्फा कणों को विक्षेपित करने के लिए पर्याप्त हो जैसा कि देखा गया है।<ref name="Heilbron2003p64-68" /> रदरफोर्ड के मॉडल को कभी-कभी ग्रहीय मॉडल कहा जाता है।<ref>{{cite web |title=Rutherford model {{!}} Definition & Facts |url=https://www.britannica.com/science/Rutherford-model |website=Encyclopedia Britannica |access-date=23 August 2021 |language=en}}</ref> चूंकि, [[हंतारो नागाओका]] को रदरफोर्ड ने 1904 में ग्रहों के परमाणु का सुझाव देने वाले पहले व्यक्ति के रूप में उद्धृत किया था।<ref>Rutherford either knew the article or looked it up, for he cited it on the last page of his classic paper, "The Scattering of a and b Particles by Matter and the Structure of the Atom," Phil. Mag., 21 (1911), 669.</ref> और ग्रहों के मॉडल का सुझाव 1897 की प्रारंभ में दिया गया था जैसे कि [[जोसेफ लारमोर]] द्वारा दिया गया था।<ref>{{Citation |author=Larmor, Joseph |year=1897 |title=On a Dynamical Theory of the Electric and Luminiferous Medium, Part 3, Relations with material media |journal=Philosophical Transactions of the Royal Society |volume=190 |pages=205–300 |doi=10.1098/rsta.1897.0020|bibcode = 1897RSPTA.190..205L |title-link=s:Dynamical Theory of the Electric and Luminiferous Medium III |doi-access=free }} “…that of the transmission of radiation across a medium permeated by molecules, each consisting of a system of electrons in steady orbital motion, and each capable of free oscillations about the steady state of motion with definite free periods analogous to those of the planetary inequalities of the Solar System;”</ref> संभवतः सौर मंडल का सबसे पहला मॉडल 1854 में [[लुडविग अगस्त कोल्डिंग]] द्वारा एक अप्रकाशित नोट में पाया गया था, जिसका विचार था कि परमाणु ग्रहीय प्रणालियों के अनुरूप थे जो घूमते हैं और चुंबकीय ध्रुवीयता का कारण बनते हैं।<ref>Helge Kragh, Niels Bohr and the Quantum Atom: The Bohr Model of Atomic Structure 1913–1925, 2012, Chap. 1, {{ISBN|9780199654987}}, Oxford Scholarship Online, {{doi|10.1093/acprof:oso/9780199654987.001.0001}}</ref> | |||
1908 और 1913 के | |||
=== परमाणु के क्वांटम भौतिक मॉडल की ओर पहला चरण === | |||
{{Main|बोहर मॉडल}} | |||
परमाणु के ग्रहीय मॉडल में दो महत्वपूर्ण दोष थे। पहला यह है कि सूर्य की परिक्रमा करने वाले ग्रहों के विपरीत, इलेक्ट्रॉन आवेशित कण होते हैं। [[शास्त्रीय विद्युत चुंबकत्व|प्राचीन विद्युत चुंबकत्व]] में लार्मर सूत्र के अनुसार एक त्वरित विद्युत आवेश [[विद्युत चुम्बकीय तरंग|विद्युत चुम्बकीय तरंगों]] का उत्सर्जन करने के लिए जाना जाता है। एक कक्षीय आवेश को धीरे-धीरे ऊर्जा खोनी चाहिए और एक सेकंड के एक छोटे से अंश में नाभिक से टकराते हुए उसकी ओर सर्पिल होना चाहिए। दूसरी समस्या यह थी कि ग्रहों का मॉडल अत्यधिक शिखर वाले उत्सर्जन स्पेक्ट्रम और परमाणुओं के [[अवशोषण स्पेक्ट्रम]] की व्याख्या नहीं कर सका जो देखे गए थे। | |||
[[File:Bohr atom animation 2.gif|thumb|right|परमाणु का [[बोहर मॉडल]]]][[क्वांटम यांत्रिकी]] ने 20 वीं शताब्दी की प्रारंभ में भौतिकी में क्रांति ला दी, जब [[मैक्स प्लैंक]] और अल्बर्ट आइंस्टीन ने कहा कि प्रकाश ऊर्जा क्वांटम (एकवचन, क्वांटम) के रूप में जानी जाने वाली असतत [[मात्रा]] में उत्सर्जित या अवशोषित होती है। इसने क्वांटम परमाणु मॉडलों की एक श्रृंखला को जन्म दिया जैसे 1910 में [[आर्थर एरिक हास]] का क्वांटम मॉडल और 1912 में [[जॉन विलियम निकोलसन]] क्वांटम परमाणु मॉडल जिसने कोणीय गति को h/2{{pi}} के रूप में निर्धारित किया।<ref>J. W. Nicholson, Month. Not. Roy. Astr. Soc. lxxii. pp. 49,130, 677, 693, 729 (1912).</ref><ref>The Atomic Theory of John William Nicholson, Russell McCormmach, Archive for History of Exact Sciences, Vol. 3, No. 2 (25.8.1966), pp. 160-184 (25 pages), Springer.</ref> 1913 में, [[नील्स बोह्र]] ने इस विचार को परमाणु के अपने बोह्र मॉडल में सम्मिलित किया, जिसमें एक इलेक्ट्रॉन केवल निश्चित कोणीय गति और ऊर्जा के साथ विशेष गोलाकार कक्षाओं में नाभिक की परिक्रमा कर सकता है, और नाभिक से इसकी दूरी (अर्थात, उनकी त्रिज्या) इसकी ऊर्जा के समानुपाती होती है।<ref name="NBohr">{{cite journal|author=Bohr, Niels|title=On the constitution of atoms and molecules|url=http://www.ffn.ub.es/luisnavarro/nuevo_maletin/Bohr_1913.pdf |archive-url=https://ghostarchive.org/archive/20221009/http://www.ffn.ub.es/luisnavarro/nuevo_maletin/Bohr_1913.pdf |archive-date=2022-10-09 |url-status=live|journal=Philosophical Magazine|year=1913|volume=26|pages=476–502|doi=10.1080/14786441308634993|issue=153|bibcode=1913PMag...26..476B }}</ref> इस मॉडल के अनुसार एक इलेक्ट्रॉन नाभिक में सर्पिल नहीं हो सका क्योंकि यह निरंतर विधियों से ऊर्जा नहीं खो सकता था; इसके अतिरिक्त, यह निश्चित [[ऊर्जा स्तर|ऊर्जा स्तरों]] के मध्य केवल तात्कालिक [[परमाणु इलेक्ट्रॉन संक्रमण]] कर सकता है।<ref name="NBohr"/> जब ऐसा हुआ, तब प्रकाश ऊर्जा (इसलिए असतत स्पेक्ट्रा में प्रकाश का अवशोषण और उत्सर्जन) में परिवर्तन के आनुपातिक आवृत्ति पर उत्सर्जित या अवशोषित किया गया था।<ref name="NBohr"/> | |||
बोर का मॉडल पूर्ण नहीं था। यह केवल हाइड्रोजन की [[वर्णक्रमीय रेखा]]ओं की पूर्वानुमान कर सकता था, बहुइलेक्ट्रॉन परमाणुओं की नहीं कर सकता था।<ref>{{Cite journal |last=Kragh |first=Helge |author-link=Helge Kragh |date=1979 |title=Niels Bohr's Second Atomic Theory |url=https://www.jstor.org/stable/27757389 |journal=Historical Studies in the Physical Sciences |volume=10 |pages=123–186 |doi=10.2307/27757389 |issn=0073-2672}}</ref> इससे भी चिंतित तथ्य यह है कि यह हाइड्रोजन स्पेक्ट्रम की सभी विशेषताओं का आकलन भी नहीं कर सका: जैसे-जैसे [[स्पेक्ट्रोफोटोमेट्री]] में सुधार हुआ, यह पता चला कि एक चुंबकीय क्षेत्र ज़ीमन प्रभाव को इस प्रकार से प्रयुक्त करना कि बोह्र का मॉडल व्याख्या नहीं कर सका। 1916 में, [[अर्नोल्ड सोमरफेल्ड]] ने अतिरिक्त उत्सर्जन रेखाओं की व्याख्या करने के लिए बोह्र मॉडल में अण्डाकार कक्षाएँ जोड़ीं, किन्तु इसने मॉडल का उपयोग करना अधिक कठिन हो गया, और यह अभी भी अधिक सम्मिश्र परमाणुओं की व्याख्या नहीं कर सका।<ref>{{cite book |last=Hentschel |first=Klaus |title=Zeeman Effect |date=2009 |url=https://link.springer.com/10.1007/978-3-540-70626-7_241 |work=Compendium of Quantum Physics |pages=862–864 |editor-last=Greenberger |editor-first=Daniel |place=Berlin, Heidelberg |publisher=Springer Berlin Heidelberg |language=en |doi=10.1007/978-3-540-70626-7_241 |isbn=978-3-540-70622-9 |access-date=2023-02-08 |editor2-last=Hentschel |editor2-first=Klaus |editor3-last=Weinert |editor3-first=Friedel}}</ref><ref>{{Cite journal |last=Eckert |first=Michael |date=April 2014 |title=How Sommerfeld extended Bohr’s model of the atom (1913–1916) |url=http://link.springer.com/10.1140/epjh/e2013-40052-4 |journal=The European Physical Journal H |language=en |volume=39 |issue=2 |pages=141–156 |doi=10.1140/epjh/e2013-40052-4 |issn=2102-6459}}</ref> | |||
=== समस्थानिकों की खोज === | === समस्थानिकों की खोज === | ||
{{Main| | {{Main|आइसोटोप}} | ||
[[रेडियोधर्मी क्षय]] के उत्पादों के साथ प्रयोग करते हुए, 1913 में [[रेडियो रसायन]] [[फ्रेडरिक सोड्डी]] ने पाया कि कुछ तत्वों की एक से अधिक | [[रेडियोधर्मी क्षय]] के उत्पादों के साथ प्रयोग करते हुए, 1913 में [[रेडियो रसायन]] [[फ्रेडरिक सोड्डी]] ने पाया कि कुछ तत्वों की एक से अधिक प्रकार दिखाई देते हैं।<ref>{{cite web | ||
|url=http://nobelprize.org/nobel_prizes/chemistry/laureates/1921/soddy-bio.html | |url=http://nobelprize.org/nobel_prizes/chemistry/laureates/1921/soddy-bio.html | ||
|title=Frederick Soddy, The Nobel Prize in Chemistry 1921 | |title=Frederick Soddy, The Nobel Prize in Chemistry 1921 | ||
|publisher=Nobel Foundation | |publisher=Nobel Foundation | ||
|access-date=2008-01-18 | |access-date=2008-01-18 | ||
}}</ref> इन | }}</ref> इन प्रकारों के लिए उपयुक्त नाम के रूप में [[मार्गरेट टोड (डॉक्टर)]] द्वारा [[आइसोटोप]] शब्द रखा गया था।<ref>{{cite journal|last=Fleck |first=Alexander |year=1957|title=Frederick Soddy|journal=Biographical Memoirs of Fellows of the Royal Society|volume=3|pages=203–216|quote=p. 208: Up to 1913 we used the phrase 'radio elements chemically non-separable' and at that time the word isotope was suggested in a drawing-room discussion with Dr. Margaret Todd in the home of Soddy's father-in-law, Sir [[George Beilby]].|doi=10.1098/rsbm.1957.0014|doi-access=free}}</ref> | ||
उसी वर्ष, जे. जे. थॉमसन ने एक प्रयोग किया जिसमें उन्होंने चुंबकीय और विद्युत क्षेत्रों के माध्यम से [[नियोन|नियॉन]] [[आयन|आयनों]] की एक धारा प्रवाहित की, जो दूसरे छोर पर एक फोटोग्राफिक प्लेट से टकराई। उन्होंने प्लेट पर दो चमकते हुए पैच देखे, जो दो भिन्न-भिन्न विक्षेपण प्रक्षेप पथों का सुझाव देते थे। थॉमसन ने यह निष्कर्ष निकाला कि कुछ नियॉन आयनों का द्रव्यमान भिन्न था।<ref name="thompson3">{{cite journal|author=Thomson, J. J. |url=http://web.lemoyne.edu/~giunta/canal.html | doi = 10.1098/rspa.1913.0057 |title=Rays of positive electricity|journal=Proceedings of the Royal Society|year=1913|volume=A 89|pages=1–20|bibcode = 1913RSPSA..89....1T|issue=607 |doi-access=free}} [as excerpted in Henry A. Boorse & Lloyd Motz, ''The World of the Atom'', Vol. 1 (New York: Basic Books, 1966)]. Retrieved on August 29, 2007.</ref> इस भिन्न द्रव्यमान की प्रकृति को पश्चात् में 1932 में [[न्यूट्रॉन]] की खोज से समझाया जाएगा: एक ही तत्व के सभी परमाणुओं में समान संख्या में प्रोटॉन होते हैं, जबकि विभिन्न समस्थानिकों में न्यूट्रॉन की संख्या भिन्न होती है।<ref>{{cite book|url=https://openstax.org/books/chemistry-2e/pages/21-1-nuclear-structure-and-stability |title=Chemistry 2e |publisher=OpenStax |first1=Paul |last1=Flowers |display-authors=etal |year=2022 |isbn=978-1-947172-61-6 |pages=70–71}}</ref> | |||
===परमाणु कणों की खोज=== | ===परमाणु कणों की खोज=== | ||
{{Main| | {{Main|परमाणु नाभिक|न्यूट्रॉन की खोज}} | ||
1917 में अर्नेस्ट रदरफोर्ड ने [[अल्फा कण]] | 1917 में अर्नेस्ट रदरफोर्ड ने [[अल्फा कण|अल्फा कणों]] के साथ [[नाइट्रोजन]] गैस की बमबारी की और गैस (रदरफोर्ड ने इन्हें पहचाना, क्योंकि उन्होंने पहले उन्हें अल्फा कणों के साथ हाइड्रोजन पर बमबारी करके और उत्पादों में हाइड्रोजन नाभिकों का अवलोकन करते हुए प्राप्त किया था) से निकलने वाले [[हाइड्रोजन]] नाभिकों को देखा। रदरफोर्ड ने निष्कर्ष निकाला कि हाइड्रोजन नाभिक स्वयं नाइट्रोजन परमाणुओं (वास्तव में, उन्होंने नाइट्रोजन को विभाजित किया था) के नाभिक से निकलते हैं।<ref>{{cite journal|author=Rutherford, Ernest|url=http://web.lemoyne.edu/~GIUNTA/rutherford.html |title=Collisions of alpha Particles with Light Atoms. IV. An Anomalous Effect in Nitrogen|journal=Philosophical Magazine|year=1919|volume=37|page=581|doi=10.1080/14786440608635919|issue=222}}</ref> | ||
अपने स्वयं के काम और अपने छात्रों बोह्र और [[हेनरी मोस्ले]] के काम से, रदरफोर्ड जानते थे कि किसी भी परमाणु का धनात्मक आवेश सदैव हाइड्रोजन नाभिकों की पूर्णांक संख्या के सामान्तर हो सकता है। यह, अनेक तत्वों के परमाणु द्रव्यमान के साथ-साथ हाइड्रोजन परमाणुओं की एक पूर्णांक संख्या के सामान्तर होने के साथ जुड़ा हुआ है - जिसे तब सबसे हल्के कण माना जाता था - जिससे उन्हें यह निष्कर्ष निकालना पड़ा कि हाइड्रोजन नाभिक एकल कण थे और सभी परमाणु नाभिकों का एक मूल घटक थे। उन्होंने ऐसे कणों को [[प्रोटॉन]] नाम दिया। रदरफोर्ड द्वारा आगे के प्रयोग में पाया गया कि अधिकांश परमाणुओं का परमाणु द्रव्यमान उसके पास उपस्थित प्रोटॉन से अधिक है; उन्होंने अनुमान लगाया कि यह अधिशेष द्रव्यमान पहले से अज्ञात न्यूट्रल आवेश कणों से बना था, जिन्हें अस्थायी रूप से न्यूट्रॉन करार दिया गया था। | |||
1928 में, [[वाल्टर बोथे]] ने देखा कि अल्फा कणों के साथ बमबारी करने पर बेरिलियम अत्यधिक सूक्ष्म, विद्युत रूप से तटस्थ विकिरण उत्सर्जित करता है। पश्चात् में पता चला कि यह विकिरण [[पैराफिन मोम]] से हाइड्रोजन परमाणुओं को बाहर निकाल सकता है। प्रारंभ में इसे उच्च-ऊर्जा [[गामा विकिरण]] माना जाता था, क्योंकि गामा विकिरण का धातुओं में इलेक्ट्रॉनों पर समान प्रभाव पड़ता था, किन्तु [[जेम्स चाडविक]] ने पाया कि विद्युत चुम्बकीय विकिरण के कारण होने के लिए [[आयनीकरण]] प्रभाव अधिक शक्तिशाली था, जब तक कि ऊर्जा और संवेग वार्तालाप में संरक्षित किया गया। 1932 में, चाडविक ने रहस्यमय बेरिलियम विकिरण के लिए हाइड्रोजन और नाइट्रोजन जैसे विभिन्न तत्वों को प्रकाशित किया, और पुनरावर्तक आवेशित कणों की ऊर्जा को मापकर, उन्होंने निष्कर्ष निकाला कि विकिरण वास्तव में विद्युत रूप से तटस्थ कणों से बना था, जो द्रव्यमान की तरह द्रव्यमान रहित नहीं हो सकता था। गामा किरण, किन्तु इसके अतिरिक्त एक प्रोटॉन के समान द्रव्यमान होना आवश्यक था। चाडविक ने अब प्रमाणित किया कि यह कण रदरफोर्ड के न्यूट्रॉन हैं।<ref>{{cite journal|author=Chadwick, James|year=1932|url=http://web.mit.edu/22.54/resources/Chadwick.pdf |archive-url=https://ghostarchive.org/archive/20221009/http://web.mit.edu/22.54/resources/Chadwick.pdf |archive-date=2022-10-09 |url-status=live |title=Possible Existence of a Neutron|doi=10.1038/129312a0|journal=Nature|page=312|volume=129|bibcode = 1932Natur.129Q.312C|issue=3252|s2cid=4076465|doi-access=free}}</ref> न्यूट्रॉन की खोज के लिए चाडविक को 1935 में नोबेल पुरस्कार मिला।<ref>{{Cite web |title=The Nobel Prize in Physics 1935 |url=https://www.nobelprize.org/prizes/physics/1935/chadwick/facts/ |access-date=2023-02-08 |website=NobelPrize.org |language=en-US}}</ref> | |||
=== परमाणु के क्वांटम भौतिक मॉडल === | |||
{{Main|परमाणु कक्षक}} | |||
[[File:S-p-Orbitals.svg|right|thumb|एक नियॉन परमाणु के पांच भरे हुए परमाणु ऑर्बिटल्स को भिन्न किया गया और बाएं से दाएं बढ़ते ऊर्जा के क्रम में व्यवस्थित किया गया, जिसमें अंतिम तीन ऑर्बिटल्स [[ऊर्जा के स्तर को कम करना]] थे। प्रत्येक कक्षीय में दो इलेक्ट्रॉन होते हैं, जो संभवतः रंगीन बुलबुले द्वारा दर्शाए गए क्षेत्रों में उपस्थित होते हैं। प्रत्येक इलेक्ट्रॉन दोनों कक्षीय क्षेत्रों में समान रूप से उपस्थित होता है, यहां रंग द्वारा केवल विभिन्न तरंग चरण को प्रकाशित करने के लिए दिखाया गया है।]]1924 में, [[लुइस डी ब्रोगली]] ने प्रस्तावित किया कि सभी गतिमान कण-विशेष रूप से इलेक्ट्रॉन जैसे उप-परमाणु कण-कुछ सीमा तक तरंग जैसा व्यवहार प्रदर्शित करते हैं। इस विचार से प्रभावित इरविन श्रोडिंगर ने यह पता लगाया कि परमाणु में इलेक्ट्रॉन की गति को एक कण के अतिरिक्त एक तरंग के रूप में योग्य प्रणाली से समझाया जा सकता है या नहीं। 1926 में प्रकाशित श्रोडिंगर का समीकरण,<ref name="schrodinger">{{cite journal|author=Schrödinger, Erwin|title=Quantisation as an Eigenvalue Problem|journal=Annalen der Physik|volume=81|issue=18|pages=109–139|year=1926|doi=10.1002/andp.19263861802|bibcode = 1926AnP...386..109S }}</ref> एक इलेक्ट्रॉन को एक बिंदु कण के अतिरिक्त एक [[तरंग क्रिया|तरंग फ़ंक्शन]] के रूप में वर्णित करता है। इस दृष्टिकोण ने अनेक वर्णक्रमीय घटनाओं की सुंदर विधि से पूर्वानुमान की है जिसकी बोह्र का मॉडल व्याख्या करने में विफल रहा था। यद्यपि यह अवधारणा गणितीय रूप से सुविधाजनक थी, इसकी कल्पना करना कठिन था, और विरोध का सामना करना पड़ा।<ref name="Mahanti">{{cite news|author=Mahanti, Subodh|url=http://www.vigyanprasar.gov.in/scientists/ESchrodinger.htm|title=Erwin Schrödinger: The Founder of Quantum Wave Mechanics|access-date=2009-08-01|url-status=dead|archive-url=https://web.archive.org/web/20090417074535/http://www.vigyanprasar.gov.in/scientists/ESchrodinger.htm|archive-date=2009-04-17}}</ref> इसके आलोचकों में से एक, [[मैक्स बोर्न]], ने इसके अतिरिक्त प्रस्तावित किया कि श्रोडिंगर के तरंग समारोह ने एक इलेक्ट्रॉन (जैसे प्राचीन विद्युत चुंबकत्व में आवेश वितरण) की भौतिक सीमा का वर्णन नहीं किया, किन्तु यह संभावना दी कि एक इलेक्ट्रॉन को मापने पर एक विशेष बिंदु पर पाया जाएगा।<ref>{{cite news|author=Mahanti, Subodh|url=http://www.vigyanprasar.gov.in/scientists/MBorn.htm|title=Max Born: Founder of Lattice Dynamics|access-date=2009-08-01|url-status=dead|archive-url=https://web.archive.org/web/20090122193755/http://www.vigyanprasar.gov.in/scientists/MBorn.htm|archive-date=2009-01-22}}</ref> इसने तरंग-जैसे और कण-जैसे इलेक्ट्रॉनों के विचारों को समेट लिया: एक इलेक्ट्रॉन, या किसी अन्य उप-परमाणु इकाई के व्यवहार में तरंग- जैसे और कण-जैसे दोनों पहलू होते हैं और एक पहलू या दूसरा अधिक स्पष्ट है या नहीं यह स्थिति पर निर्भर करता है।<ref>{{cite news|author=Greiner, Walter|url=https://books.google.com/books?id=7qCMUfwoQcAC&q=wave-particle+all-particles&pg=PA29 |title=Quantum Mechanics: An Introduction|date = 4 October 2000|isbn = 9783540674580|access-date=2010-06-14}}</ref> | |||
तरंगों के रूप में इलेक्ट्रॉनों का वर्णन करने का एक परिणाम यह है कि एक साथ एक इलेक्ट्रॉन की स्थिति और गति को प्राप्त करना गणितीय रूप से असंभव है। यह सैद्धांतिक भौतिक विज्ञानी [[वर्नर हाइजेनबर्ग]] के पश्चात् हाइजेनबर्ग अनिश्चितता सिद्धांत के रूप में जाना जाने लगा, जिन्होंने पहली बार 1927 में इसका एक संस्करण प्रकाशित किया था।<ref>{{Cite journal |first=W. |last=Heisenberg |title=Über den anschaulichen Inhalt der quantentheoretischen Kinematik und Mechanik |language=de|journal=[[Zeitschrift für Physik]] |volume=43 |issue=3–4 |year=1927 |pages=172–198 |doi=10.1007/BF01397280 |bibcode = 1927ZPhy...43..172H |s2cid=122763326 }}</ref> (हाइजेनबर्ग ने एक विचार प्रयोग का विश्लेषण किया जहां एक हाइजेनबर्ग के माइक्रोस्कोप का प्रयास करता है। एक साथ एक इलेक्ट्रॉन की स्थिति और गति को मापता है। चूंकि, हाइजेनबर्ग ने इन मापों में अनिश्चितता का क्या अर्थ है, इसकी त्रुटिहीन गणितीय परिभाषा नहीं दी। स्थिति-संवेग अनिश्चितता सिद्धांत का त्रुटिहीन गणितीय कथन [[अर्ल हेस्से केनार्ड]], [[वोल्फगैंग पाउली]] और [[हरमन वेइल]] के कारण है।<ref>{{Cite journal|last1=Busch|first1=Paul|author-link1=Paul Busch (physicist) |last2=Lahti|first2=Pekka|last3=Werner|first3=Reinhard F.|date=17 October 2013|title=Proof of Heisenberg's Error-Disturbance Relation|journal=Physical Review Letters|language=en|volume=111|issue=16|pages=160405|doi=10.1103/PhysRevLett.111.160405|pmid=24182239|arxiv=1306.1565|issn=0031-9007|bibcode=2013PhRvL.111p0405B|s2cid=24507489}}</ref><ref>{{Cite journal|last=Appleby|first=David Marcus|date=6 May 2016|title=Quantum Errors and Disturbances: Response to Busch, Lahti and Werner|journal=Entropy|language=en|volume=18|issue=5|pages=174|doi=10.3390/e18050174|arxiv=1602.09002|bibcode=2016Entrp..18..174A|doi-access=free}}</ref>) इसने बोह्र के मॉडल को उसकी स्पष्ट रूप से परिभाषित गोलाकार कक्षाओं के साथ अमान्य कर दिया। [[परमाणु कक्षीय]] मॉडल संभावनाओं के संदर्भ में एक परमाणु में इलेक्ट्रॉनों की स्थिति का वर्णन करता है। एक इलेक्ट्रॉन संभावित रूप से नाभिक से किसी भी दूरी पर पाया जा सकता है, किन्तु, इसके ऊर्जा स्तर और कोणीय गति के आधार पर, नाभिक के आसपास के कुछ क्षेत्रों में दूसरों की तुलना में अधिक बार उपस्थित होता है; इस पैटर्न को इसके परमाणु कक्षीय के रूप में जाना जाता है। कक्षाएँ मध्य में नाभिक के साथ गोलाकार, [[डम्बल]], [[टोरस्र्स|टोरस]] आदि विभिन्न आकारों में आती हैं।<ref>{{cite news|author1=Milton Orchin |author2=Roger Macomber |author3=Allan Pinhas |author4=R. Wilson |url=http://media.wiley.com/product_data/excerpt/81/04716802/0471680281.pdf |archive-url=https://ghostarchive.org/archive/20221009/http://media.wiley.com/product_data/excerpt/81/04716802/0471680281.pdf |archive-date=2022-10-09 |url-status=live |title=The Vocabulary and Concepts of Organic Chemistry, Second Edition|access-date=2010-06-14}}</ref> श्रोडिंगर समीकरण को समाधान करके परमाणु कक्षाओं के आकार पाए जाते हैं; चूंकि, श्रोडिंगर समीकरण के विश्लेषणात्मक समाधान [[हाइड्रोजन परमाणु]] और [[डाइहाइड्रोजन कटियन]] सहित विश्लेषणात्मक समाधानों के साथ क्वांटम-मैकेनिकल सिस्टम की सूची के लिए जाने जाते हैं। यहां तक कि [[हीलियम]] परमाणु- जिसमें सिर्फ दो इलेक्ट्रॉन होते हैं- जिसने पूरी तरह से विश्लेषणात्मक विवेचन के सभी प्रयासों को विफल कर दिया है।<ref>{{Cite book |last=Zwiebach |first=Barton |url=https://www.worldcat.org/oclc/1306066387 |title=Mastering Quantum Mechanics Essentials, Theory, and Applications. |date=2022 |publisher=MIT Press |isbn=0-262-36689-4 |location=Cambridge |pages=281-305 |oclc=1306066387 |author-link=Barton Zwiebach}}</ref><ref>{{Cite journal |last=Grivet |first=Jean-Philippe |date=January 2002 |title=The Hydrogen Molecular Ion Revisited |url=https://pubs.acs.org/doi/abs/10.1021/ed079p127 |journal=Journal of Chemical Education |language=en |volume=79 |issue=1 |pages=127 |doi=10.1021/ed079p127 |issn=0021-9584}}</ref><ref>{{Cite journal |last=Levin |first=F. S. |last2=Shertzer |first2=J. |date=1985-12-01 |title=Finite-element solution of the Schrödinger equation for the helium ground state |url=https://link.aps.org/doi/10.1103/PhysRevA.32.3285 |journal=Physical Review A |language=en |volume=32 |issue=6 |pages=3285–3290 |doi=10.1103/PhysRevA.32.3285 |issn=0556-2791}}</ref> | |||
== यह भी देखें == | == यह भी देखें == | ||
{{Portal|Physics}} | {{Portal|Physics}} | ||
| Line 173: | Line 204: | ||
[[Category: Machine Translated Page]] | [[Category: Machine Translated Page]] | ||
[[Category:Created On 16/02/2023]] | [[Category:Created On 16/02/2023]] | ||
[[Category:Vigyan Ready]] | |||
Latest revision as of 10:05, 11 December 2023
आणविक सिद्धांत वह वैज्ञानिक सिद्धांत है जिसके अनुसार पदार्थ परमाणु नामक कणों से बना होता है। परमाणु सिद्धांत की उत्पत्ति परमाणुवाद नामक एक प्राचीन दार्शनिक परंपरा से हुई है। इस विचार के अनुसार, यदि कोई पदार्थ का एक टुकड़ा लेकर उसे छोटे-छोटे टुकड़ों में काटता है, तब वह अंततः एक ऐसे बिंदु पर पहुंच जाएगा जहां टुकड़ों को और छोटे टुकड़ों में नहीं काटा जा सकता है। प्राचीन यूनानी दर्शन ने पदार्थ के इन काल्पनिक अंतिम कणों को 'परमाणु' कहा था, जिसका अर्थ अविभाजित होता है।
1800 के दशक के प्रारंभ में, वैज्ञानिक जॉन डाल्टन ने देखा कि रासायनिक पदार्थ भार के अनुपात में अन्य पदार्थों में जुड़ते और टूटते हैं, जिससे पता चलता है कि प्रत्येक रासायनिक तत्व अंततः निरंतर भार के छोटे अविभाज्य कणों से बना होता है। 1850 के कुछ समय पश्चात्, कुछ भौतिकविदों ने गैसों और ऊष्मा के गतिज सिद्धांत को विकसित किया, जिसने गणितीय रूप से गैसों के व्यवहार को यह मानते हुए प्रतिरूपित किया कि वह कणों से बने हैं। 20वीं सदी की प्रारंभ में, अल्बर्ट आइंस्टीन और जॉन पेरिन ने सिद्ध किया कि ब्राउनी गति (जल में परागकणों की अनियमित गति) जल के अणुओं की क्रिया के कारण होती है; साक्ष्य की इस तीसरी पंक्ति ने वैज्ञानिकों के मध्य शेष संदेह को शांत कर दिया कि क्या परमाणु और अणु वास्तविक थे। उन्नीसवीं शताब्दी के समय, कुछ वैज्ञानिकों ने आगाह किया था कि परमाणुओं के लिए साक्ष्य अप्रत्यक्ष थे, और इसलिए परमाणु वास्तव में वास्तविक नहीं हो सकते हैं, किन्तु केवल वास्तविक प्रतीत होते हैं।
20वीं शताब्दी के प्रारंभ तक, वैज्ञानिकों ने पदार्थ की संरचना के लिए अधिक विस्तृत और त्रुटिहीन मॉडल विकसित कर लिए थे, जिसके कारण सामान्य पदार्थ बनाने वाले छोटे अदृश्य कणों के लिए अधिक कठोर-परिभाषित वर्गीकरण हुआ। एक परमाणु को अब मूल कण के रूप में परिभाषित किया जाता है जो एक रासायनिक तत्व का निर्माण करता है। 20वीं शताब्दी के अंत में, भौतिकविदों ने पाया कि जिन कणों को रसायनशास्त्री परमाणु कहते हैं, वह वास्तव में और भी छोटे कणों (उपपरमाण्विक कण) के समूह हैं, किन्तु वैज्ञानिकों ने इस नाम को परंपरा से बाहर रखा। 'प्रारंभिक कण' शब्द का उपयोग अब उन कणों को संदर्भित करने के लिए किया जाता है जो वास्तव में अविभाज्य हैं।
इतिहास
दार्शनिक परमाणुवाद
यह विचार कि पदार्थ भिन्न-भिन्न इकाइयों से बना है, एक अधिक पुराना विचार है, जो ग्रीस और भारत सहित अनेक प्राचीन संस्कृतियों में दिखाई देता है। परमाणु शब्द (Greek: ἄτομος;atomos), जिसका अर्थ है अकाट्य, पूर्व-सुकराती यूनानी दार्शनिक ल्यूसिपस और उनके शिष्य डेमोक्रिटस (c.460–c.370 ईसा पूर्व) द्वारा रखा गया था।[1][2][3][4] डेमोक्रिटस ने सिखाया कि परमाणु संख्या में अनंत, अनुपचारित और शाश्वत थे, और यह कि किसी वस्तु के गुण उस प्रकार के परमाणुओं से उत्पन्न होते हैं जो इसे बनाते हैं।[2][3][4] डेमोक्रिटस के परमाणुवाद को पश्चात् के ग्रीक दार्शनिक एपिकुरस (341-270 ईसा पूर्व) और रोमन एपिक्यूरियन कवि ल्यूक्रेटियस (c.99–c.55 ईसा पूर्व) द्वारा परिष्कृत और विस्तृत किया गया था।[3][4] प्रारंभिक मध्य युग के समय, पश्चिमी यूरोप में परमाणुवाद को अधिकतर भुला दिया गया था। 12वीं शताब्दी के समय, अरस्तू के नए-नए खोजे गए लेखों में इसके संदर्भ के माध्यम से पश्चिमी यूरोप में इसे फिर से जाना जाने लगा।[3] अरस्तू द्वारा समर्थित स्थितियों का विरोधी दृष्टिकोण यह था कि पदार्थ निरंतर और अनंत था और इसे असीमित रूप से उप-विभाजित किया जा सकता था।[5][6]
14वीं शताब्दी में, ल्यूक्रेटियस के डी रेरम नेचुरा और डायोजनीज लार्टियस के जीवन और प्रख्यात दार्शनिकों की राय सहित परमाणुवादी शिक्षाओं का वर्णन करने वाले प्रमुख प्राचीन कार्यों की पुनः खोज ने इस विषय पर विद्वानों का ध्यान बढ़ाया। फिर भी, क्योंकि परमाणुवाद महाकाव्यवाद के दर्शन से जुड़ा था, जो रूढ़िवादी ईसाई शिक्षाओं का खंडन करता था, जिस कारण अधिकांश यूरोपीय दार्शनिकों द्वारा परमाणुओं में विश्वास को स्वीकार्य नहीं माना जाता था।[3] फ्रांसीसी कैथोलिक पादरी पियरे गैसेंडी (1592-1655) ने एपिक्यूरियन परमाणुवाद को संशोधनों के साथ पुनर्जीवित किया, यह तर्क देते हुए कि परमाणु भगवान द्वारा बनाए गए थे और चूंकि अधिक अधिक हैं, किन्तु अनंत नहीं हैं। वह पहले व्यक्ति थे जिन्होंने परमाणुओं के एकत्रीकरण का वर्णन करने के लिए अणु शब्द का प्रयोग किया था।[3][4] फ्रांस्वा बर्नियर (1620-1688) और इंग्लैंड में प्राकृतिक दार्शनिक वाल्टर चार्लटन (1619-1707) द्वारा गैसेंडी के परमाणुओं के संशोधित सिद्धांत को फ्रांस में लोकप्रिय बनाया गया था। रसायनज्ञ रॉबर्ट बॉयल (1627-1691) और भौतिक विज्ञानी आइजैक न्यूटन (1642-1727) दोनों ने परमाणुवाद का बचाव किया और 17वीं शताब्दी के अंत तक, वैज्ञानिक समुदाय के कुछ भागों द्वारा इसे स्वीकार कर लिया गया।[3]
डाल्टन का बहु अनुपात का नियम
18वीं शताब्दी के अंत में, परमाणु सिद्धांत की धारणा का उल्लेख किए बिना रासायनिक प्रतिक्रियाओं के बारे में दो नियम सामने आए। पहला द्रव्यमान के संरक्षण का नियम था, जो एंटोनी लेवोइसियर के काम से निकटता से जुड़ा हुआ था, जिसमें कहा गया है कि रासायनिक प्रतिक्रिया में कुल द्रव्यमान स्थिर (अर्थात, अभिकारकों का द्रव्यमान उत्पादों के समान होता है) रहता है।[7] दूसरा निश्चित अनुपात का नियम था। सबसे पहले 1797 में फ्रांसीसी रसायनज्ञ जोसेफ प्राउस्ट द्वारा स्थापित इस नियम में कहा गया है कि यदि किसी यौगिक को उसके घटक रासायनिक तत्वों में तोड़ दिया जाता है तब मूल पदार्थ की मात्रा या स्रोत की चिन्ता किए बिना, घटकों के द्रव्यमान का भार सदैव समान अनुपात में होगा।[8]
जॉन डाल्टन ने स्वयं और अन्य वैज्ञानिकों द्वारा एकत्र किए गए डेटा का अध्ययन किया और एक पैटर्न देखा जो पश्चात् में अनेक अनुपातों के नियम के रूप में जाना जाने लगा। यौगिकों में जिनमें सभी में एक विशेष तत्व होता है, उस तत्व की सामग्री इन यौगिकों में छोटी पूर्ण संख्याओं के अनुपात से भिन्न होगी। इन सब से डाल्टन ने निष्कर्ष निकाला कि तत्व एक दूसरे के साथ असतत और भार की सुसंगत इकाइयों में प्रतिक्रिया करते हैं। डाल्टन ने इन इकाइयों को परमाणु कहने का फैसला किया।
उदाहरण 1 — टिन ऑक्साइड: डाल्टन ने टिन के दो ऑक्साइड की पहचान की। एक ग्रे चूर्ण (जिसे डाल्टन ने प्रोटोऑक्साइड कहा है) है जिसमें टिन के प्रत्येक 100 भागों के लिए ऑक्सीजन का 13.5 भाग होता है। अन्य ऑक्साइड एक सफेद चूर्ण (जिसे डाल्टन ने ड्यूटॉक्साइड कहा है) है जिसमें टिन के प्रत्येक 100 भागों के लिए ऑक्सीजन के 27 भाग होते हैं।[9] 13.5 और 27 जो 1:2 का अनुपात बनाते हैं। डाल्टन ने निष्कर्ष निकाला कि ग्रे ऑक्साइड में प्रत्येक टिन परमाणु के लिए एक ऑक्सीजन परमाणु होता है, और सफेद ऑक्साइड में प्रत्येक टिन परमाणु के लिए दो ऑक्सीजन परमाणु होते हैं। इन ऑक्साइडों को आज क्रमशः टिन(II) ऑक्साइड (SnO) और टिन(IV) ऑक्साइड (SnO2) के नाम से जाना जाता है।
उदाहरण 2 — आयरन ऑक्साइड्स: डाल्टन ने आयरन के दो ऑक्साइडों की पहचान की। एक काला चूर्ण होता है जिसमें आयरन के प्रत्येक 100 भाग में लगभग 28 भाग ऑक्सीजन होता है। दूसरा एक लाल चूर्ण है जिसमें आयरन के प्रत्येक 100 भाग के लिए 42 भाग ऑक्सीजन होता हैं।[10] 28 और 42 का अनुपात 2:3 है। इन ऑक्साइड को आज आयरन (II) ऑक्साइड (जिसे वुस्टाइट के रूप में जाना जाता है) और आयरन (III) ऑक्साइड (जंग का प्रमुख घटक) के रूप में जाना जाता है। इनके आधुनिक सूत्र क्रमशः Fe2O2 और Fe2O3 हैं।
उदाहरण 3 - नाइट्रोजन ऑक्साइड: डाल्टन ने नाइट्रोजन के तीन ऑक्साइड का उल्लेख किया: नाइट्रस ऑक्साइड, नाइट्रस गैस और नाइट्रिक एसिड[11] (इन यौगिकों को आज क्रमशः नाइट्रस ऑक्साइड, नाइट्रिक ऑक्साइड और नाइट्रोजन डाइऑक्साइड के रूप में जाना जाता है)। डाल्टन ने समझा कि "नाइट्रस ऑक्साइड" में 63.3% नाइट्रोजन और 36.7% ऑक्सीजन है, जिसका अर्थ है कि इसमें प्रत्येक 140 ग्राम नाइट्रोजन के लिए 80 ग्राम ऑक्सीजन है। "नाइट्रस गैस" में 44.05% नाइट्रोजन और 55.95% ऑक्सीजन है, जिसका अर्थ है कि प्रत्येक 140 ग्राम नाइट्रोजन में 160 ग्राम ऑक्सीजन होती है। "नाइट्रिक एसिड" में 29.5% नाइट्रोजन और 70.5% ऑक्सीजन है, जिसका अर्थ है कि इसमें प्रत्येक 140 ग्राम नाइट्रोजन के लिए 320 ग्राम ऑक्सीजन है। 80 ग्राम, 160 ग्राम, और 320 ग्राम का अनुपात 1:2:4 है। इन यौगिकों के लिए डाल्टन के सूत्र N2O, NO, और NO2 थे, जो मूलतः आज के समान ही थे।
परमाणु भार का निर्धारण
किसी तत्व का परमाणु भार मापता है कि उस तत्व का परमाणु अन्य तत्वों के परमाणुओं की तुलना में कितना भारी है। डाल्टन और उनके समकालीन परमाणुओं का पूर्ण भार, अर्थात् ग्राम में उनका भार नहीं माप सकते थे।
1803 में डाल्टन ने जल में कार्बन डाइऑक्साइड और नाइट्रोजन जैसी विभिन्न गैसों की घुलनशीलता पर मैनचेस्टर लिटरेरी एंड फिलोसोफिकल सोसाइटी के सामने एक वार्ता में अनेक पदार्थों के सापेक्ष परमाणु भारों की एक सूची का उल्लेख किया। डाल्टन ने यह संकेत नहीं दिया कि उन्होंने सापेक्ष भार कैसे प्राप्त किया, किन्तु उन्होंने प्रारंभ में परिकल्पना की कि घुलनशीलता में भिन्नता द्रव्यमान और गैस कणों की सम्मिश्रता में अंतर के कारण थी - एक विचार जिसे उन्होंने 1805 में पेपर के अंत में प्रकाशित होने तक छोड़ दिया था।[12] वर्षों से, अनेक इतिहासकारों ने डाल्टन के परमाणु सिद्धांत के विकास का श्रेय उनके गैसीय विलेयता के अध्ययन को दिया है, किन्तु उनकी प्रयोगशाला नोटबुक प्रविष्टियों के एक नवीनतम अध्ययन ने निष्कर्ष निकाला कि उन्होंने रासायनिक परमाणु सिद्धांत विकसित किया। 1803 में नाइट्रिक एसिड की संरचना पर कैवेंडिश और लेवोज़ियर के विश्लेषणात्मक डेटा को समेटने के लिए, जल में गैसों की घुलनशीलता की व्याख्या नहीं की गई थी।[13]
थॉमसन (रसायनज्ञ) ने अपनी पुस्तक ए सिस्टम ऑफ केमिस्ट्री के तीसरे संस्करण में डाल्टन के परमाणु सिद्धांत का पहला संक्षिप्त विवरण प्रकाशित किया।[14] 1808 में डाल्टन ने ए न्यू सिस्टम ऑफ केमिकल फिलॉसफी के पहले भाग में एक विस्तृत विवरण प्रकाशित किया।[15] चूंकि, 1811 तक डाल्टन ने बहु अनुपात के अपने सिद्धांत के लिए अपना तर्क प्रदान नहीं किया था।[16]
डाल्टन ने हाइड्रोजन परमाणु को एकता के रूप में लेते हुए, द्रव्यमान अनुपात के अनुसार परमाणु भार का अनुमान लगाया जिसमें वह संयुक्त थे। चूँकि, डाल्टन को यह नहीं पता था कि कुछ तत्व परमाणु अणुओं के रूप में अपने प्राकृतिक शुद्ध रूप में उपस्थित हैं - जैसे शुद्ध ऑक्सीजन O2 के रूप में उपस्थित होती है। उन्होंने यह भी गलती से मान लिया कि किन्हीं दो तत्वों के मध्य के सबसे सरल यौगिक में सदैव प्रत्येक (इसलिए उन्होंने सोचा कि जल HO है H2O नही है) का एक परमाणु होता है।[17] यह, उसके उपकरणों की अशिष्टता के अतिरिक्त, उसके परिणामों में त्रुटिपूर्ण था। उदाहरण के लिए, 1803 में उनका मानना था कि ऑक्सीजन परमाणु हाइड्रोजन परमाणुओं से 5.5 गुना भारी थे, क्योंकि जल में उन्होंने प्रत्येक 1 ग्राम हाइड्रोजन के लिए 5.5 ग्राम ऑक्सीजन मापा और माना कि जल का सूत्र HO था। योग्य डेटा को अपनाते हुए, 1806 में उन्होंने निष्कर्ष निकाला कि ऑक्सीजन का परमाणु भार वास्तव में 5.5 के अतिरिक्त 7 होना चाहिए, और उन्होंने अपने शेष जीवन के लिए इस भार को बनाए रखा। इस समय अन्य लोगों ने पहले से ही अधिक त्रुटिहीन माप से यह निष्कर्ष निकाला था कि यदि कोई जल के अणु (HO) के लिए डाल्टन के सूत्र को मानता है तब ऑक्सीजन परमाणु का वजन हाइड्रोजन के सापेक्ष 8 के सामान्तर होना चाहिए या यदि कोई आधुनिक जल सूत्र (H2O) को मानता है तब 16 होना चाहिए।[18]
अवोगाद्रो
डाल्टन के सिद्धांत में दोष को 1811 में एमेडियो अवोगाद्रो द्वारा सैद्धांतिक रूप से ठीक किया गया था। अवोगाद्रो ने प्रस्तावित किया था कि समान तापमान और दबाव पर किन्हीं दो गैसों के समान आयतन में समान संख्या में अणु (दूसरे शब्दों में, गैस के कणों का द्रव्यमान उस आयतन को प्रभावित नहीं करता है जो इसे घेरे हुए है) होते हैं।[19] अवोगाद्रो के नियम ने उन्हें उन मात्राओं का अध्ययन करके अनेक गैसों की डायटोमिक प्रकृति को कम करने की अनुमति दी, जिस पर उन्होंने प्रतिक्रिया की। उदाहरण के लिए: यह तथ्य कि दो लीटर हाइड्रोजन केवल एक लीटर ऑक्सीजन के साथ प्रतिक्रिया करके दो लीटर जलवाष्प (स्थिर दबाव और तापमान पर) उत्पन्न करेगा, यह सुझाव देता है कि पानी के दो अणु बनाने के लिए एक ऑक्सीजन अणु को दो भागों में विभाजित होना चाहिए। इसका अर्थ यह भी था कि पानी का अणु H2O होना चाहिए। इस प्रकार, अवोगाद्रो ऑक्सीजन और विभिन्न अन्य तत्वों के परमाणु द्रव्यमान का अधिक त्रुटिहीन अनुमान लगाने में सक्षम था, और अणुओं और परमाणुओं के मध्य स्पष्ट अंतर किया।[20] जिसे अब हम परमाणु कहते हैं अवोगाद्रो उसे "प्राथमिक अणु" कहता है, और जिसे अब हम अणु कहते हैं उसे अवोगाद्रो "यौगिक अणु" कहता है।
आइसोमेरिज्म
वैज्ञानिकों ने जल्द ही ऐसे पदार्थों के स्थितियों की खोज की जिनकी आनुपातिक तात्विक संरचना समान है किन्तु गुण भिन्न हैं। उदाहरण के लिए, 1827 में, फ्रेडरिक वॉहलर ने पाया कि सिल्वर फुलमिनेट और सिल्वर साइनेट दोनों 107 भाग सिल्वर, 12 भाग कार्बन, 14 भाग नाइट्रोजन और 12 भाग ऑक्सीजन (अब हम उनके सूत्रों को AgCNO दोनों के रूप में जानते हैं) हैं। वॉहलर ने यह भी पता लगाया कि यूरिया और अमोनियम साइनेट दोनों की संरचना समान (अब हम जानते हैं कि उनके सूत्र CH4N2O हैं) है किन्तु गुण भिन्न-भिन्न हैं। 1830 में, जॉन्स जैकब बर्ज़ेलियस ने इस घटना का वर्णन करने के लिए आइसोमेरिज्म शब्द का प्रारंभ किया था। 1830 के दशक और बाद के अधिकांश रसायनज्ञों ने इस सुझाव को स्वीकार कर लिया कि समरूपता समान संख्या और प्रकार के परमाणुओं की भिन्न-भिन्न व्यवस्था के परिणामस्वरूप हुई, जिसके परिणामस्वरूप भिन्न-भिन्न पदार्थ बने। कार्बनिक रसायन विज्ञान के विकास के साथ आइसोमर्स की संख्या तेजी से बढ़ी, सामान्यतः 1860 के दशक में परमाणु संयोजकता और संरचनात्मक सिद्धांत के प्रारंभ के बाद तेजी से बढ़ी थी। उदाहरण के लिए, पेंटेन (C5H12) पर विचार करें। संयोजकता और संरचना के सिद्धांतों के अनुसार, पेंटेन अणु के लिए तीन संभावित परमाणु विन्यास हैं, और वास्तव में तीन भिन्न-भिन्न पदार्थ हैं जिनकी संरचना पेंटेन के समान है किन्तु भिन्न-भिन्न गुण हैं।
आइसोमेरिज्म कुछ ऐसा नहीं था जिसे परमाणु सिद्धांत के वैकल्पिक सिद्धांतों, जैसे कि कट्टरपंथी सिद्धांत और प्रकारों के सिद्धांत द्वारा पूरी तरह से समझाया जा सकता था।
1860 में, लुई पाश्चर ने परिकल्पना की कि आइसोमर्स के अणुओं की संरचना समान हो सकती है किन्तु उनके परमाणुओं की तीन आयामों में भिन्न-भिन्न व्यवस्था हो सकती है। 1874 में, जेकोबस हेनरिकस वैन टी हॉफ ने प्रस्तावित किया कि कार्बन परमाणु टेट्राहेड्रल व्यवस्था में अन्य परमाणुओं के साथ बंधन बनाता है। इस परिकल्पना से काम करते हुए, वह आइसोमेरिज्म के स्थितियों की व्याख्या कर सकते थे जहां प्रासंगिक अणुओं की मूल कंकाल संरचना समान प्रतीत होती थी; दोनों अणु केवल अपने त्रि-आयामी स्थानिक विन्यास में भिन्न थे, जैसे दो अन्यथा समान बाएँ और दाएँ हाथ, या दो समान सर्पिल जो दक्षिणावर्त और वामावर्त घूमते हैं।
मेंडेलीव की आवर्त सारणी

दिमित्री मेंडेलीव ने देखा कि जब उन्होंने तत्वों को उनके परमाणु भार के अनुसार एक पंक्ति में व्यवस्थित किया, तब उनमें एक निश्चित आवधिकता थी।[21]: 117 उदाहरण के लिए, दूसरा तत्व, लिथियम, के गुण नौवें तत्व से, सोडियम, और सोलहवें तत्व, पोटैशियम - सात की अवधि के समान गुण थे। इसी प्रकार, बेरिलियम, मैगनीशियम और कैल्शियम समान थे और सभी मेंडेलीव की सारणी (आधुनिक तालिका में आठ स्थान भिन्न) पर सभी एक दूसरे से सात स्थानों की दूरी पर थे। इन प्रारूपों का उपयोग करते हुए, मेंडेलीव ने नए तत्वों के अस्तित्व और गुणों की पूर्वानुमान की, जो पश्चात् में प्रकृति में स्कैंडियम, गैलियम और जर्मेनियम में खोजे गए।[21]: 118 इसके अतिरिक्त, आवर्त सारणी यह अनुमान लगा सकती है कि एक परमाणु अन्य तत्वों के कितने परमाणुओं के साथ बंध सकता है - उदाहरण के लिए, जर्मेनियम और कार्बन सारणी पर एक ही समूह में हैं और उनके परमाणु प्रत्येक दो ऑक्सीजन परमाणुओं (GeO2 और CO2) के साथ जुड़ते हैं। मेंडेलीव ने इन प्रारूपों को परिकल्पना की पुष्टि करने के लिए पाया कि पदार्थ परमाणुओं से बना है। क्योंकि इससे पता चला कि तत्वों को उनके परमाणु भार के आधार पर वर्गीकृत किया जा सकता है। एक अवधि के मध्य में एक नया तत्व डालने से उस अवधि और अगले अवधि के मध्य समानता टूट जाएगी, और डाल्टन के एकाधिक अनुपात के नियम का भी उल्लंघन होगा।[22]
ब्राउनियन गति
1827 में, ब्रिटिश वनस्पतिशास्त्री रॉबर्ट ब्राउन (वनस्पतिशास्त्री, जन्म 1773) ने देखा कि जल में तैरते परागकणों के अंदर धूल के कण बिना किसी स्पष्ट कारण के निरंतर हिलते-डुलते रहते हैं। 1905 में, अल्बर्ट आइंस्टीन ने सिद्धांत दिया कि यह ब्राउनियन गति जल के अणुओं द्वारा कण को निरंतर टकराने के कारण हुई, और इसका वर्णन करने के लिए एक गणितीय मॉडल विकसित किया।[23] इस मॉडल को 1908 में फ्रांसीसी भौतिक विज्ञानी जीन पेरिन द्वारा प्रयोगात्मक रूप से मान्य किया गया था, जिन्होंने परमाणुओं के आकार को निर्धारित करने के लिए आइंस्टीन के समीकरणों का उपयोग किया था। इस प्रकार परमाणु सिद्धांत के लिए अतिरिक्त सत्यापन और अणुओं के आकार का एक मात्रात्मक माप प्रदान किया गया।[24]
| अणु | पेरियर की माप | आधुनिक माप |
|---|---|---|
| हीलियम | 1.7 × 10−10 m | 2.6 × 10−10 m |
| आर्गन | 2.7 × 10−10 m | 3.4 × 10−10 m |
| पारा | 2.8 × 10−10 m | 3 × 10−10 m |
| हाइड्रोजन | 2 × 10−10 m | 2.89 × 10−10 m |
| ऑक्सीजन | 2.6 × 10−10 m | 3.46 × 10−10 m |
| नाइट्रोजन | 2.7 × 10−10 m | 3.64 × 10−10 m |
| क्लोरीन | 4 × 10−10 m | 3.20 × 10−10 m |
सांख्यिकीय यांत्रिकी
आदर्श गैस नियम और भौतिकी के सांख्यिकीय रूपों को प्रस्तुत करने के लिए, परमाणुओं के अस्तित्व की पुष्टि करना आवश्यक था। 1738 में, स्विस भौतिक विज्ञानी और गणितज्ञ डेनियल बर्नौली ने माना कि गैसों का दबाव और ऊष्मा दोनों ही अणुओं की अंतर्निहित गति के कारण होते हैं।
1860 में, जेम्स क्लर्क मैक्सवेल, जो परमाणुवाद के मुखर समर्थक थे,वह भौतिकी में सांख्यिकीय यांत्रिकी का उपयोग करने वाले पहले व्यक्ति थे।[25] लुडविग बोल्ट्जमैन और रुडोल्फ क्लॉसियस ने गैसों और ऊष्मप्रवैगिकी के नियमों, विशेष रूप से एन्ट्रापी से संबंधित दूसरे नियम पर अपने काम का विस्तार किया। 1870 के दशक में, योशिय्याह विलार्ड गिब्स ने एंट्रॉपी और ऊष्मप्रवैगिकी के नियमों का विस्तार किया और सांख्यिकीय यांत्रिकी शब्द रखा। आइंस्टीन ने पश्चात् में स्वतंत्र रूप से गिब्स के नियमों को फिर से खोजा, क्योंकि वह केवल एक अस्पष्ट अमेरिकी पत्रिका में छपे थे।[26] आइंस्टीन ने पश्चात् में टिप्पणी की कि यदि उन्हें गिब्स के काम के बारे में पता होता, तब वह उन पत्रों को बिल्कुल भी प्रकाशित नहीं करते, किन्तु स्वयं को कुछ बिंदुओं [जो भिन्न थे] के विवेचन तक ही सीमित रखते।[27] सभी सांख्यिकीय यांत्रिकी और ऊष्मा, गैस और एन्ट्रापी के नियमों ने परमाणुओं के अस्तित्व को एक आवश्यक अवधारणा के रूप में लिया।
उपपरमाण्विक कणों की खोज
1897 तक परमाणुओं को पदार्थ का सबसे छोटा संभव विभाजन माना जाता था जब जे जे थॉमसन ने कैथोड किरणों पर अपने काम के माध्यम से इलेक्ट्रॉन की खोज की।[28]
क्रूक्स ट्यूब सीलबंद ग्लास कंटेनर होता है जिसमें दो इलेक्ट्रोड एक निर्वात द्वारा भिन्न होते हैं। जब इलेक्ट्रोड पर एक वोल्टेज लगाया जाता है, तब कैथोड किरणें उत्पन्न होती हैं, जिससे एक चमकदार पैच बनता है जहां वह ट्यूब के विपरीत छोर पर कांच से टकराते हैं। प्रयोग के माध्यम से, थॉमसन ने पाया कि किरणों को एक विद्युत क्षेत्र (चुंबकीय क्षेत्र के अतिरिक्त, जो पहले से ज्ञात था) द्वारा विक्षेपित किया जा सकता है। उन्होंने निष्कर्ष निकाला कि यह किरणें, प्रकाश का रूप न होकर, अधिक हल्के ऋणात्मक विद्युत आवेशित कणों से बनी थीं। थॉमसन ने इन्हें अणु कण (कणिका) कहा, किन्तु विद्युत आवेश की मूल इकाई के नामकरण के लिए जॉर्ज जॉनस्टोन स्टोनी के 1894 के सुझाव के पश्चात् अन्य वैज्ञानिकों ने उन्हें इलेक्ट्रॉन कहा।[29] उन्होंने द्रव्यमान-से-आवेश अनुपात को मापा और पाया कि यह सबसे छोटे परमाणु हाइड्रोजन से 1800 गुना छोटा था। यह कणिकाएं पहले से ज्ञात किसी अन्य के विपरीत एक कण थीं।
थॉमसन ने सुझाव दिया कि परमाणु विभाज्य हैं, और कणिकाएं उनके निर्माण खंड हैं।[30] परमाणु के समग्र तटस्थ आवेश की व्याख्या करने के लिए, उन्होंने प्रस्ताव दिया कि कणिकाओं को धनात्मक आवेश के एक समान समुद्र में वितरित किया गया था।[31] इसे प्लम पुडिंग मॉडल के रूप में जाना जाता है क्योंकि इलेक्ट्रॉनों को सूखे फल के पुडिंग में फलों के टुकड़ों की तरह धनात्मक आवेश में एम्बेडेड किया गया था, चूंकि थॉमसन ने सोचा था कि इलेक्ट्रॉन परमाणु के अन्दर घूमते रहते हैं।[32]
नाभिक की खोज
थॉमसन के प्लम पुडिंग मॉडल को 1909 में उनके एक पूर्व छात्र, अर्नेस्ट रदरफोर्ड द्वारा अस्वीकृत कर दिया गया था, जिन्होंने पाया कि परमाणु का अधिकांश द्रव्यमान और धनात्मक आवेश इसके आयतन के अधिक छोटे अंश में केंद्रित होता है, जिसे उन्होंने बिल्कुल केंद्र में माना था।
अर्नेस्ट रदरफोर्ड और उनके सहयोगियों हंस गीगर और अर्नेस्ट मार्सडेन को थॉमसन मॉडल के बारे में संदेह हुआ क्योंकि जब उन्होंने अल्फा कणों (यह रेडियम जैसे कुछ रेडियोधर्मी पदार्थों द्वारा उत्सर्जित धनात्मक आवेशित कण हैं) के आवेश-से-द्रव्यमान अनुपात को मापने के लिए एक उपकरण बनाने की कोशिश की तब उन्हें कठिनाइयों का सामना करना पड़ा। डिटेक्शन चैंबर में हवा द्वारा अल्फा कण बिखरे जा रहे थे, जिससे माप अविश्वसनीय हो गए थे। थॉमसन को कैथोड किरणों पर अपने काम में इसी प्रकार की समस्या का सामना करना पड़ा था, जिसे उन्होंने अपने उपकरणों में लगभग पूर्ण निर्वात बनाकर समाधान किया था। रदरफोर्ड ने नहीं सोचा था कि वह इसी समस्या का सामना करेंगे क्योंकि अल्फा कण इलेक्ट्रॉनों की तुलना में अधिक अधिक भारी होते हैं। परमाणु के थॉमसन के मॉडल के अनुसार, परमाणु में धनात्मक आवेश एक अल्फा कण को विक्षेपित करने के लिए पर्याप्त विद्युत क्षेत्र का उत्पादन करने के लिए पर्याप्त रूप से केंद्रित नहीं है, और इलेक्ट्रॉन इतने हल्के होते हैं कि उन्हें अधिक भारी अल्फा कणों द्वारा आसानी से एक तरफ धकेल दिया जाना चाहिए। फिर भी बिखराव हुआ था, इसलिए रदरफोर्ड और उनके सहयोगियों ने इस बिखराव की सावधानी से जांच करने का फैसला किया।[33]
1908 और 1913 के मध्य, रदरफोर्ड और उनके सहयोगियों ने अनेक प्रयोग किए, जिसमें उन्होंने अल्फा कणों के साथ धातु की पतली पन्नी पर बमबारी की। उन्होंने अल्फा कणों को 90° से अधिक कोणों से विक्षेपित होते हुए देखा। इसकी व्याख्या करने के लिए, रदरफोर्ड ने प्रस्ताव दिया कि परमाणु का धनात्मक आवेश परमाणु के पूरे आयतन में वितरित नहीं होता जैसा कि थॉमसन का मानना था, किन्तु केंद्र में एक छोटे से नाभिक में केंद्रित है। आवेश की केवल इतनी सघन सांद्रता ही एक ऐसा विद्युत क्षेत्र उत्पन्न कर सकती है जो अल्फा कणों को विक्षेपित करने के लिए पर्याप्त हो जैसा कि देखा गया है।[33] रदरफोर्ड के मॉडल को कभी-कभी ग्रहीय मॉडल कहा जाता है।[34] चूंकि, हंतारो नागाओका को रदरफोर्ड ने 1904 में ग्रहों के परमाणु का सुझाव देने वाले पहले व्यक्ति के रूप में उद्धृत किया था।[35] और ग्रहों के मॉडल का सुझाव 1897 की प्रारंभ में दिया गया था जैसे कि जोसेफ लारमोर द्वारा दिया गया था।[36] संभवतः सौर मंडल का सबसे पहला मॉडल 1854 में लुडविग अगस्त कोल्डिंग द्वारा एक अप्रकाशित नोट में पाया गया था, जिसका विचार था कि परमाणु ग्रहीय प्रणालियों के अनुरूप थे जो घूमते हैं और चुंबकीय ध्रुवीयता का कारण बनते हैं।[37]
परमाणु के क्वांटम भौतिक मॉडल की ओर पहला चरण
परमाणु के ग्रहीय मॉडल में दो महत्वपूर्ण दोष थे। पहला यह है कि सूर्य की परिक्रमा करने वाले ग्रहों के विपरीत, इलेक्ट्रॉन आवेशित कण होते हैं। प्राचीन विद्युत चुंबकत्व में लार्मर सूत्र के अनुसार एक त्वरित विद्युत आवेश विद्युत चुम्बकीय तरंगों का उत्सर्जन करने के लिए जाना जाता है। एक कक्षीय आवेश को धीरे-धीरे ऊर्जा खोनी चाहिए और एक सेकंड के एक छोटे से अंश में नाभिक से टकराते हुए उसकी ओर सर्पिल होना चाहिए। दूसरी समस्या यह थी कि ग्रहों का मॉडल अत्यधिक शिखर वाले उत्सर्जन स्पेक्ट्रम और परमाणुओं के अवशोषण स्पेक्ट्रम की व्याख्या नहीं कर सका जो देखे गए थे।
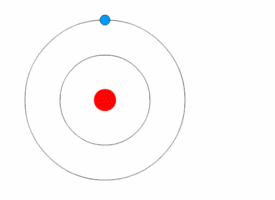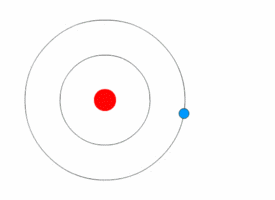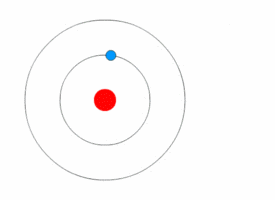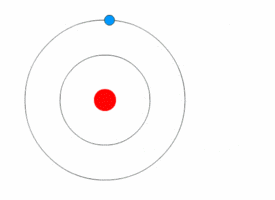
क्वांटम यांत्रिकी ने 20 वीं शताब्दी की प्रारंभ में भौतिकी में क्रांति ला दी, जब मैक्स प्लैंक और अल्बर्ट आइंस्टीन ने कहा कि प्रकाश ऊर्जा क्वांटम (एकवचन, क्वांटम) के रूप में जानी जाने वाली असतत मात्रा में उत्सर्जित या अवशोषित होती है। इसने क्वांटम परमाणु मॉडलों की एक श्रृंखला को जन्म दिया जैसे 1910 में आर्थर एरिक हास का क्वांटम मॉडल और 1912 में जॉन विलियम निकोलसन क्वांटम परमाणु मॉडल जिसने कोणीय गति को h/2π के रूप में निर्धारित किया।[38][39] 1913 में, नील्स बोह्र ने इस विचार को परमाणु के अपने बोह्र मॉडल में सम्मिलित किया, जिसमें एक इलेक्ट्रॉन केवल निश्चित कोणीय गति और ऊर्जा के साथ विशेष गोलाकार कक्षाओं में नाभिक की परिक्रमा कर सकता है, और नाभिक से इसकी दूरी (अर्थात, उनकी त्रिज्या) इसकी ऊर्जा के समानुपाती होती है।[40] इस मॉडल के अनुसार एक इलेक्ट्रॉन नाभिक में सर्पिल नहीं हो सका क्योंकि यह निरंतर विधियों से ऊर्जा नहीं खो सकता था; इसके अतिरिक्त, यह निश्चित ऊर्जा स्तरों के मध्य केवल तात्कालिक परमाणु इलेक्ट्रॉन संक्रमण कर सकता है।[40] जब ऐसा हुआ, तब प्रकाश ऊर्जा (इसलिए असतत स्पेक्ट्रा में प्रकाश का अवशोषण और उत्सर्जन) में परिवर्तन के आनुपातिक आवृत्ति पर उत्सर्जित या अवशोषित किया गया था।[40]
बोर का मॉडल पूर्ण नहीं था। यह केवल हाइड्रोजन की वर्णक्रमीय रेखाओं की पूर्वानुमान कर सकता था, बहुइलेक्ट्रॉन परमाणुओं की नहीं कर सकता था।[41] इससे भी चिंतित तथ्य यह है कि यह हाइड्रोजन स्पेक्ट्रम की सभी विशेषताओं का आकलन भी नहीं कर सका: जैसे-जैसे स्पेक्ट्रोफोटोमेट्री में सुधार हुआ, यह पता चला कि एक चुंबकीय क्षेत्र ज़ीमन प्रभाव को इस प्रकार से प्रयुक्त करना कि बोह्र का मॉडल व्याख्या नहीं कर सका। 1916 में, अर्नोल्ड सोमरफेल्ड ने अतिरिक्त उत्सर्जन रेखाओं की व्याख्या करने के लिए बोह्र मॉडल में अण्डाकार कक्षाएँ जोड़ीं, किन्तु इसने मॉडल का उपयोग करना अधिक कठिन हो गया, और यह अभी भी अधिक सम्मिश्र परमाणुओं की व्याख्या नहीं कर सका।[42][43]
समस्थानिकों की खोज
रेडियोधर्मी क्षय के उत्पादों के साथ प्रयोग करते हुए, 1913 में रेडियो रसायन फ्रेडरिक सोड्डी ने पाया कि कुछ तत्वों की एक से अधिक प्रकार दिखाई देते हैं।[44] इन प्रकारों के लिए उपयुक्त नाम के रूप में मार्गरेट टोड (डॉक्टर) द्वारा आइसोटोप शब्द रखा गया था।[45]
उसी वर्ष, जे. जे. थॉमसन ने एक प्रयोग किया जिसमें उन्होंने चुंबकीय और विद्युत क्षेत्रों के माध्यम से नियॉन आयनों की एक धारा प्रवाहित की, जो दूसरे छोर पर एक फोटोग्राफिक प्लेट से टकराई। उन्होंने प्लेट पर दो चमकते हुए पैच देखे, जो दो भिन्न-भिन्न विक्षेपण प्रक्षेप पथों का सुझाव देते थे। थॉमसन ने यह निष्कर्ष निकाला कि कुछ नियॉन आयनों का द्रव्यमान भिन्न था।[46] इस भिन्न द्रव्यमान की प्रकृति को पश्चात् में 1932 में न्यूट्रॉन की खोज से समझाया जाएगा: एक ही तत्व के सभी परमाणुओं में समान संख्या में प्रोटॉन होते हैं, जबकि विभिन्न समस्थानिकों में न्यूट्रॉन की संख्या भिन्न होती है।[47]
परमाणु कणों की खोज
1917 में अर्नेस्ट रदरफोर्ड ने अल्फा कणों के साथ नाइट्रोजन गैस की बमबारी की और गैस (रदरफोर्ड ने इन्हें पहचाना, क्योंकि उन्होंने पहले उन्हें अल्फा कणों के साथ हाइड्रोजन पर बमबारी करके और उत्पादों में हाइड्रोजन नाभिकों का अवलोकन करते हुए प्राप्त किया था) से निकलने वाले हाइड्रोजन नाभिकों को देखा। रदरफोर्ड ने निष्कर्ष निकाला कि हाइड्रोजन नाभिक स्वयं नाइट्रोजन परमाणुओं (वास्तव में, उन्होंने नाइट्रोजन को विभाजित किया था) के नाभिक से निकलते हैं।[48]
अपने स्वयं के काम और अपने छात्रों बोह्र और हेनरी मोस्ले के काम से, रदरफोर्ड जानते थे कि किसी भी परमाणु का धनात्मक आवेश सदैव हाइड्रोजन नाभिकों की पूर्णांक संख्या के सामान्तर हो सकता है। यह, अनेक तत्वों के परमाणु द्रव्यमान के साथ-साथ हाइड्रोजन परमाणुओं की एक पूर्णांक संख्या के सामान्तर होने के साथ जुड़ा हुआ है - जिसे तब सबसे हल्के कण माना जाता था - जिससे उन्हें यह निष्कर्ष निकालना पड़ा कि हाइड्रोजन नाभिक एकल कण थे और सभी परमाणु नाभिकों का एक मूल घटक थे। उन्होंने ऐसे कणों को प्रोटॉन नाम दिया। रदरफोर्ड द्वारा आगे के प्रयोग में पाया गया कि अधिकांश परमाणुओं का परमाणु द्रव्यमान उसके पास उपस्थित प्रोटॉन से अधिक है; उन्होंने अनुमान लगाया कि यह अधिशेष द्रव्यमान पहले से अज्ञात न्यूट्रल आवेश कणों से बना था, जिन्हें अस्थायी रूप से न्यूट्रॉन करार दिया गया था।
1928 में, वाल्टर बोथे ने देखा कि अल्फा कणों के साथ बमबारी करने पर बेरिलियम अत्यधिक सूक्ष्म, विद्युत रूप से तटस्थ विकिरण उत्सर्जित करता है। पश्चात् में पता चला कि यह विकिरण पैराफिन मोम से हाइड्रोजन परमाणुओं को बाहर निकाल सकता है। प्रारंभ में इसे उच्च-ऊर्जा गामा विकिरण माना जाता था, क्योंकि गामा विकिरण का धातुओं में इलेक्ट्रॉनों पर समान प्रभाव पड़ता था, किन्तु जेम्स चाडविक ने पाया कि विद्युत चुम्बकीय विकिरण के कारण होने के लिए आयनीकरण प्रभाव अधिक शक्तिशाली था, जब तक कि ऊर्जा और संवेग वार्तालाप में संरक्षित किया गया। 1932 में, चाडविक ने रहस्यमय बेरिलियम विकिरण के लिए हाइड्रोजन और नाइट्रोजन जैसे विभिन्न तत्वों को प्रकाशित किया, और पुनरावर्तक आवेशित कणों की ऊर्जा को मापकर, उन्होंने निष्कर्ष निकाला कि विकिरण वास्तव में विद्युत रूप से तटस्थ कणों से बना था, जो द्रव्यमान की तरह द्रव्यमान रहित नहीं हो सकता था। गामा किरण, किन्तु इसके अतिरिक्त एक प्रोटॉन के समान द्रव्यमान होना आवश्यक था। चाडविक ने अब प्रमाणित किया कि यह कण रदरफोर्ड के न्यूट्रॉन हैं।[49] न्यूट्रॉन की खोज के लिए चाडविक को 1935 में नोबेल पुरस्कार मिला।[50]
परमाणु के क्वांटम भौतिक मॉडल

1924 में, लुइस डी ब्रोगली ने प्रस्तावित किया कि सभी गतिमान कण-विशेष रूप से इलेक्ट्रॉन जैसे उप-परमाणु कण-कुछ सीमा तक तरंग जैसा व्यवहार प्रदर्शित करते हैं। इस विचार से प्रभावित इरविन श्रोडिंगर ने यह पता लगाया कि परमाणु में इलेक्ट्रॉन की गति को एक कण के अतिरिक्त एक तरंग के रूप में योग्य प्रणाली से समझाया जा सकता है या नहीं। 1926 में प्रकाशित श्रोडिंगर का समीकरण,[51] एक इलेक्ट्रॉन को एक बिंदु कण के अतिरिक्त एक तरंग फ़ंक्शन के रूप में वर्णित करता है। इस दृष्टिकोण ने अनेक वर्णक्रमीय घटनाओं की सुंदर विधि से पूर्वानुमान की है जिसकी बोह्र का मॉडल व्याख्या करने में विफल रहा था। यद्यपि यह अवधारणा गणितीय रूप से सुविधाजनक थी, इसकी कल्पना करना कठिन था, और विरोध का सामना करना पड़ा।[52] इसके आलोचकों में से एक, मैक्स बोर्न, ने इसके अतिरिक्त प्रस्तावित किया कि श्रोडिंगर के तरंग समारोह ने एक इलेक्ट्रॉन (जैसे प्राचीन विद्युत चुंबकत्व में आवेश वितरण) की भौतिक सीमा का वर्णन नहीं किया, किन्तु यह संभावना दी कि एक इलेक्ट्रॉन को मापने पर एक विशेष बिंदु पर पाया जाएगा।[53] इसने तरंग-जैसे और कण-जैसे इलेक्ट्रॉनों के विचारों को समेट लिया: एक इलेक्ट्रॉन, या किसी अन्य उप-परमाणु इकाई के व्यवहार में तरंग- जैसे और कण-जैसे दोनों पहलू होते हैं और एक पहलू या दूसरा अधिक स्पष्ट है या नहीं यह स्थिति पर निर्भर करता है।[54]
तरंगों के रूप में इलेक्ट्रॉनों का वर्णन करने का एक परिणाम यह है कि एक साथ एक इलेक्ट्रॉन की स्थिति और गति को प्राप्त करना गणितीय रूप से असंभव है। यह सैद्धांतिक भौतिक विज्ञानी वर्नर हाइजेनबर्ग के पश्चात् हाइजेनबर्ग अनिश्चितता सिद्धांत के रूप में जाना जाने लगा, जिन्होंने पहली बार 1927 में इसका एक संस्करण प्रकाशित किया था।[55] (हाइजेनबर्ग ने एक विचार प्रयोग का विश्लेषण किया जहां एक हाइजेनबर्ग के माइक्रोस्कोप का प्रयास करता है। एक साथ एक इलेक्ट्रॉन की स्थिति और गति को मापता है। चूंकि, हाइजेनबर्ग ने इन मापों में अनिश्चितता का क्या अर्थ है, इसकी त्रुटिहीन गणितीय परिभाषा नहीं दी। स्थिति-संवेग अनिश्चितता सिद्धांत का त्रुटिहीन गणितीय कथन अर्ल हेस्से केनार्ड, वोल्फगैंग पाउली और हरमन वेइल के कारण है।[56][57]) इसने बोह्र के मॉडल को उसकी स्पष्ट रूप से परिभाषित गोलाकार कक्षाओं के साथ अमान्य कर दिया। परमाणु कक्षीय मॉडल संभावनाओं के संदर्भ में एक परमाणु में इलेक्ट्रॉनों की स्थिति का वर्णन करता है। एक इलेक्ट्रॉन संभावित रूप से नाभिक से किसी भी दूरी पर पाया जा सकता है, किन्तु, इसके ऊर्जा स्तर और कोणीय गति के आधार पर, नाभिक के आसपास के कुछ क्षेत्रों में दूसरों की तुलना में अधिक बार उपस्थित होता है; इस पैटर्न को इसके परमाणु कक्षीय के रूप में जाना जाता है। कक्षाएँ मध्य में नाभिक के साथ गोलाकार, डम्बल, टोरस आदि विभिन्न आकारों में आती हैं।[58] श्रोडिंगर समीकरण को समाधान करके परमाणु कक्षाओं के आकार पाए जाते हैं; चूंकि, श्रोडिंगर समीकरण के विश्लेषणात्मक समाधान हाइड्रोजन परमाणु और डाइहाइड्रोजन कटियन सहित विश्लेषणात्मक समाधानों के साथ क्वांटम-मैकेनिकल सिस्टम की सूची के लिए जाने जाते हैं। यहां तक कि हीलियम परमाणु- जिसमें सिर्फ दो इलेक्ट्रॉन होते हैं- जिसने पूरी तरह से विश्लेषणात्मक विवेचन के सभी प्रयासों को विफल कर दिया है।[59][60][61]
यह भी देखें
- स्पेक्ट्रोस्कोपी
- आणविक सिद्धांत का इतिहास
- रासायनिक तत्व खोजों की समयरेखा
- क्वांटम यांत्रिकी का परिचय
- गैसों का गतिज सिद्धांत
- अणुवाद
- क्वांटम सिद्धांत के भौतिक सिद्धांत
फुटनोट्स
- ↑ Pullman, Bernard (1998). The Atom in the History of Human Thought. Oxford, England: Oxford University Press. pp. 31–33. ISBN 978-0-19-515040-7.
- ↑ 2.0 2.1 Kenny, Anthony (2004). Ancient Philosophy. A New History of Western Philosophy. Vol. 1. Oxford, England: Oxford University Press. pp. 26–28. ISBN 0-19-875273-3.
- ↑ 3.0 3.1 3.2 3.3 3.4 3.5 3.6 Pyle, Andrew (2010). "Atoms and Atomism". In Grafton, Anthony; Most, Glenn W.; Settis, Salvatore (eds.). The Classical Tradition. Cambridge, Massachusetts and London, England: The Belknap Press of Harvard University Press. pp. 103–104. ISBN 978-0-674-03572-0.
- ↑ 4.0 4.1 4.2 4.3 Cohen, Henri; Lefebvre, Claire, eds. (2017). Handbook of Categorization in Cognitive Science (Second ed.). Amsterdam, The Netherlands: Elsevier. p. 427. ISBN 978-0-08-101107-2.
- ↑ "Welcome to CK-12 Foundation | CK-12 Foundation".
- ↑ Berryman, Sylvia, "Democritus", The Stanford Encyclopedia of Philosophy (Fall 2008 Edition), Edward N. Zalta (ed.), http://plato.stanford.edu/archives/fall2008/entries/democritus
- ↑ Weisstein, Eric W. "Lavoisier, Antoine (1743-1794)". scienceworld.wolfram.com. Retrieved 2009-08-01.
- ↑ "Law of definite proportions | chemistry". Encyclopedia Britannica (in English). Retrieved 2020-09-03.
- ↑ Dalton (1817). A New System of Chemical Philosophy vol. 2, p. 36
- ↑ Dalton (1817). A New System of Chemical Philosophy vol. 2, p. 28
- ↑ Dalton (1808). A New System of Chemical Philosophy vol. 1, pp. 316-319
- ↑ डाल्टन, जॉन। पानी और अन्य तरल पदार्थों द्वारा गैसों के अवशोषण पर, मैनचेस्टर के साहित्यिक और दार्शनिक समाज के संस्मरण में। 1803. 29 अगस्त, 2007 को पुनःप्राप्त।
- ↑ Grossman, Mark I. (2021-01-02). "जॉन डाल्टन का "अहा" क्षण: रासायनिक परमाणु सिद्धांत की उत्पत्ति". Ambix. 68 (1): 49–71. doi:10.1080/00026980.2020.1868861. ISSN 0002-6980. PMID 33577439. S2CID 231909410.
- ↑ "डाल्टन की परमाणु परिकल्पना पर थॉमसन". www.chemteam.info. Retrieved 2021-02-20.
- ↑ Dalton, John (1808). रासायनिक दर्शन की एक नई प्रणाली ... (in English). S. Russell. pp. 211–216.
- ↑ Nicholson, William (1811). ए जर्नल ऑफ नेचुरल फिलॉसफी, केमिस्ट्री एंड द आर्ट्स (in English). G. G. and J. Robinson. pp. 143–151.
- ↑ Johnson, Chris. "Avogadro - his contribution to chemistry". Archived from the original on 2002-07-10. Retrieved 2009-08-01.
- ↑ Alan J. Rocke (1984). Chemical Atomism in the Nineteenth Century. Columbus: Ohio State University Press.
- ↑ Avogadro, Amedeo (1811). "Essay on a Manner of Determining the Relative Masses of the Elementary Molecules of Bodies, and the Proportions in Which They Enter into These Compounds". Journal de Physique. 73: 58–76.
- ↑ Hinshelwood, Cyril N.; Pauling, Linus (1956-10-19). "Amedeo Avogadro". Science (in English). 124 (3225): 708–713. doi:10.1126/science.124.3225.708. ISSN 0036-8075.
- ↑ 21.0 21.1 Scerri, Eric R. (2020). The Periodic Table, Its Story and Its Significance (2nd ed.). New York: Oxford University Press. ISBN 978-0-190-91436-3.
- ↑ Brito, Angmary; Rodríguez, María A.; Niaz, Mansoor. "A Reconstruction of Development of the Periodic Table Based on History and Philosophy of Science and Its Implications for General Chemistry Textbooks". Journal of Research in Science Teaching. 42 (1): 84–111. doi:10.1002/tea.20044.
- ↑ Einstein, A. (1905). "Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen" (PDF). Annalen der Physik. 322 (8): 549–560. Bibcode:1905AnP...322..549E. doi:10.1002/andp.19053220806. hdl:10915/2785.
- ↑ "The Nobel Prize in Physics 1926". NobelPrize.org (in English). Retrieved 2023-02-08.
- ↑ See:
- Maxwell, J.C. (1860) "Illustrations of the dynamical theory of gases. Part I. On the motions and collisions of perfectly elastic spheres," Philosophical Magazine, 4th series, 19 : 19–32.
- Maxwell, J.C. (1860) "Illustrations of the dynamical theory of gases. Part II. On the process of diffusion of two or more kinds of moving particles among one another," Philosophical Magazine, 4th series, 20 : 21–37.
- ↑ Navarro, Luis. “Gibbs, Einstein and the Foundations of Statistical Mechanics.” Archive for History of Exact Sciences, vol. 53, no. 2, Springer, 1998, pp. 147–80, http://www.jstor.org/stable/41134058.
- ↑ Stone, A. Douglas, Einstein and the quantum : the quest of the valiant Swabian, Princeton University Press, (2013). ISBN 978-0-691-13968-5 quoted from Folsing, Albert Einstein, 110.
- ↑ Thomson, J. J. (1897). "Cathode rays" ([facsimile from Stephen Wright, Classical Scientific Papers, Physics (Mills and Boon, 1964)]). Philosophical Magazine. 44 (269): 293. doi:10.1080/14786449708621070.
- ↑ Olenick, Richard P.; Apostol, Tom M.; Goodstein, David L. (1986-12-26). Beyond the Mechanical Universe: From Electricity to Modern Physics (in English). Cambridge University Press. p. 435. ISBN 978-0-521-30430-6.
- ↑ Whittaker, E. T. (1951), A History of the Theories of Aether and Electricity. Vol 1, Nelson, London
- ↑ Thomson, J. J. (1904). "On the Structure of the Atom: an Investigation of the Stability and Periods of Oscillation of a number of Corpuscles arranged at equal intervals around the Circumference of a Circle; with Application of the Results to the Theory of Atomic Structure". Philosophical Magazine. 7 (39): 237. doi:10.1080/14786440409463107.
- ↑ Hon, Giora; Goldstein, Bernard R. (2013-09-06). "J. J. Thomson's plum-pudding atomic model: The making of a scientific myth". Annalen der Physik. 525 (8–9): A129–A133. doi:10.1002/andp.201300732.
- ↑ 33.0 33.1 Heilbron (2003). Ernest Rutherford and the Explosion of Atoms, pp. 64-68
- ↑ "Rutherford model | Definition & Facts". Encyclopedia Britannica (in English). Retrieved 23 August 2021.
- ↑ Rutherford either knew the article or looked it up, for he cited it on the last page of his classic paper, "The Scattering of a and b Particles by Matter and the Structure of the Atom," Phil. Mag., 21 (1911), 669.
- ↑ Larmor, Joseph (1897), , Philosophical Transactions of the Royal Society, 190: 205–300, Bibcode:1897RSPTA.190..205L, doi:10.1098/rsta.1897.0020 “…that of the transmission of radiation across a medium permeated by molecules, each consisting of a system of electrons in steady orbital motion, and each capable of free oscillations about the steady state of motion with definite free periods analogous to those of the planetary inequalities of the Solar System;”
- ↑ Helge Kragh, Niels Bohr and the Quantum Atom: The Bohr Model of Atomic Structure 1913–1925, 2012, Chap. 1, ISBN 9780199654987, Oxford Scholarship Online, doi:10.1093/acprof:oso/9780199654987.001.0001
- ↑ J. W. Nicholson, Month. Not. Roy. Astr. Soc. lxxii. pp. 49,130, 677, 693, 729 (1912).
- ↑ The Atomic Theory of John William Nicholson, Russell McCormmach, Archive for History of Exact Sciences, Vol. 3, No. 2 (25.8.1966), pp. 160-184 (25 pages), Springer.
- ↑ 40.0 40.1 40.2 Bohr, Niels (1913). "On the constitution of atoms and molecules" (PDF). Philosophical Magazine. 26 (153): 476–502. Bibcode:1913PMag...26..476B. doi:10.1080/14786441308634993. Archived (PDF) from the original on 2022-10-09.
- ↑ Kragh, Helge (1979). "Niels Bohr's Second Atomic Theory". Historical Studies in the Physical Sciences. 10: 123–186. doi:10.2307/27757389. ISSN 0073-2672.
- ↑ Hentschel, Klaus (2009). Greenberger, Daniel; Hentschel, Klaus; Weinert, Friedel (eds.). Zeeman Effect. pp. 862–864. doi:10.1007/978-3-540-70626-7_241. ISBN 978-3-540-70622-9. Retrieved 2023-02-08.
{{cite book}}:|work=ignored (help) - ↑ Eckert, Michael (April 2014). "How Sommerfeld extended Bohr's model of the atom (1913–1916)". The European Physical Journal H (in English). 39 (2): 141–156. doi:10.1140/epjh/e2013-40052-4. ISSN 2102-6459.
- ↑ "Frederick Soddy, The Nobel Prize in Chemistry 1921". Nobel Foundation. Retrieved 2008-01-18.
- ↑ Fleck, Alexander (1957). "Frederick Soddy". Biographical Memoirs of Fellows of the Royal Society. 3: 203–216. doi:10.1098/rsbm.1957.0014.
p. 208: Up to 1913 we used the phrase 'radio elements chemically non-separable' and at that time the word isotope was suggested in a drawing-room discussion with Dr. Margaret Todd in the home of Soddy's father-in-law, Sir George Beilby.
- ↑ Thomson, J. J. (1913). "Rays of positive electricity". Proceedings of the Royal Society. A 89 (607): 1–20. Bibcode:1913RSPSA..89....1T. doi:10.1098/rspa.1913.0057. [as excerpted in Henry A. Boorse & Lloyd Motz, The World of the Atom, Vol. 1 (New York: Basic Books, 1966)]. Retrieved on August 29, 2007.
- ↑ Flowers, Paul; et al. (2022). Chemistry 2e. OpenStax. pp. 70–71. ISBN 978-1-947172-61-6.
- ↑ Rutherford, Ernest (1919). "Collisions of alpha Particles with Light Atoms. IV. An Anomalous Effect in Nitrogen". Philosophical Magazine. 37 (222): 581. doi:10.1080/14786440608635919.
- ↑ Chadwick, James (1932). "Possible Existence of a Neutron" (PDF). Nature. 129 (3252): 312. Bibcode:1932Natur.129Q.312C. doi:10.1038/129312a0. S2CID 4076465. Archived (PDF) from the original on 2022-10-09.
- ↑ "The Nobel Prize in Physics 1935". NobelPrize.org (in English). Retrieved 2023-02-08.
- ↑ Schrödinger, Erwin (1926). "Quantisation as an Eigenvalue Problem". Annalen der Physik. 81 (18): 109–139. Bibcode:1926AnP...386..109S. doi:10.1002/andp.19263861802.
- ↑ Mahanti, Subodh. "Erwin Schrödinger: The Founder of Quantum Wave Mechanics". Archived from the original on 2009-04-17. Retrieved 2009-08-01.
- ↑ Mahanti, Subodh. "Max Born: Founder of Lattice Dynamics". Archived from the original on 2009-01-22. Retrieved 2009-08-01.
- ↑ Greiner, Walter (4 October 2000). "Quantum Mechanics: An Introduction". ISBN 9783540674580. Retrieved 2010-06-14.
- ↑ Heisenberg, W. (1927). "Über den anschaulichen Inhalt der quantentheoretischen Kinematik und Mechanik". Zeitschrift für Physik (in Deutsch). 43 (3–4): 172–198. Bibcode:1927ZPhy...43..172H. doi:10.1007/BF01397280. S2CID 122763326.
- ↑ Busch, Paul; Lahti, Pekka; Werner, Reinhard F. (17 October 2013). "Proof of Heisenberg's Error-Disturbance Relation". Physical Review Letters (in English). 111 (16): 160405. arXiv:1306.1565. Bibcode:2013PhRvL.111p0405B. doi:10.1103/PhysRevLett.111.160405. ISSN 0031-9007. PMID 24182239. S2CID 24507489.
- ↑ Appleby, David Marcus (6 May 2016). "Quantum Errors and Disturbances: Response to Busch, Lahti and Werner". Entropy (in English). 18 (5): 174. arXiv:1602.09002. Bibcode:2016Entrp..18..174A. doi:10.3390/e18050174.
- ↑ Milton Orchin; Roger Macomber; Allan Pinhas; R. Wilson. "The Vocabulary and Concepts of Organic Chemistry, Second Edition" (PDF). Archived (PDF) from the original on 2022-10-09. Retrieved 2010-06-14.
- ↑ Zwiebach, Barton (2022). Mastering Quantum Mechanics Essentials, Theory, and Applications. Cambridge: MIT Press. pp. 281–305. ISBN 0-262-36689-4. OCLC 1306066387.
- ↑ Grivet, Jean-Philippe (January 2002). "The Hydrogen Molecular Ion Revisited". Journal of Chemical Education (in English). 79 (1): 127. doi:10.1021/ed079p127. ISSN 0021-9584.
- ↑ Levin, F. S.; Shertzer, J. (1985-12-01). "Finite-element solution of the Schrödinger equation for the helium ground state". Physical Review A (in English). 32 (6): 3285–3290. doi:10.1103/PhysRevA.32.3285. ISSN 0556-2791.
ग्रन्थसूची
- Andrew G. van Melsen (1960) [First published 1952]. From Atomos to Atom: The History of the Concept Atom. Translated by Henry J. Koren. Dover Publications. ISBN 0-486-49584-1.
- J. P. Millington (1906). John Dalton. J. M. Dent & Co. (London); E. P. Dutton & Co. (New York).
- Jaume Navarro (2012). A History of the Electron: J. J. and G. P. Thomson. Cambridge University Press. ISBN 978-1-107-00522-8.
अग्रिम पठन
- Bernard Pullman (1998) The Atom in the History of Human Thought, trans. by Axel Reisinger. Oxford Univ. Press.
- Charles Adolphe Wurtz (1881) The Atomic Theory, D. Appleton and Company, New York.
- Alan J. Rocke (1984) Chemical Atomism in the Nineteenth Century: From Dalton to Cannizzaro, Ohio State University Press, Columbus (open access full text at http://digital.case.edu/islandora/object/ksl%3Ax633gj985).
बाहरी संबंध
- Atomism by S. Mark Cohen.
- Atomic Theory - detailed information on atomic theory with respect to electrons and electricity.
- The Feynman Lectures on Physics Vol. I Ch. 1: Atoms in Motion




