संयुग्म (अम्ल-क्षार सिद्धांत)
ब्रोंस्टेड-लोरी अम्ल-क्षार सिद्धांत के अंतर्गत संयुग्मी अम्ल, ऐसा रासायनिक यौगिक है जब अम्ल प्रोटॉन (H+) क्षार प्रदान करता है- दूसरे शब्दों में, यह हाइड्रोजन आयन के साथ क्षार है, क्योंकि विपरीत प्रतिक्रिया में यह हाइड्रोजन आयन को लुप्त कर देता है। दूसरी ओर, संयुग्मी क्षार वह होता है जो रासायनिक प्रतिक्रिया के समय अम्ल द्वारा प्रोटॉन प्रदान करने के पश्चात बचा रहता है। इसलिए, संयुग्म क्षार अम्ल से अवक्षेपण द्वारा बनाई गई प्रजाति है, क्योंकि विपरीत प्रतिक्रिया में यह हाइड्रोजन आयन प्राप्त करने में सक्षम है।[1] क्योंकि पॉलीप्रोटिक अम्ल कई प्रोटॉन प्रारंभ करने में सक्षम हैं, अम्ल का संयुग्मित क्षार स्वयं अम्लीय हो सकता है।
संक्षेप में, इसे निम्नलिखित रासायनिक प्रतिक्रिया के रूप में दर्शाया जा सकता है:
जोहान्स निकोलस ब्रोंस्टेड और मार्टिन लोरी ने ब्रोंस्टेड-लोरी सिद्धांत प्रस्तुत किया, जिसने प्रस्तावित किया कि कोई भी यौगिक जो प्रोटॉन को किसी अन्य यौगिक में स्थानांतरित कर सकता है, वह अम्ल है, और वह यौगिक जो प्रोटॉन को स्वीकार करता है, वह क्षार है। प्रोटॉन परमाणु कण है जिसमें एक इकाई सकारात्मक विद्युत आवेश होता है; इसे प्रतीक H+ द्वारा दर्शाया गया है क्योंकि यह हाइड्रोजन परमाणु के परमाणु नाभिक का गठन करता है,[2] जो कि हाइड्रोन धनायन है।
धनायन संयुग्मित अम्ल हो सकता है, और ऋणायन संयुग्मी क्षार हो सकता है, यह इस बात पर निर्भर करता है कि कौन सा रासायनिक पदार्थ सम्मिलित है और कौन सा अम्ल-क्षार सिद्धांत दृष्टिकोण है। सबसे सरल ऋणायन जो संयुग्मित क्षार हो सकता है, वह विलायकित इलेक्ट्रॉन है जिसका संयुग्मी अम्ल परमाणु हाइड्रोजन है।
अम्ल-क्षार प्रतिक्रियाएँ
अम्ल-क्षार प्रतिक्रिया में, अम्ल, क्षार, संयुग्मी क्षार और संयुग्मी अम्ल बनाने के लिए प्रतिक्रिया करता है। अम्ल प्रोटॉन को लुप्त कर देता है और क्षार प्रोटॉन प्राप्त कर लेता है। रासायनिक आरेखों में जो इसे स्पष्ट करते हैं, क्षार और प्रोटॉन के मध्य बनाये नए बंधन को तीर द्वारा दिखाया गया है जो पारंपरिक रूप से क्षार से इलेक्ट्रॉन जोड़ी पर प्रारंभ होता है और जिसका तीर-शीर्ष हाइड्रोजन आयन (प्रोटॉन) पर समाप्त होता है जिसे स्थानांतरित किया जाएगा:
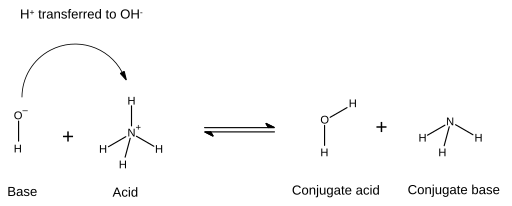
- इस स्थिति में, पानी का अणु हाइड्रॉक्साइड आयन का संयुग्मित अम्ल होता है, जिसे पश्चात में अमोनियम द्वारा प्रदान किए गए हाइड्रोजन आयन से प्राप्त किया जाता है। दूसरी ओर, अमोनिया अम्ल अमोनियम के लिए संयुग्मित क्षार है, क्योंकि अमोनियम ने हाइड्रोजन आयन प्रदान किया है और पानी के अणु का उत्पादन किया है। साथ ही, OH− को H
2O का संयुग्म क्षार माना जा सकता है, क्योंकि विपरीत प्रतिक्रिया में पानी का अणु NH+
4 देने के लिए प्रोटॉन प्रदान करता है। अम्ल, क्षार, संयुग्मी अम्ल और संयुग्मी क्षार निश्चित रासायनिक प्रजाति के लिए तय नहीं हैं, किंतु होने वाली प्रतिक्रिया के अनुसार विनिमेय हैं।
संयुग्मों की शक्ति
संयुग्मित अम्ल की शक्ति सीधे उसके पृथक्करण स्थिरांक के समानुपाती होती है। यदि संयुग्मित अम्ल स्थिर है, तो इसका पृथक्करण उच्च संतुलन स्थिरांक होगा और प्रतिक्रिया के उत्पादों का पक्ष लिया जाएगा। संयुग्म क्षार की स्थिरता को प्रजातियों की प्रवृत्ति के रूप में हाइड्रोजन प्रोटॉन को अपनी ओर खींचने के रूप में देखा जा सकता है। यदि संयुग्म क्षार को स्थिरता के रूप में वर्गीकृत किया जाता है, तो यह विलयन में होने पर हाइड्रोजन प्रोटॉन को पकड़ लेगा और इसका अम्ल पृथक्क नहीं होगा।
यदि प्रजाति को स्थिरता अम्ल के रूप में वर्गीकृत किया जाता है, तो इसका संयुग्म क्षार निर्बल होगा।[3] इस स्थिति का उदाहरण हाइड्रोक्लोरिक अम्ल HCl का प्रबल अम्ल है (यह अधिक सीमा तक वियोजित हो जाता है), इसका संयुग्मी क्षार (Cl−
) निर्बल संयुग्म क्षार होगा। इसलिए, इस प्रणाली में, अधिकांश H+
हाइड्रोनियम आयन के रूप में होगा। H
3O+
इसके अतिरिक्त CL− आयन से जुड़ा हुआ है और संयुग्मित क्षार पानी के अणु से स्थिर होगा।
दूसरी ओर, यदि प्रजाति को स्थिर अम्ल के रूप में वर्गीकृत किया जाता है, तो इसका संयुग्म क्षार स्थिर क्षार नहीं होगा। विचार करें कि एसीटेट, एसिटिक अम्ल का संयुग्म आधा, लगभग 5.6×10−10 का क्षार पृथक्करण स्थिरांक (Kb) है, जो इसे स्थिर क्षार बनाता है। प्रजाति के लिए स्थिर संयुग्म क्षार होने के लिए यह अधिक स्थिर अम्ल होना चाहिए, उदाहरण के लिए पानी है।
संयुग्म अम्ल-क्षार युग्मों की पहचान करना
संयुग्मी अम्ल की पहचान करने के लिए, संबंधित यौगिकों के युग्म को देखें। अम्ल-क्षार प्रतिक्रिया को पूर्व और पश्चात के अर्थ में देखा जा सकता है। पूर्व समीकरण का अभिकारक पक्ष है, पश्चात वाला समीकरण का उत्पाद पक्ष है। समीकरण के पश्चात के पक्ष में संयुग्मी अम्ल हाइड्रोजन आयन प्राप्त करता है, इसलिए समीकरण के पूर्व पक्ष में संयुग्म अम्ल कम हाइड्रोजन आयन वाला यौगिक क्षार होता है। समीकरण के पश्चात के पक्ष में संयुग्म क्षार ने हाइड्रोजन आयन को लुप्त कर देता है, इसलिए समीकरण के पूर्व पक्ष में, यौगिक जिसमें संयुग्म क्षार का हाइड्रोजन आयन है वह अम्ल है।
निम्नलिखित अम्ल-क्षार प्रतिक्रिया पर विचार करें:
3 + H
2O → H
3O+
+ NO−
3
नाइट्रिक अम्ल (HNO
3) वह अम्ल है क्योंकि यह पानी के अणु को प्रोटॉन देता है और इसका संयुग्मी क्षार नाइट्रेट (NO−
3) है, पानी का अणु क्षार के रूप में कार्य करता है क्योंकि यह हाइड्रोजन केशन (प्रोटॉन) को प्राप्त करता है और इसका संयुग्मित अम्ल हाइड्रोनियम आयन (H
3O+
) है।
| समीकरण | अम्ल | क्षार | संयुग्म क्षार | संयुग्म अम्ल |
|---|---|---|---|---|
| HClO 2 + H 2O → ClO− 2 + H 3O+ |
[[chlorous acid|HClO 2]] |
[[Properties of water|H 2O]] |
[[chlorite|ClO− 2]] |
[[hydronium|H 3O+ ]] |
| ClO− + H 2O → HClO + OH− |
H 2O |
[[hypochlorite|ClO− ]] |
[[hydroxide|OH− ]] |
[[Hypochlorous acid|HClO]] |
| HCl + H 2PO− 4 → Cl− + H 3PO 4 |
[[hydrochloric acid|HCl]] | [[phosphate#Chemical properties|H 2PO− 4]] |
[[chloride|Cl− ]] |
[[phosphoric acid|H 3PO 4]] |
अनुप्रयोग
संयुग्म अम्ल और क्षार का उपयोग बफ़रिंग प्रणाली में निहित है, जिसमें बफर विलयन सम्मिलित है। अनुमापन प्रक्रिया के समय पीएच परिवर्तन को सीमित करने के लिए बफर में, स्थिर अम्ल और इसके संयुग्मित क्षार (नमक के रूप में), या स्थिर क्षार और इसके संयुग्मित अम्ल का उपयोग किया जाता है। बफ़र्स में कार्बनिक और अकार्बनिक रासायनिक अनुप्रयोग दोनों होते हैं। उदाहरण के लिए, प्रयोगशाला प्रक्रियाओं में उपयोग किए जाने वाले बफ़र्स के अतिरिक्त, मानव रक्त पीएच को बनाए रखने के लिए बफर के रूप में कार्य करता है। हमारे रक्तप्रवाह में सबसे महत्वपूर्ण बफर बाइकार्बोनेट बफरिंग है। जो CO
2 होने पर पीएच परिवर्तन का अवरोध करता है:
CO
2 + H2O <=> H2CO3 <=> HCO3- + H+
इसके अतिरिक्त, यहां सामान्य बफ़र्स की सारणी है।
| बफरिंग एजेंट | pKa | उपयोगी पीएच श्रेणी |
|---|---|---|
| सिट्रिक अम्ल | 3.13, 4.76, 6.40 | 2.1 - 7.4 |
| एसिटिक अम्ल | 4.8 | 3.8 - 5.8 |
| KH2PO4 | 7.2 | 6.2 - 8.2 |
| चेस | 9.3 | 8.3–10.3 |
| बोरेट | 9.24 | 8.25 - 10.25 |
कार्बनिक यौगिक के साथ दूसरा सामान्य अनुप्रयोग एसिटिक अम्ल के साथ बफर का उत्पादन होगा। यदि एसिटिक एसिड, सूत्र के साथ स्थिर अम्ल CH
3COOH, बफर विलयन में बनाया गया था, इसे इसके संयुग्मित क्षार CH
3COO−
के साथ नमक के रूप में संयोजित करने की आवश्यकता होगी। परिणामी मिश्रण को एसीटेट बफर कहा जाता है, जिसमें जलीय CH
3COOH और CH
3COONa होता है एसिटिक एसिड, कई अन्य स्थिर अम्ल के साथ, विभिन्न प्रयोगशाला सेटिंग्स में बफ़र्स के उपयोगी घटकों के रूप में कार्य करता है, प्रत्येक अपने स्वयं के पीएच श्रेणी के भीतर उपयोगी होता है।
रिंगर का लैक्टेट विलयन का उदाहरण है जहां कार्बनिक अम्ल, लैक्टिक अम्ल का संयुग्म क्षार CH
3CH(OH)CO−
2 को आसुत जल में सोडियम, कैल्शियम और पोटेशियम केशन और क्लोराइड आयनों के साथ संयुक्त है[4] जो मिलकर तरल पदार्थ बनाते हैं जो मानव रक्त के संबंध में आइसोटोनिक होता है और शारीरिक आघात, सर्जरी या जलने के कारण रक्त की हानि के पश्चात द्रव प्रतिस्थापन के लिए उपयोग किया जाता है।[5]
अम्लों और उनके संयुग्मी क्षारों की सारणी
अम्लों और उनके संयुग्मी क्षारों के अनेक उदाहरण नीचे सारणीबद्ध हैं; ध्यान दें कि वे केवल प्रोटॉन (H+ आयन) से कैसे भिन्न होते हैं। अम्ल की स्थिरता कम हो जाती है और टेबल के नीचे संयुग्म क्षार की स्थिरता बढ़ जाती है।
| अम्ल | संयुग्म क्षार |
|---|---|
| H 2F+ फ्लोरोनियम आयन |
HF हाइड्रोजन फ्लोराइड |
| HCl हाइड्रोक्लोरिक अम्ल | Cl− क्लोराइड आयन |
| H2SO4 सल्फ्यूरिक अम्ल | HSO− 4 हाइड्रोजन सल्फेट आयन (बाईसल्फेट आयन) |
| HNO3 नाइट्रिक अम्ल | NO− 3 नाइट्रेट आयन |
| H3O+ हाइड्रोनियम आयन | H2O पानी |
| HSO− 4 हाइड्रोजन सल्फेट आयन |
SO2− 4 सल्फेट आयन |
| H3PO4 फॉस्फोरिक अम्ल | H2PO− 4 डिहाइड्रोजनफास्फेट आयन |
| CH3COOH एसिटिक अम्ल | CH3COO− एसीटेट आयन |
| HF हाइड्रोफ्लोरिक अम्ल | F− फ्लोराइड आयन |
| H2CO3 कार्बनिक अम्ल | HCO− 3 हाइड्रोजन कार्बोनेट आयन |
| H2S हाइड्रोसल्फ्यूरिक अम्ल | HS− हाइड्रोसल्फाइड आयन |
| H2PO− 4 डिहाइड्रोजन फास्फेट आयन |
HPO2− 4 हाइड्रोजन फास्फेट आयन |
| NH+ 4 अमोनियम आयन |
NH3 अमोनिया |
| H2O पानी (pH=7) | OH− हाइड्राऑक्साइड आयन |
| HCO− 3 हाइड्रोजनकार्बोनेट (बाईकार्बोनेट) आयन |
CO2− 3 कार्बोनेट आयन |
क्षारों की सारणी और उनके संयुग्मी अम्ल
इसके विपरीत, यहाँ क्षारों और उनके संयुग्मी अम्लों की सारणी है। इसी प्रकार, क्षार शक्ति घट जाती है और टेबल के नीचे संयुग्म अम्ल की स्थिरता बढ़ जाती है।
| Base | Conjugate अम्ल |
|---|---|
| C 2H 5NH 2 एथिलामिने |
C 2H 5NH+ 3 एथिलअमोनियम आयन |
| CH 3NH 2 मिथाइलमाइन |
CH 3NH+ 3 मिथाइलअमोनियम आयन |
| NH 3 अमोनिया |
NH+ 4 अमोनियम आयन |
| C 5H 5N पिरिडीन |
C 5H 6N+ पिरिडीनियम |
| C 6H 5NH 2 अनिलिन |
C 6H 5NH+ 3 फेनिलमोनियम आयन |
| C 6H 5CO− 2 बेंजोएटआयन |
C 6H 6CO 2 बेंज़ोइक एसिड |
| F− फ्लोराइड आयन |
HF हाइड्रोजिन फ्लोराइड |
| पीओ3− 4 फास्फेट आयन |
एचपीओ2− 4 मोनोहाइड्रोजन फॉस्फेट आयन |
| ओह− हीड्राकसीड आयन | एच2ओ पानी (तटस्थ, पीएच 7) |
| HCO− 3 बिकारबोनिट |
H 2CO 3 कार्बोनिक एसिड |
| CO2− 3 कार्बोनेट आयन |
HCO− 3 बाइकार्बोनेट |
| Br− ब्रोमाइड आयन |
HBr हाइड्रोजन ब्रोमाइड |
| HPO2− 4 मोनोहाइड्रोजन फॉस्फेट |
H 2PO− 4 डाइहाइड्रोजन फॉस्फेट आयन |
| Cl− क्लोराइड आयन |
HCl हाइड्रोजन क्लोराइड |
| H 2O पानी |
H 3O+ हाइड्रोनियम आयन |
| नाइट्राट आयन | नाइट्रस अम्ल |
यह भी देखें
- बफर द्रावण
- अवक्षेपण
- प्रोटोनेशन
- नमक (रसायन विज्ञान)
संदर्भ
- ↑ Zumdahl, Stephen S., & Zumdahl, Susan A. Chemistry. Houghton Mifflin, 2007, ISBN 0618713700
- ↑ "Brønsted–Lowry theory | chemistry". Encyclopedia Britannica (in English). Retrieved 2020-02-25.
- ↑ "संयुग्म अम्ल और क्षार रसायन ट्यूटोरियल की शक्ति". www.ausetute.com.au. Retrieved 2020-02-25.
- ↑ British national formulary: BNF 69 (69 ed.). British Medical Association. 2015. p. 683. ISBN 9780857111562.
- ↑ Pestana, Carlos (7 April 2020). पेस्टाना की सर्जरी नोट्स (Fifth ed.). Kaplan Medical Test Prep. pp. 4–5. ISBN 978-1506254340.


