आईटीआईईएस
विधुत रसायन में, ITIES (दो अमिश्रणीय इलेक्ट्रोलाइट विलयनों के बीच अंतरपृष्ठ)[1][2][3] एक वैद्युतरासायनिक अंतरपृष्ठ है जो या तो ध्रुवीकरण योग्य या ध्रुवीकृत है। एक आईटीईएस ध्रुवीकरण योग्य है यदि कोई गैल्वनिक विभवान्तर को बदल सकता है, या दूसरे शब्दों में, दो आसन्न चरणों के बीच आंतरिक क्षमता के अंतर को, संबंधित चरणों की रासायनिक संरचना में उल्लेखनीय परिवर्तन किए बिना (अर्थात अंतरपृष्ठ पर ध्यान देने योग्य विद्युत रासायनिक प्रतिक्रियाओं के बिना)। यदि दो चरणों के बीच विभिन्न आवेशों और रिडॉक्स प्रजातियों का वितरण गैल्वनिक विभवान्तर निर्धारित करता है, तो एक ITIES प्रणाली ध्रुवीकृत हो जाती है।
सामान्यतः, एक इलेक्ट्रोलाइट एक जलीय इलेक्ट्रोलाइट होता है जो पानी में घुले NaCl जैसे जलस्नेही आयनों से बना होता है और दूसरा इलेक्ट्रोलाइट एक वसारागी नमक होता है जैसे कि टेट्राब्यूटाइलमोनियम टेट्राफेनिलबोरेट, जो नाइट्रोबेन्जीन या 1,2-डाइक्लोरोइथेन जैसे जल के साथ अमिश्रणीय कार्बनिक विलायक में घुल जाता है।
आईटीआईईएस की आवेश स्थानांतरण अभिक्रियाएं
ITIES में आवेश स्थानांतरण प्रतिक्रियाओं के तीन प्रमुख वर्गों का अध्ययन किया जा सकता है:
- आयन स्थानांतरण अभिक्रियाएँ
- सहायक आयन स्थानांतरण अभिक्रियाएँ
- विषम इलेक्ट्रॉन स्थानांतरण अभिक्रियाएँ
आयन स्थानांतरण अभिक्रिया के लिए नर्नस्ट समीकरण बताता है
- ,
जहाँ वोल्टेज स्केल में व्यक्त स्थानांतरण की गिब्स ऊर्जा के रूप में परिभाषित मानक स्थानांतरण क्षमता है।
एकल विषम इलेक्ट्रॉन स्थानांतरण अभिक्रिया के लिए नर्नस्ट समीकरण बताता है
- ,
जहाँ इलेक्ट्रॉनों के अंतरापृष्ठीय स्थानांतरण के लिए मानक रेडॉक्स क्षमता है जिसे दो रेडॉक्स जोड़ों की मानक रेडॉक्स क्षमता के अंतर के रूप में परिभाषित किया गया है लेकिन इसे जलीय मानक हाइड्रोजन इलेक्ट्रोड (एसएचई) कहा जाता है।
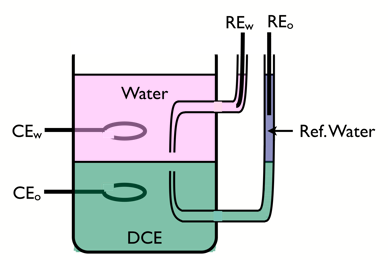
चार-इलेक्ट्रोड सेल
ITIES की आवेश स्थानांतरण अभिक्रियाओं का अध्ययन करने के लिए, चार-इलेक्ट्रोड सेल का उपयोग किया जाता है।
अंतरपृष्ठ के ध्रुवीकरण को नियंत्रित करने के लिए दो संदर्भ इलेक्ट्रोड का उपयोग किया जाता है, और विद्युत प्रवाह को पारित करने के लिए उत्कृष्ट धातुओं से बने दो काउंटर इलेक्ट्रोड का उपयोग किया जाता है। जलीय सहायक इलेक्ट्रोलाइट जलंरागीहोना चाहिए, जैसे LiCl, और कार्बनिक इलेक्ट्रोलाइट वसारागी होना चाहिए, जैसे टेट्राहेप्टाइलमोनियम टेट्रा-पेंटाफ्लोरोफेनिल बोरेट।
आयन विभाजन गुणांक और आयन वितरण गुणांक
एक उदासीन विलेय के विपरीत, एक आयन का विभाजन गुणांक दो चरणों के बीच गैल्वनिक विभवान्तर पर निर्भर करता है:
वितरण क्षमता
जब नमक को दो चरणों के बीच वितरित किया जाता है, तो गैल्वनिक विभवान्तर को वितरण क्षमता कहा जाता है और इसे पढ़ने के लिए धनायन C+ और ऋणायन A- के लिए संबंधित नर्नस्ट समीकरणों से प्राप्त किया जाता है
जहां γ सक्रियता गुणांक का प्रतिनिधित्व करता है।
यह भी देखें
संदर्भ
- ↑ Hung, Le Quoc (1980-12-23). "Electrochemical properties of the interface between two immiscible electrolyte solutions: Part I. Equilibrium situation and galvani potential difference". Journal of Electroanalytical Chemistry. 115 (2): 159–174. doi:10.1016/S0022-0728(80)80323-8. ISSN 0022-0728.
- ↑ Hung, Le Quoc (1983-07-08). "Electrochemical properties of the interface between two immiscible electrolyte solutions: Part III. The general case of the galvani potential difference at the interface and of the distribution of an arbitrary number of components interacting in both phases". Journal of Electroanalytical Chemistry. 149 (1–2): 1–14. doi:10.1016/S0022-0728(83)80553-1. ISSN 0022-0728.
- ↑ Samec, Zdenek (1988-06-01). "Electrical double layer at the interface between two immiscible electrolyte solutions". Chemical Reviews. 88 (4): 617–632. doi:10.1021/cr00086a003.