परमाणु बंधन ऊर्जा
| परमाणु भौतिकी |
|---|
 |
| नाभिक · न्यूक्लियन s ( p, n) · परमाणु मामला · परमाणु बल · परमाणु संरचना · परमाणु प्रतिक्रिया |
प्रायोगिक भौतिकी में परमाणु बंधन ऊर्जा वह न्यूनतम ऊर्जा है जो किसी परमाणु के नाभिक को उसके घटक प्रोटॉन और न्यूट्रॉन में विभाजित करने के लिए आवश्यक होती है, जिन्हें सामूहिक रूप से न्यूक्लियॉन के रूप में जाना जाता है। स्थिर नाभिक के लिए बंधन ऊर्जा सदैव एक धनात्मक संख्या होती है, क्योंकि नाभिक को एक दूसरे से अलग होने के लिए ऊर्जा प्राप्त करनी होती है। प्रबल परमाणु बल के कारण न्यूक्लियॉन एक दूसरे की ओर आकर्षित होते हैं। सैद्धांतिक परमाणु भौतिकी में, परमाणु बंधन ऊर्जा को एक ऋणात्मक संख्या माना जाता है। इस संदर्भ में यह घटक नाभिकों की ऊर्जा के सापेक्ष नाभिक की ऊर्जा का प्रतिनिधित्व करता है जब वे अनंत रूप से दूर होते हैं। प्रयोगात्मक और सैद्धांतिक दोनों विचार समतुल्य हैं, बंधन ऊर्जा का क्या अर्थ है, इस पर थोड़ा अलग जोर दिया गया है।
एक परमाणु नाभिक का द्रव्यमान मुक्त घटक: प्रोटॉन और न्यूट्रॉन के व्यक्तिगत द्रव्यमान के योग से कम होता है। द्रव्यमान में अंतर की गणना आइंस्टीन समीकरण, E = mc2 द्वारा की जा सकती है, जहां E परमाणु बंधन ऊर्जा, c प्रकाश की गति और m द्रव्यमान में अंतर है। इस 'अप्राप्त द्रव्यमान' को द्रव्यमान दोष के रूप में जाना जाता है और यह उस ऊर्जा का प्रतिनिधित्व करती है जो नाभिक के निर्माण के समय विमुक्त हुई थी।[1]
शब्द "परमाणु बंधन ऊर्जा" उन प्रक्रियाओं में ऊर्जा संतुलन को भी संदर्भित कर सकता है जिसमें नाभिक एक से अधिक न्यूक्लियॉन से बने टुकड़ों में विभाजित हो जाता है। यदि प्रकाश नाभिक के संलयन (परमाणु संलयन) पर, या जब भारी नाभिक विभाजित (परमाणु विखंडन) पर नई बंधन ऊर्जा उपलब्ध होती है, तो किसी भी प्रक्रिया के परिणामस्वरूप इस बंधन ऊर्जा विमुक्त हो सकती है। इस ऊर्जा को परमाणु ऊर्जा के रूप में उपलब्ध कराया जा सकता है और इसका उपयोग बिजली उत्पादन के लिए किया जा सकता है, जैसे कि परमाणु ऊर्जा, या नाभिकीय आयुध में है। जब एक बड़ा नाभिक परमाणु टुकड़ों में परिवर्तित होता है, तो अतिरिक्त ऊर्जा गामा किरणों और विभिन्न उत्सर्जित कणों (परमाणु विखंडन उत्पादों) की गतिज ऊर्जा के रूप में उत्सर्जित होती है।
ये परमाणु बंधन ऊर्जाएं और बल हाइड्रोजन जैसे प्रकाश परमाणुओं की इलेक्ट्रॉन बंधन ऊर्जा ऊर्जाओं से दस लाख गुना अधिक हैं।[2]
परिचय
परमाणु ऊर्जा
परमाणु ऊर्जा का अवशोषण या विमोचन परमाणु प्रतिक्रियाओं या रेडियोधर्मी क्षय में होता है; जो ऊर्जा को अवशोषित करते हैं उन्हें ऊष्माशोषी प्रतिक्रियाएं कहा जाता है और जो ऊर्जा छोड़ते हैं उन्हें ऊष्माक्षेपी प्रतिक्रियाएं कहा जाता है। परमाणु रूपांतरण के आने वाले और बाहर जाने वाले उत्पादों के मध्य परमाणु बंधन ऊर्जा में अंतर के कारण ऊर्जा की खपत या विमुक्त होती है।[3]
ऊष्माक्षेपी परमाणु रूपांतरण के सबसे प्रसिद्ध वर्ग परमाणु विखंडन और परमाणु संलयन हैं। परमाणु ऊर्जा विखंडन द्वारा विमुक्त की जा सकती है, जब भारी परमाणु नाभिक (जैसे यूरेनियम और प्लूटोनियम) हल्के नाभिक में टूट जाते हैं। विखंडन से प्राप्त ऊर्जा का उपयोग दुनिया भर में सैकड़ों स्थानों पर विद्युत ऊर्जा उत्पन्न करने के लिए किया जाता है। संलयन के पर्यन्त परमाणु ऊर्जा भी निकलती है, जब हाइड्रोजन जैसे हल्के परमाणु नाभिक मिलकर हीलियम जैसे भारी नाभिक बनाते हैं। सूर्य और अन्य तारे तापीय ऊर्जा उत्पन्न करने के लिए परमाणु संलयन का उपयोग करते हैं जो बाद में सतह से विकिरणित होती है, जो एक प्रकार का तारकीय न्यूक्लियोसिंथेसिस है। किसी भी ऊष्माक्षेपी परमाणु प्रक्रिया में, परमाणु द्रव्यमान को अंततः तापीय ऊर्जा में परिवर्तित किया जा सकता है, जो ऊष्मा के रूप में उत्सर्जित होती है।
किसी भी परमाणु रूपांतरण में विमुक्त या अवशोषित ऊर्जा की मात्रा निर्धारित करने के लिए, किसी को रूपांतरण में सम्मिलित परमाणु घटकों की परमाणु बंधन ऊर्जा को जानना चाहिए।
परमाणु बल
स्थिरवैद्युत् आकर्षण (ऋणात्मक धनात्मक को आकर्षित करता है) द्वारा इलेक्ट्रॉनों और नाभिकों को एक साथ रखा जाता है। इसके अतिरिक्त, इलेक्ट्रॉन कभी-कभी सहसंयोजक बंधन में बंध जाते हैं या उनमें स्थानांतरित हो जाते हैं (परिमाण भौतिकी की प्रक्रियाओं द्वारा); परमाणुओं के मध्य की इस बन्ध को रासायनिक बंध कहा जाता है और यह सभी रासायनिक यौगिकों के निर्माण के लिए उत्तरदायी है।[4]
विद्युत चुम्बकत्व नाभिकों को एक साथ नहीं रखता है, क्योंकि सभी प्रोटॉन धनात्मक आवेश रखते हैं और एक दूसरे को प्रतिकर्षित करते हैं। यदि दो प्रोटान स्पर्श कर रहे हों तो उनका प्रतिकर्षण बल लगभग 40 न्यूटन होगा। क्योंकि प्रत्येक न्यूट्रॉन का कुल आवेश शून्य होता है, एक प्रोटॉन विद्युत रूप से न्यूट्रॉन को आकर्षित कर सकता है यदि प्रोटॉन न्यूट्रॉन को विद्युत रूप से ध्रुवीकृत होने के लिए प्रेरित कर सकता है। हालाँकि, दो प्रोटॉन के मध्य न्यूट्रॉन होने से (ताकि उनका पारस्परिक प्रतिकर्षण 10 N तक कम हो जाए) न्यूट्रॉन को केवल विद्युत चतुष्कोण (− + + −) व्यवस्था के लिए आकर्षित करेगा। अधिक प्रोटॉनों को संतुष्ट करने के लिए आवश्यक उच्च बहुध्रुव, दुर्बल आकर्षण का कारण बनते हैं और शीघ्र ही अविश्वसनीय हो जाते हैं।
प्रोटॉन और न्यूट्रॉन के चुंबकीय क्षणों को मापने और सत्यापित करने के बाद, यह स्पष्ट था कि उनका चुंबकीय बल 20 या 30 न्यूटन हो सकता है, जो ठीक से उन्मुख होने पर आकर्षक होगा। प्रोटॉनों का एक युग्म एक-दूसरे के समीप आने पर 10−13 जूल का कार्य करेगी - अर्थात, एक साथ रहने के लिए उन्हें 0.5 एमईवी की ऊर्जा छोड़ने की आवश्यकता होगी। दूसरी ओर, एक बार जब न्यूक्लियॉन का एक युग्म चुंबकीय रूप से चिपक जाता है, तो उनका बाहरी क्षेत्र बहुत कम हो जाता है, इसलिए कई न्यूक्लियॉन के लिए बहुत अधिक चुंबकीय ऊर्जा एकत्र करना कठिन होता है।
इसलिए, एक अन्य बल, जिसे परमाणु बल (या अवशिष्ट सुदृढ़ बल) कहा जाता है, नाभिक के न्यूक्लियंस को एक साथ रखता है। यह बल प्रबल अंतःक्रिया का अवशेष है, जो क्वार्क को और भी छोटे स्तर की दूरी पर न्यूक्लियॉन में बांधता है।
तथ्य यह है कि सामान्य परिस्थितियों में नाभिक एक साथ नहीं जुड़ते (संगलन) से पता चलता है कि परमाणु बल बड़ी दूरी पर विद्युत प्रतिकर्षण से दुर्बल होना चाहिए, लेकिन निकट सीमा पर प्रबल होना चाहिए। इसलिए, इसमें कम दूरी की विशेषताएं हैं। परमाणु बल का एक सादृश्य दो छोटे चुम्बकों के मध्य का बल है: जब चुम्बक एक साथ चिपक जाते हैं तो उन्हें अलग करना बहुत कठिन होता है, लेकिन एक बार थोड़ी दूरी खींचने पर उनके मध्य का बल लगभग शून्य हो जाता है।[4]
गुरुत्वाकर्षण या विद्युत बलों के विपरीत, परमाणु बल केवल बहुत कम दूरी पर ही प्रभावी होता है। अधिक दूरी पर, स्थिरवैद्युत् बल प्रमुख होता है: प्रोटॉन एक दूसरे को प्रतिकर्षित करते हैं क्योंकि वे धनात्मक रूप से आवेश होते हैं और समान आवेश प्रतिकर्षित होते हैं। इस कारण से, सामान्य हाइड्रोजन के नाभिक बनाने वाले प्रोटॉन - उदाहरण के लिए, हाइड्रोजन से भरे गुब्बारे में - हीलियम बनाने के लिए संयोजित नहीं होते हैं (एक ऐसी प्रक्रिया जिसमें इलेक्ट्रॉनों के साथ संयोजन करने और न्यूट्रॉन बनने के लिए कुछ प्रोटॉन की भी आवश्यकता होगी)। वे इतने समीप नहीं आ पाते कि परमाणु बल, जो उन्हें एक-दूसरे की ओर आकर्षित करता है। केवल अत्यधिक दाब और तापमान की स्थितियों में (उदाहरण के लिए, किसी तारे के अंतर्भाग के भीतर), ऐसी प्रक्रिया हो सकती है।[5]
नाभिक की भौतिकी
पृथ्वी पर लगभग 94 प्राकृतिक रूप से पाए जाने वाले तत्व हैं। प्रत्येक तत्व के परमाणुओं में एक परमाणु नाभिक होता है जिसमें एक विशिष्ट संख्या में प्रोटोन (किसी दिए गए तत्व के लिए सदैव समान संख्या) और कुछ संख्या में न्यूट्रॉन होते हैं, जो प्रायः लगभग समान संख्या होती है। एक ही तत्व के दो परमाणु जिनमें न्यूट्रॉन की संख्या भिन्न-भिन्न होती है, तत्व के समस्थानिक कहलाते हैं। विभिन्न समस्थानिक में अलग-अलग गुण हो सकते हैं - उदाहरण के लिए एक स्थिर हो सकता है और दूसरा अस्थिर हो सकता है और धीरे-धीरे रेडियोधर्मी क्षय से गुजरते हुए एक अन्य तत्व बन सकता है।
हाइड्रोजन नाभिक में केवल एक प्रोटॉन होता है। इसके समस्थानिक ड्यूटेरियम, या भारी हाइड्रोजन में एक प्रोटॉन और एक न्यूट्रॉन होता है। हीलियम में दो प्रोटॉन और दो न्यूट्रॉन होते हैं, कार्बन, नाइट्रोजन और ऑक्सीजन - प्रत्येक कण में क्रमशः छह, सात और आठ होते हैं। हालाँकि, एक हीलियम नाभिक का भार दो भारी हाइड्रोजन नाभिकों के भार के योग से कम होता है जो इसे बनाने के लिए संयोजित होते हैं।[6] कार्बन, नाइट्रोजन और ऑक्सीजन के लिए भी यही सत्य है। उदाहरण के लिए, कार्बन नाभिक तीन हीलियम नाभिकों से थोड़ा हल्का होता है, जो मिलकर कार्बन नाभिक बना सकते हैं। इस अंतर को द्रव्यमान दोष के नाम से जाना जाता है।
द्रव्यमान दोष
द्रव्यमान दोष (जिसे "द्रव्यमान कमी" भी कहा जाता है) किसी वस्तु के द्रव्यमान और उसके घटक कणों के द्रव्यमान के योग के मध्य का अंतर है। इसकी खोज अल्बर्ट आइंस्टीन ने 1905 में की थी, इसे उनके सूत्र E = mc2 का उपयोग करके समझाया जा सकता है, जो ऊर्जा और द्रव्यमान की समानता का वर्णन करता है। द्रव्यमान में कमी परमाणु के निर्माण की प्रतिक्रिया में उत्सर्जित ऊर्जा को c2 से विभाजित करने के समान है।[7] इस सूत्र के अनुसार, ऊर्जा जोड़ने से द्रव्यमान (भार और जड़त्व दोनों) बढ़ता है, जबकि ऊर्जा हटाने से द्रव्यमान घटता है। उदाहरण के लिए, चार न्यूक्लियॉन वाले हीलियम परमाणु का द्रव्यमान चार हाइड्रोजन परमाणुओं (प्रत्येक में एक न्यूक्लियॉन होता है) के कुल द्रव्यमान से लगभग 0.8% कम होता है। हीलियम नाभिक में चार न्यूक्लियॉन एक साथ बंधे होते हैं और बंधन ऊर्जा जो उन्हें एक साथ रखती है, वास्तव में, अप्राप्त द्रव्यमान 0.8% है।[8][9]
यदि कणों के संयोजन में अतिरिक्त ऊर्जा होती है - उदाहरण के लिए, विस्फोटक टीएनटी के एक अणु में - तो इसे विस्फोट के बाद इसके अंतिम उत्पादों की तुलना में कुछ अतिरिक्त द्रव्यमान का पता चलता है। अंतिम उत्पादों को रोकने और ठंडा करने के बाद उनका भार किया जाना चाहिए, हालांकि, सिद्धांत रूप में, इसकी हानि पर ध्यान देने से पहले अतिरिक्त द्रव्यमान को प्रणाली से ऊष्मा के रूप में बाहर निकलना चाहिए। दूसरी ओर, यदि किसी को ऊर्जा अन्तःक्षेप करनी चाहिए। कणों की एक प्रणाली को उसके घटकों में अलग करें, तो अलग होने के बाद प्रारंभिक द्रव्यमान घटकों के द्रव्यमान से कम होता है। बाद की स्थिति में, अन्तःक्षेप की गई ऊर्जा को स्थितिज ऊर्जा के रूप में संग्रहीत किया जाता है, जो इसे संग्रहीत करने वाले घटकों के बढ़े हुए द्रव्यमान के रूप में दर्शाता है। यह इस तथ्य का उदाहरण है कि प्रणालियों में सभी प्रकार की ऊर्जाओं को द्रव्यमान के रूप में देखा जाता है, क्योंकि द्रव्यमान और ऊर्जा समतुल्य हैं और प्रत्येक दूसरे की विशेषता है।[10]
बाद वाला परिदृश्य हीलियम जैसे नाभिक की स्थिति में है: उन्हें प्रोटॉन और न्यूट्रॉन में तोड़ने के लिए, किसी को ऊर्जा अन्तःक्षेप करनी होगी। दूसरी ओर, यदि विपरीत दिशा में चलने वाली कोई प्रक्रिया अस्तित्व में हो, जिसके द्वारा हाइड्रोजन परमाणुओं को जोड़कर हीलियम बनाया जा सके, तो ऊर्जा निकलेगी। प्रत्येक नाभिक के लिए E = Δmc2 का उपयोग करके ऊर्जा की गणना की जा सकती है, जहां Δm हीलियम नाभिक के द्रव्यमान और चार प्रोटॉनों के द्रव्यमानों (और दो इलेक्ट्रॉन, हीलियम के न्यूट्रॉन बनाने के लिए अवशोषित) के मध्य का अंतर है।
हल्के तत्वों के लिए, उन्हें हल्के तत्वों से एकत्र करके जो ऊर्जा विमुक्त की जा सकती है वह कम हो जाती है और जब वे संगलित हो जाते हैं तो ऊर्जा विमुक्त की जा सकती है। यह आयरन/निकल से हल्के नाभिकों के लिए सत्य है। भारी नाभिकों को बांधने के लिए अधिक ऊर्जा की आवश्यकता होती है और वह ऊर्जा उन्हें टुकड़ों में तोड़कर (परमाणु विखंडन के रूप में जाना जाता है) विमुक्त की जा सकती है। वर्तमान में परमाणु ऊर्जा रिएक्टरों में यूरेनियम नाभिक को तोड़कर और विमुक्त ऊर्जा को ऊष्मा के रूप में ग्रहण करके, जिसे बिजली में परिवर्तित किया जाता है, परमाणु ऊर्जा उत्पन्न की जाती है।
एक नियम के रूप में, बहुत हल्के तत्व तुलनात्मक रूप से सरलता से जुड़ सकते हैं और बहुत भारी तत्व बहुत सरलता से विखंडन के माध्यम से टूट सकते हैं; मध्य के तत्व अधिक स्थिर होते हैं और उन्हें प्रयोगशाला जैसे वातावरण में संलयन या विखंडन से गुजरना कठिन होता है।
आयरन के बाद प्रवृत्ति के उत्क्रम का कारण नाभिक का बढ़ता धनात्मक आवेश है, जो नाभिक को टूटने के लिए विवश करता है। इसका प्रतिरोध प्रबल परमाणु अन्योन्यक्रिया द्वारा किया जाता है, जो न्यूक्लियंस को एक साथ रखता है। विद्युत बल प्रबल परमाणु बल से दुर्बल हो सकता है, लेकिन प्रबल बल की सीमा बहुत अधिक सीमित होती है: आयरन के नाभिक में, प्रत्येक प्रोटॉन अन्य 25 प्रोटॉन को पीछे हटाता है, जबकि परमाणु बल केवल निकट सहवासियों को बांधता है। इसलिए बड़े नाभिकों के लिए, स्थिरवैद्युत् बल प्रमुख हो जाते हैं और समय के साथ नाभिक टूटने लगता है।
जैसे-जैसे नाभिक बड़े होते जाते हैं, यह विघटनकारी प्रभाव निरंतर अधिक महत्वपूर्ण होता जाता है। जब तक पोलोनियम (84 प्रोटॉन) तक पहुंच जाता है, तब तक नाभिक अपने बड़े धनात्मक आवेश को समायोजित नहीं कर सकता है, लेकिन अल्फा रेडियोधर्मिता की प्रक्रिया में अपने अतिरिक्त प्रोटॉन को काफी तीव्रता से उत्सर्जित करता है - हीलियम नाभिक का उत्सर्जन, प्रत्येक में दो प्रोटॉन और दो न्यूट्रॉन होते हैं। हीलियम नाभिक एक विशेष रूप से स्थिर संयोजन है। इस प्रक्रिया के कारण, 94 से अधिक प्रोटॉन वाले नाभिक पृथ्वी पर स्वाभाविक रूप से नहीं पाए जाते हैं (आवर्त सारणी देखें)। सबसे लंबे अर्ध आयु वाले यूरेनियम (परमाणु क्रमांक 92) से परे के समस्थानिक प्लूटोनियम-244 (80 मिलियन वर्ष) और क्यूरियम-247 (16 मिलियन वर्ष) हैं।
सूर्य में परमाणु प्रतिक्रियाएँ
परमाणु संलयन प्रक्रिया इस प्रकार कार्य करती है: पांच अरब वर्ष पूर्व, नया सूर्य तब बना जब गुरुत्वाकर्षण ने हाइड्रोजन और धूल के एक विशाल बादल को एक साथ खींच लिया, जिससे पृथ्वी और अन्य ग्रह भी उत्पन्न हुए। गुरुत्वाकर्षण बल ने ऊर्जा विमुक्त की और प्रारंभिक सूर्य को गर्म कर दिया, ठीक उसी तरह जैसे हेल्महोल्ट्ज़ ने प्रस्तावित किया था।[11]
ऊष्मीय ऊर्जा परमाणुओं और अणुओं की गति के रूप में प्रकट होती है: कणों के संग्रह का तापमान जितना अधिक होता है, उनका वेग उतना ही अधिक होता है और उनका संघट्ट उतनी ही अधिक तीव्र होता है। जब नवगठित सूर्य के केंद्र का तापमान इतना बढ़ गया कि हाइड्रोजन नाभिकों के मध्य टकराव हो सके, जिससे उनके विद्युत प्रतिकर्षण पर नियंत्रण पाया जा सके और उन्हें आकर्षक परमाणु बल की छोटी सीमा में लाया जा सके, तो नाभिक आपस में चिपकना प्रारम्भ हो गए। जब ऐसा होने लगा, तो प्रोटॉन ड्यूटेरियम और फिर हीलियम में संयुक्त हो गए, इस प्रक्रिया में कुछ प्रोटॉन न्यूट्रॉन (धन पॉज़िट्रॉन, धनात्मक इलेक्ट्रॉन, जो इलेक्ट्रॉनों के साथ जुड़ते हैं और गामा- किरणे फोटॉन में नष्ट हो जाते हैं) में बदल जाते हैं। यह विमुक्त परमाणु ऊर्जा अब सूर्य के अंतर्भाग के उच्च तापमान को बनाए रखती है और ऊष्मा गैस के दाब को भी उच्च रखती है, जिससे सूर्य अपने वर्तमान आकार में रहता है और गुरुत्वाकर्षण को इसे और अधिक संपीड़ित करने से रोकता है। अब गुरुत्वाकर्षण और दाब के मध्य एक स्थिर संतुलन है।
सूर्य के अस्तित्व के विभिन्न चरणों में विभिन्न परमाणु प्रतिक्रियाएं प्रबल हो सकती हैं, जिसमें प्रोटॉन-प्रोटॉन प्रतिक्रिया और कार्बन-नाइट्रोजन चक्र सम्मिलित है - जिसमें भारी नाभिक सम्मिलित होते हैं, लेकिन जिसका अंतिम उत्पाद अभी भी हीलियम बनाने के लिए प्रोटॉन का संयोजन होता है।
भौतिकी की एक शाखा, नियंत्रित परमाणु संलयन का अध्ययन, 1950 के दशक से परमाणु संलयन प्रतिक्रियाओं से उपयोगी शक्ति प्राप्त करने का प्रयास कर रही है जो छोटे नाभिकों को बड़े नाभिकों में जोड़ती है, सामान्यतः वाष्पित्र को गर्म करने के लिए, जिनकी भाप टर्बाइनों को घूमा सकती है और बिजली का उत्पादन कर सकती है। कोई भी सांसारिक प्रयोगशाला सौर बिजलीघर की एक विशेषता से मेल नहीं खा सकती है: सूर्य का विशाल द्रव्यमान, जिसका भार तप्त प्लाज्मा को संपीड़ित रखता है और परमाणु भट्टी को सूर्य के अंतर्भाग तक सीमित रखता है। इसके बजाय, भौतिक विज्ञानी प्लाज्मा को सीमित करने के लिए प्रबल चुंबकीय क्षेत्र का उपयोग करते हैं और ईंधन के लिए वे हाइड्रोजन के भारी रूपों का उपयोग करते हैं, जो अधिक सरलता से जलते हैं। चुंबकीय जाल काफी अस्थिर हो सकते हैं और परमाणु संलयन से गुजरने के लिए पर्याप्त गर्म और सघन कोई भी प्लाज्मा थोड़े समय के बाद उनमें से फिसल जाता है। यहां तक कि सरल तरकीबों के साथ भी, अधिकतर स्थितियों में परिरोधन एक सेकंड के एक छोटे से भाग तक ही रहता है।
नाभिकों का संयोजन
छोटे नाभिक जो हाइड्रोजन से बड़े होते हैं, बड़े नाभिकों में संयोजित हो सकते हैं और ऊर्जा विमुक्त कर सकते हैं, लेकिन ऐसे नाभिकों के संयोजन में, विमुक्त ऊर्जा की मात्रा हाइड्रोजन संलयन की तुलना में बहुत कम होती है। इसका कारण यह है कि जबकि समग्र प्रक्रिया परमाणु आकर्षण को अपना कार्य करने से ऊर्जा मुक्त करती है, ऊर्जा को पहले धनात्मक रूप से आवेश किए गए प्रोटॉन को एक साथ लाने के लिए अन्तःक्षेप किया जाना चाहिए, जो अपने विद्युत आवेश के साथ एक दूसरे को भी पीछे हटाते हैं।[5]
उन तत्वों के लिए जिनका भार आयरन (26 प्रोटॉन वाला एक नाभिक) से अधिक है, संलयन प्रक्रिया अब ऊर्जा जारी नहीं करती है। यहां तक कि भारी नाभिकों में भी समान आकार के नाभिकों के संयोजन से ऊर्जा की खपत होती है। इतने बड़े नाभिक के साथ, विद्युत प्रतिकर्षण (जो नाभिक में सभी प्रोटॉन को प्रभावित करता है) पर नियंत्रण पाने के लिए परमाणु आकर्षण (जो मुख्य रूप से निकट सहवासियों के मध्य प्रभावी होता है) द्वारा विमुक्त ऊर्जा की तुलना में अधिक ऊर्जा की आवश्यकता होती है। इसके विपरीत, ऊर्जा वास्तव में आयरन से भी भारी नाभिक को तोड़कर विमुक्त की जा सकती है।[5]
लेड से भारी तत्वों के नाभिक के साथ, विद्युत प्रतिकर्षण इतना प्रबल होता है कि उनमें से कुछ अनायास ही धनात्मक टुकड़ों को बाहर निकाल देते हैं, सामान्यतः हीलियम के नाभिक जो स्थिर अल्फा कण बनाते हैं। यह स्वतःस्फूर्त विघटन कुछ नाभिकों द्वारा प्रदर्शित रेडियोधर्मिता के रूपों में से एक है।[5]
लेड से भारी नाभिक (बिस्मथ, थोरियम और यूरेनियम को छोड़कर) अनायास इतने शीघ्र टूट जाते हैं कि प्रकृति में मौलिक तत्वों के रूप में प्रकट हो जाते हैं, हालांकि उन्हें कृत्रिम रूप से या भारी तत्वों की क्षय श्रृंखलाओं में मध्यवर्ती के रूप में उत्पादित किया जा सकता है। सामान्यतः, नाभिक जितने भारी होते हैं, वे उतनी ही तीव्रता से स्वतः क्षय होते हैं।[5]
आयरन नाभिक सबसे स्थिर नाभिक होते हैं (विशेष रूप से लौह-56), और इसलिए ऊर्जा के सर्वोत्तम स्रोत वे नाभिक होते हैं जिनका भार आयरन से यथासंभव दूर होता है। कोई सबसे हल्के नाभिकों-हाइड्रोजन (प्रोटॉन) के नाभिकों को मिलाकर हीलियम के नाभिक बना सकता है और इसी तरह सूर्य अपनी ऊर्जा उत्पन्न करता है। वैकल्पिक रूप से, कोई सबसे भारी टुकड़ों - यूरेनियम या प्लूटोनियम के नाभिक - को छोटे टुकड़ों में तोड़ सकता है और परमाणु रिएक्टर यही करते हैं।[5]
परमाणु बंधन ऊर्जा
परमाणु बंधन ऊर्जा को दर्शाने वाला एक उदाहरण 12C (कार्बन-12), का नाभिक है, जिसमें 6 प्रोटॉन और 6 न्यूट्रॉन होते हैं। सभी प्रोटॉन धनात्मक रूप से आवेशित होते हैं और एक-दूसरे को प्रतिकर्षित करते हैं, लेकिन परमाणु बल प्रतिकर्षण पर नियंत्रण पा लेता है और उन्हें एक साथ चिपका देता है। परमाणु बल एक निकट-सीमा बल है (यह 1.0 एफएम की दूरी पर अत्यधिक आकर्षक है और 2.5 एफएम की दूरी से परे बहुत ही छोटा हो जाता है), और इस बल का वस्तुतः कोई प्रभाव नाभिक के बाहर नहीं देखा जाता है। परमाणु बल न्यूट्रॉन, या न्यूट्रॉन और प्रोटॉन को भी एक साथ खींचता है।[12]
अनंत दूरी तक खींचे गए कणों की ऊर्जा के संबंध में नाभिक की ऊर्जा ऋणात्मक है (सौर मंडल के ग्रहों की गुरुत्वाकर्षण ऊर्जा की तरह), क्योंकि ऊर्जा का उपयोग नाभिक को उसके अलग-अलग प्रोटॉन और न्यूट्रॉन में विभाजित करने के लिए किया जाना चाहिए। द्रव्यमान स्पेक्ट्रममिति ने नाभिक के द्रव्यमान को मापा है, जो सदैव उन्हें बनाने वाले प्रोटॉन और न्यूट्रॉन के द्रव्यमान के योग से कम होता है और अंतर - सूत्र E = mc2 द्वारा - नाभिक की बंधन ऊर्जा देता है।[12]
परमाणु संलयन
हीलियम की बंधन ऊर्जा सूर्य और अधिकांश तारों की ऊर्जा स्रोत है।[13] सूर्य 74 प्रतिशत हाइड्रोजन (द्रव्यमान द्वारा मापा गया) से बना है, एक तत्व जिसमें एक नाभिक होता है जिसमें एक प्रोटॉन होता है। सूर्य में ऊर्जा तब मुक्त होती है जब 4 प्रोटॉन एक हीलियम नाभिक में संयोजित होते हैं, एक प्रक्रिया जिसमें उनमें से दो भी न्यूट्रॉन में परिवर्तित हो जाते हैं।[12]
प्रोटॉन का न्यूट्रॉन में रूपांतरण एक अन्य परमाणु बल का परिणाम है, जिसे दुर्बल (परमाणु) बल के रूप में जाना जाता है। दुर्बल बल की, प्रबल बल की तरह, एक छोटी सीमा होती है, लेकिन प्रबल बल की तुलना में बहुत दुर्बल होती है। दुर्बल बल न्यूट्रॉन और प्रोटॉन की संख्या को सबसे ऊर्जावान रूप से स्थिर विन्यास में बनाने का प्रयास करता है। 40 से कम कणों वाले नाभिक के लिए, ये संख्याएँ सामान्यतः लगभग बराबर होती हैं। प्रोटॉन और न्यूट्रॉन आपस में घनिष्ठ रूप से संबंधित हैं और सामूहिक रूप से न्यूक्लियॉन के रूप में जाने जाते हैं। जैसे-जैसे कणों की संख्या अधिकतम 209 तक बढ़ती है, स्थिरता बनाए रखने के लिए न्यूट्रॉन की संख्या प्रोटॉन की संख्या से अधिक होने लगती है, जब तक कि न्यूट्रॉन और प्रोटॉन का अनुपात लगभग तीन से दो नहीं हो जाता।[12]
हाइड्रोजन के प्रोटॉन हीलियम से तभी संयोजित होते हैं जब उनमें इतना वेग हो कि वे एक-दूसरे के पारस्परिक प्रतिकर्षण पर नियंत्रण पा सकें और प्रबल परमाणु आकर्षण की सीमा के भीतर आ सकें। इसका अर्थ यह है कि संलयन केवल बहुत तप्त गैस के भीतर ही होता है। हीलियम में संयोजित होने के लिए पर्याप्त गर्म हाइड्रोजन को सीमित रखने के लिए अत्यधिक दाब की आवश्यकता होती है, लेकिन सूर्य के सौर अंतर्भाग में उपयुक्त स्थितियाँ उपस्थित हैं, जहां ऐसा दाब अंतर्भाग के ऊपर की परतों के भारी भार द्वारा प्रदान किया जाता है, जो सूर्य के प्रबल गुरुत्वाकर्षण द्वारा भीतर की ओर दबाया जाता है। प्रोटॉन के संयोजन से हीलियम बनाने की प्रक्रिया परमाणु संलयन का एक उदाहरण है।[12]
ड्यूटेरियम बनाने में कठिनाई के कारण सामान्य हाइड्रोजन से हीलियम का उत्पादन पृथ्वी पर व्यावहारिक रूप से असंभव होगा। ड्यूटेरियम और ट्रिटियम का उपयोग करके एक प्रक्रिया विकसित करने पर अनुसंधान किया जा रहा है। पृथ्वी के महासागरों में बड़ी मात्रा में ड्यूटेरियम होता है जिसका उपयोग किया जा सकता है और रिएक्टर में ही लिथियम से ट्रिटियम बनाया जा सकता है और इसके अतिरिक्त हीलियम उत्पाद पर्यावरण को क्षति नहीं पहुंचाता है, इसलिए कुछ लोग परमाणु संलयन को हमारी ऊर्जा आवश्यकताओं की आपूर्ति के लिए एक अच्छा विकल्प मानते हैं। संलयन के इस रूप को क्रियान्वित करने के प्रयोग अब तक आंशिक रूप से ही सफल हुए हैं। पर्याप्त रूप से गर्म ड्यूटेरियम और ट्रिटियम को सीमित किया जाना चाहिए। एक प्रविधि बहुत प्रबल चुंबकीय क्षेत्र का उपयोग करना है, क्योंकि आवेशित कण (जैसे पृथ्वी के विकिरण कटिबंध में फंसे कण) चुंबकीय क्षेत्र रेखाओं द्वारा निर्देशित होते हैं।[12]
बंधन ऊर्जा अधिकतम और क्षय द्वारा उस तक पहुंचने के तरीके
कार्बन, नाइट्रोजन और ऑक्सीजन जैसे प्रकाश तत्वों के मुख्य समस्थानिकों में, न्यूट्रॉन और प्रोटॉन का सबसे स्थिर संयोजन तब होता है जब संख्याएं बराबर होती हैं (यह तत्व 20, कैल्शियम तक जारी रहता है)। हालाँकि, भारी नाभिक में, प्रोटॉन की विघटनकारी ऊर्जा बढ़ जाती है, क्योंकि वे एक छोटी मात्रा तक ही सीमित होते हैं और एक दूसरे को प्रतिकर्षित करते हैं। नाभिक को एक साथ रखने वाले प्रबल बल की ऊर्जा भी बढ़ती है, लेकिन धीमी गति से, जैसे कि नाभिक के भीतर, केवल एक-दूसरे के निकट वाले न्यूक्लियॉन प्रबलता से बंधे होते हैं, अधिक व्यापक रूप से पृथक नहीं होते हैं।[12]
किसी नाभिक की शुद्ध बंधन ऊर्जा परमाणु आकर्षण की होती है, जिसमें विद्युत बल की विघटनकारी ऊर्जा को घटा दिया जाता है। जैसे-जैसे नाभिक हीलियम से भारी होते जाते हैं, प्रति न्यूक्लियॉन उनकी शुद्ध बंधन ऊर्जा (नाभिक के मध्य द्रव्यमान के अंतर और घटक न्यूक्लियॉन के द्रव्यमान के योग से निकाली गई) अधिक-से-अधिक धीरे-धीरे बढ़ती है और आयरन पर अपने चरम पर पहुंच जाती है। जैसे-जैसे न्यूक्लियॉन जोड़े जाते हैं, कुल परमाणु बंधन ऊर्जा सदैव बढ़ती है - लेकिन विद्युत बलों की कुल विघटनकारी ऊर्जा (धनात्मक प्रोटॉन अन्य प्रोटॉन को पीछे हटाना) भी बढ़ जाती है और पिछले आयरन में, दूसरी वृद्धि पहले से अधिक होती है। आयरन-56 (56Fe) सबसे कुशलता से बंधा हुआ नाभिक है[12]इसका अर्थ है कि इसका औसत द्रव्यमान प्रति न्यूक्लियॉन सबसे कम है। हालाँकि, प्रति न्यूक्लियॉन बंधन ऊर्जा के संदर्भ में निकल-62 सबसे प्रबलता से बंधा हुआ नाभिक है[14] (निकेल-62 की उच्च बंधन ऊर्जा 56Fe से बड़े औसत द्रव्यमान हानि में परिवर्तित नहीं होती है, क्योंकि 62Ni में आयरन-56 की तुलना में न्यूट्रॉन/प्रोटॉन का अनुपात थोड़ा अधिक है और भारी न्यूट्रॉन की उपस्थिति निकेल-62 के प्रति न्यूक्लियॉन का औसत द्रव्यमान बढ़ जाता है)।
विघटनकारी ऊर्जा को कम करने के लिए, दुर्बल अंतःक्रिया न्यूट्रॉन की संख्या को प्रोटॉन से अधिक करने की अनुमति देती है - उदाहरण के लिए, आयरन के मुख्य समस्थानिक में 26 प्रोटॉन और 30 न्यूट्रॉन होते हैं। समस्थानिक भी उपस्थित होते हैं जहां न्यूट्रॉन की संख्या न्यूक्लियॉन की उस संख्या के लिए सबसे स्थिर संख्या से भिन्न होती है। यदि एक प्रोटॉन को न्यूट्रॉन में या एक न्यूट्रॉन को प्रोटॉन में बदलने से स्थिरता बढ़ जाती है (द्रव्यमान कम हो जाता है), तो यह बीटा क्षय के माध्यम से होगा, जिसका अर्थ है कि न्यूक्लाइड रेडियोधर्मी होगा।
इस रूपांतरण के लिए दो तरीकों की मध्यस्थता दुर्बल बल द्वारा की जाती है और इसमें बीटा क्षय के प्रकार सम्मिलित होते हैं। सबसे सरल बीटा क्षय में, एक ऋणात्मक इलेक्ट्रॉन और एक प्रतिन्यूट्रीनो उत्सर्जित करके न्यूट्रॉन प्रोटॉन में परिवर्तित हो जाते हैं। यह नाभिक के बाहर सदैव संभव होता है क्योंकि न्यूट्रॉन लगभग 2.5 इलेक्ट्रॉनों के बराबर प्रोटॉन से अधिक विशाल होते हैं। विपरीत प्रक्रिया में, जो केवल नाभिक के भीतर होती है, मुक्त कणों में नहीं, एक प्रोटॉन एक पोजीट्रान और एक इलेक्ट्रॉन न्यूट्रिनो को बाहर निकालकर न्यूट्रॉन बन सकता है। इसकी अनुमति तब दी जाती है जब ऐसा करने के लिए मूल और मूलज न्यूक्लाइड के मध्य पर्याप्त ऊर्जा उपलब्ध हो (आवश्यक ऊर्जा अंतर 1.022 एमईवी के बराबर है, जो 2 इलेक्ट्रॉनों का द्रव्यमान है)। यदि मूल और मूलज के मध्य द्रव्यमान का अंतर इससे कम है, तो एक प्रोटॉन-समृद्ध नाभिक अभी भी इलेक्ट्रॉन परिग्रहण की प्रक्रिया द्वारा प्रोटॉन को न्यूट्रॉन में परिवर्तित कर सकता है, जिसमें एक प्रोटॉन केवल परमाणु के K कक्षीय इलेक्ट्रॉनों में से एक को अधिकृत करता है, एक न्यूट्रिनो उत्सर्जित करता है और न्यूट्रॉन बन जाता है।[12]
सबसे भारी नाभिकों में, 104 या अधिक न्यूक्लियॉन वाले टेल्यूरियम नाभिक (तत्व 52) से प्रारम्भ होकर, विद्युत बल इतने अस्थिर हो सकते हैं कि नाभिक के सम्पूर्ण टुकड़े बाहर निकल सकते हैं, सामान्यतः अल्फा कणों के रूप में, जिसमें दो प्रोटॉन और दो न्यूट्रॉन (अल्फा) होते हैं। कण तीव्र हीलियम नाभिक हैं। बेरिलियम-8 भी बहुत तीव्रता से दो अल्फा कणों में विघटित हो जाता है। जैसे-जैसे तत्वों का परमाणु भार 104 से अधिक बढ़ता है, इस प्रकार का क्षय अधिक-से-अधिक संभावित हो जाता है।
बंधन ऊर्जा का वक्र एक आलेख है जो परमाणु द्रव्यमान के विरुद्ध प्रति न्यूक्लियॉन बंधन ऊर्जा को आलेखित करता है। इस वक्र का मुख्य शिखर आयरन और निकल पर होता है, फिर धीरे-धीरे घटता है और हीलियम पर एक संकीर्ण पृथक शिखर होता है, जो अन्य कम द्रव्यमान वाले न्यूक्लाइड की तुलना में अधिक स्थिर होता है। प्रकृति में अनुरेखण से अधिक मात्रा में सबसे भारी नाभिक, यूरेनियम 238U, अस्थिर हैं, परन्तु 4.5 अरब वर्ष का आधा जीवन होने के कारण, पृथ्वी की उम्र के निकट, वे अभी भी अपेक्षाकृत प्रचुर मात्रा में हैं; वे (और हीलियम से भारी अन्य नाभिक) सौर मंडल के निर्माण से पहले सुपर्नोवा विस्फोटों [15] जैसे तारकीय विकास की घटनाओं में बने हैं। थोरियम का सबसे सामान्य समस्थानिक, 232Th, भी अल्फा कण उत्सर्जन से गुजरता है और इसका आधा जीवन (वह समय जिसमें परमाणुओं की आधी संख्या का क्षय होता है) कई गुना अधिक लंबा होता है। इनमें से प्रत्येक में, रेडियोसक्रिय क्षय संतति समस्थानिक का उत्पादन करता है जो अस्थिर भी होते हैं, जिससे क्षय की एक श्रृंखला प्रारम्भ होती है जो लेड के कुछ स्थिर समस्थानिकों में समाप्त होती है।[12]
परमाणु बंधन ऊर्जा की गणना
नाभिक की परमाणु बंधन ऊर्जा निर्धारित करने के लिए गणना को नियोजित किया जा सकता है। गणना में द्रव्यमान दोष का निर्धारण करना, इसे ऊर्जा में परिवर्तित करना और परिणाम को परमाणुओं के प्रति मोल ऊर्जा या प्रति न्यूक्लियॉन ऊर्जा के रूप में व्यक्त करना सम्मिलित है।[1]
द्रव्यमान दोष का ऊर्जा में रूपांतरण
द्रव्यमान दोष को किसी नाभिक के द्रव्यमान और उससे बने नाभिकों के द्रव्यमान के योग के मध्य अंतर के रूप में परिभाषित किया जाता है। द्रव्यमान दोष का निर्धारण तीन मात्राओं की गणना करके किया जाता है।[1]ये : नाभिक का वास्तविक द्रव्यमान, नाभिक की संरचना (प्रोटॉन और न्यूट्रॉन की संख्या), और एक प्रोटॉन और एक न्यूट्रॉन का द्रव्यमान हैं। इसके बाद द्रव्यमान दोष को ऊर्जा में परिवर्तित किया जाता है। यह मात्रा परमाणु बंधन ऊर्जा है, हालाँकि इसे परमाणुओं के प्रति मोल ऊर्जा या प्रति न्यूक्लियॉन ऊर्जा के रूप में व्यक्त किया जाना चाहिए।[1]
विखंडन और संलयन
परमाणुओं के नाभिकों के विभाजन (विखंडन) या विलय (संलयन) से परमाणु ऊर्जा निकलती है। परमाणु द्रव्यमान-ऊर्जा का ऊर्जा के रूप में रूपांतरण, जो ऊर्जा हटाए जाने पर कुछ द्रव्यमान हटा सकता है, द्रव्यमान-ऊर्जा तुल्यता सूत्र के अनुरूप है:
- ΔE = Δm c2,
जहाँ
- ΔE = ऊर्जा विमोचन,
- Δm = द्रव्यमान दोष,
और c = निर्वात में प्रकाश की गति है।
परमाणु ऊर्जा की खोज पहली बार 1896 में फ्रांस के भौतिक विज्ञानी हेनरी बेकरेल ने की थी, जब उन्होंने पाया कि यूरेनियम के पास अंधेरे में संग्रहीत छायाचित्रित पट्टिका एक्स-रे पट्टिकाओं की तरह काली हो गई थीं (एक्स-रे की खोज हाल ही में 1895 में हुई थी)।[16]
निकेल-62 में किसी भी समस्थानिक के प्रति न्यूक्लियॉन में उच्चतम बंधन ऊर्जा होती है। यदि प्रति न्यूक्लियॉन कम औसत बंधन ऊर्जा के एक परमाणु को प्रति न्यूक्लियॉन उच्च औसत बंधन ऊर्जा के दो परमाणुओं में बदल दिया जाता है, तो ऊर्जा उत्सर्जित होती है (यहां औसत भारित औसत है)। इसके अतिरिक्त, यदि कम औसत बंधन ऊर्जा के दो परमाणु उच्च औसत बंधन ऊर्जा के एक परमाणु में संलयन करते हैं, तो ऊर्जा उत्सर्जित होती है। तालिका से पता चलता है कि भारी परमाणु बनाने के लिए हाइड्रोजन नाभिक के संलयन या संयोजन से ऊर्जा निकलती है, जैसे यूरेनियम का विखंडन, एक बड़े नाभिक को छोटे भागों में तोड़ता है।
परमाणु ऊर्जा तीन एक्सोएनर्जेटिक (या ऊष्माक्षेपी) प्रक्रियाओं द्वारा विमुक्त की जाती है:
- रेडियोसक्रिय क्षय, जहां रेडियोसक्रिय नाभिक में एक न्यूट्रॉन या प्रोटॉन कण, विद्युत चुम्बकीय विकिरण (गामा किरणें), या दोनों उत्सर्जित करके स्वचालित रूप से क्षय हो जाता है। ध्यान दें कि रेडियोसक्रिय क्षय के लिए, बंधन ऊर्जा का बढ़ना बिल्कुल आवश्यक नहीं है। जो अत्यंत आवश्यक है वह यह है कि द्रव्यमान कम हो जाए। यदि एक न्यूट्रॉन एक प्रोटॉन में बदल जाता है और क्षय की ऊर्जा 0.782343 एमईवी से कम है, तो न्यूट्रॉन और प्रोटॉन के द्रव्यमान के मध्य का अंतर प्रकाश की गति से गुणा किया जाता है, (जैसे रूबिडियम -87 स्ट्रोंटियम 87 -87 में क्षय हो जाता है), प्रति न्यूक्लियॉन औसत बंधन ऊर्जा वास्तव में कम हो जाएगी।
- संलयन, दो परमाणु नाभिक आपस में जुड़कर एक भारी नाभिक बनाते हैं।
- विखंडन, एक भारी नाभिक का दो (या सम्भवतः कभी तीन) हल्के नाभिक और कुछ न्यूट्रॉन में टूटना हैं।
प्रकाश तत्वों की ऊर्जा उत्पादक परमाणु अंतःक्रिया को कुछ स्पष्टीकरण की आवश्यकता है। प्रायः, सभी प्रकाश तत्व ऊर्जा-उत्पादक परमाणु अंतःक्रिया को संलयन के रूप में वर्गीकृत किया जाता है, हालांकि ऊपर दी गई परिभाषा के अनुसार संलयन के लिए आवश्यक है कि उत्पादों में एक नाभिक सम्मिलित हो जो अभिकारकों से भारी हो। प्रकाश तत्व संलयन या विखंडन द्वारा ऊर्जा उत्पन्न करने वाली परमाणु अंतःक्रिया का अनुभव कर सकते हैं। दो हाइड्रोजन समस्थानिकों के मध्य और हाइड्रोजन तथा हीलियम-3 के मध्य सभी ऊर्जा उत्पादक परमाणु अंतःक्रियाएं संलयन होती हैं क्योंकि इन अंतःक्रियाओं के उत्पाद में एक भारी नाभिक सम्मिलित होता है। हालाँकि, लिथियम-6 के साथ न्यूट्रॉन की ऊर्जा उत्पादक परमाणु अंतःक्रिया हाइड्रोजन-3 और हीलियम-4 का निर्माण करती है, प्रत्येक एक हल्का नाभिक होता है। उपरोक्त परिभाषा के अनुसार, यह परमाणु अंतःक्रिया विखंडन है, संलयन नहीं। जब विखंडन न्यूट्रॉन के कारण होता है, जैसा कि इस स्थिति में है, तो इसे प्रेरित विखंडन कहा जाता है।
प्रकाश तत्व ऊर्जा उत्पादक परमाणु अंतःक्रिया:
संलयन
- 1H+ 1H → 2He Q ≈ 1.44 MeV
- 1H+ 2H → 3He Q ≈ 5.52 MeV
- 2H+ 2H → 3H + p+ Q ≈ 4.08 MeV
- 2H+ 2H → 3He + n Q ≈ 3.27 MeV
- 2H+ 3H → 4He + n Q ≈ 17.53 MeV
- 2H + 3He → 4He + p+ Q ≈ 18.34 MeV
- 3He + 3He → 4He + p+ + p+ Q ≈ 12.85 MeV
- 3He + 6Li → 4He + 4He + p+ Q ≈ 22.36 MeV
विखंडन
- 6Li + p+ → 4He + 3He Q ≈ 4.02 MeV
- 6Li + 2H → 4He + 4He Q ≈ 11.18 MeV
- 6Li + 3He → 4He + 4He + p+ Q ≈ 0.94 MeV
- 7Li + p+ → 4He + 4He Q ≈ 17.34 MeV
- 7Li + 2H → 4He + 4He + n Q ≈ 15.11 MeV
- 11B + p+ → 4He + 4He + 4He Q ≈ 8.68 MeV
परमाणुओं के लिए बंधन ऊर्जा
किसी परमाणु की बंधन ऊर्जा (उसके इलेक्ट्रॉनों सहित) बिल्कुल परमाणु के नाभिक की बंधन ऊर्जा के समान नहीं होती है। समस्थानिक की मापी गई द्रव्यमान कमी को सदैव उस समस्थानिक और अधिकतर में MeV/c2 के तटस्थ परमाणुओं की द्रव्यमान कमी के रूप में सूचीबद्ध किया जाता है। परिणामस्वरूप, सूचीबद्ध द्रव्यमान कमी पृथक नाभिक की स्थिरता या बंधन ऊर्जा का माप नहीं है, बल्कि सम्पूर्ण परमाणुओं के लिए है। इसका एक बहुत ही व्यावहारिक कारण है, अर्थात् भारी तत्वों को पूर्णतया से आयनित करना, अर्थात उनके सभी इलेक्ट्रॉनों को अलग करना बहुत कठिन है।
यह अभ्यास अन्य कारणों से भी उपयोगी है: एक भारी अस्थिर नाभिक से सभी इलेक्ट्रॉनों को पृथक करना (इस प्रकार एक अनावृत नाभिक का निर्माण करना) नाभिक के जीवनकाल को बदल देता है, या एक स्थिर तटस्थ परमाणु का नाभिक भी अलग करने के बाद अस्थिर हो सकता है, जो दर्शाता है कि नाभिक का स्वतंत्र रूप से उपचारित नहीं किया जा सकता है। इसके उदाहरण जीएसआई भारी आयन त्वरक पर किए गए परिबद्ध अवस्था β क्षय प्रयोगों में दर्शाए गए हैं।[17][18] यह इलेक्ट्रॉन परिग्रह जैसी घटनाओं से भी स्पष्ट है। सैद्धांतिक रूप से, भारी परमाणुओं के परमाणु कक्षीय मॉडल में, इलेक्ट्रॉन आंशिक रूप से नाभिक के भीतर परिक्रमा करता है (यह कठोर भाव में परिक्रमा नहीं करता है, लेकिन नाभिक के भीतर स्थित होने की एक गैर-लुप्त संभावना है)।
नाभिकीय क्षय नाभिक में होता है, जिसका अर्थ है कि घटना में नाभिक से संबंधित गुण बदल जाते हैं। भौतिकी के क्षेत्र में "बंधन ऊर्जा" के माप के रूप में द्रव्यमान की कमी की अवधारणा का अर्थ तटस्थ परमाणु (केवल नाभिक नहीं) की द्रव्यमान की कमी है और यह सम्पूर्ण परमाणु की स्थिरता का एक उपाय है।
परमाणु बंधन ऊर्जा वक्र
तत्वों की आवर्त सारणी में, हाइड्रोजन से सोडियम तक प्रकाश तत्वों की श्रृंखला में परमाणु द्रव्यमान बढ़ने के साथ-साथ प्रति न्यूक्लियॉन में सामान्यतः बढ़ती बंधन ऊर्जा देखी जाती है। यह वृद्धि नाभिक में प्रति न्यूक्लियॉन पर बल बढ़ने से उत्पन्न होती है, क्योंकि प्रत्येक अतिरिक्त न्यूक्लियॉन अन्य निकटवर्ती न्यूक्लियॉन द्वारा आकर्षित होता है और इस प्रकार संपूर्ण से अधिक मजबूती से बंधा हुआ है। हीलियम-4 और ऑक्सीजन-16 इस प्रवृत्ति के विशेष रूप से स्थिर अपवाद हैं (दाईं ओर चित्र देखें)। ऐसा इसलिए है क्योंकि उनमें अतिस्थायित्व है, जिसका अर्थ है कि उनके प्रोटॉन और न्यूट्रॉन दोनों अपने संबंधित परमाणु कोश को भरते हैं।
बढ़ती बंधन ऊर्जा के क्षेत्र के बाद द्रव्यमान 30 से लेकर द्रव्यमान 90 तक क्रम में सापेक्ष स्थिरता (संतृप्ति) का क्षेत्र आता है। इस क्षेत्र में, नाभिक इतना बड़ा हो गया है कि परमाणु बल अब इसकी चौड़ाई में पूर्णतया से कुशलतापूर्वक विस्तार नहीं कर पाते हैं। इस क्षेत्र में आकर्षक परमाणु बल, जैसे-जैसे परमाणु द्रव्यमान बढ़ता है, परमाणु संख्या बढ़ने पर प्रोटॉन के मध्य विकर्षक विद्युत चुम्बकीय बलों द्वारा लगभग संतुलित हो जाते हैं।
अंत में, भारी तत्वों में, परमाणु संख्या बढ़ने पर प्रति न्यूक्लियॉन बंधन ऊर्जा में धीरे-धीरे कमी आती है। परमाणु आकार के इस क्षेत्र में, विद्युत चुम्बकीय प्रतिकारक बल प्रबल परमाणु बल आकर्षण पर नियंत्रण पाने लगे हैं।
बंधन ऊर्जा के चरम पर, निकेल-62 सबसे प्रबलता से बंधा हुआ नाभिक (प्रति न्यूक्लियॉन) है, इसके बाद आयरन-58 और आयरन-56 हैं।[19] यह अनुमानित बुनियादी कारण है कि ग्रहों के अंतर्भाग में आयरन और निकल बहुत सामान्य धातुएं हैं, क्योंकि वे सुपर्नोवा में अंतिम उत्पादों के रूप में और सितारों में सिलिकॉन जलने के अंतिम चरण में प्रचुर मात्रा में उत्पादित होते हैं। हालाँकि, यह प्रति परिभाषित न्यूक्लियॉन (जैसा कि ऊपर परिभाषित है) के लिए बंधन ऊर्जा नहीं है, जो नियंत्रित करता है कि वास्तव में कौन से नाभिक बने हैं, क्योंकि तारों के भीतर, न्यूट्रॉन और प्रोटॉन प्रति वर्गीय न्यूक्लियॉन और भी अधिक ऊर्जा विमुक्त करने के लिए अंतर-परिवर्तित हो सकते हैं। वास्तव में, यह तर्क दिया गया है कि न्यूट्रॉन के प्रोटॉन में इस बीटा क्षय रूपांतरण के कारण, अत्यंत उष्ण तारे के अंतर्भाग में 62Ni 62 का 56Fe बनाने के लिए फोटोविघटन ऊर्जावान रूप से संभव हो सकता है।[20] यह 56Fe के निर्माण का पक्षधर है, प्रति न्यूक्लियॉन सबसे कम द्रव्यमान वाला न्यूक्लाइड है। हालाँकि, उच्च तापमान पर सभी पदार्थ न्यूनतम ऊर्जा अवस्था में नहीं होंगे। यह ऊर्जावान अधिकतम परिवेशीय स्थितियों के लिए भी होना चाहिए, मान लीजिए, T = 298 K और p = 1 atm, 56Fe परमाणुओं से युक्त तटस्थ संघनित पदार्थ के लिए - हालाँकि, इन स्थितियों में परमाणुओं के नाभिक को पदार्थ की सबसे स्थिर और कम ऊर्जा अवस्था में संलयन से रोका जाता है।
प्रति न्यूक्लियॉन उच्च बंधन ऊर्जा वाले तत्व, जैसे आयरन और निकल, विखंडन से नहीं गुजर सकते हैं, लेकिन वे सैद्धांतिक रूप से हाइड्रोजन, ड्यूटेरियम, हीलियम और कार्बन के साथ संलयन से गुजर सकते हैं, उदाहरण के लिए:[21]
- 62Ni + 12C → 74Se Q = 5.467 MeV
सामान्यतः यह माना जाता है कि यांत्रिकीय कारणों से ब्रह्मांड में आयरन-56 निकल-56 समस्थानिक की तुलना में अधिक सामान्य है, क्योंकि इसका अस्थिर प्रजनक निकेल-56 सुपर्नोवा के भीतर 14 हीलियम नाभिकों के चरणबद्ध निर्माण द्वारा प्रचुर मात्रा में बनाया गया है, जहां कुछ ही मिनटों में अंतरतारकीय माध्यम में छोड़े जाने से पहले इसके पास आयरन में क्षय होने का समय नहीं होता है, क्योंकि सुपर्नोवा विस्फोट होता है। हालाँकि, निकेल-56 फिर कुछ ही हफ्तों में कोबाल्ट-56 में परिवर्तित हो जाता है, फिर यह विकिरण समस्थानिक अंततः लगभग 77.3 दिनों की अर्ध आयु के साथ आयरन-56 में परिवर्तित हो जाता है। ऐसी प्रक्रिया का रेडियोधर्मी क्षय-संचालित प्रकाश वक्र एसएन 1987ए जैसे प्रकार II सुपर्नोवा में घटित होता देखा गया है। किसी तारे में, अल्फा-अतिरिक्त प्रक्रियाओं द्वारा निकेल-62 बनाने का कोई अच्छा तरीका नहीं है, अन्यथा संभवतः ब्रह्मांड में इस अत्यधिक स्थिर न्यूक्लाइड की संख्या अधिक होगी।
बंधन ऊर्जा और न्यूक्लाइड द्रव्यमान
This section does not cite any sources. (अक्टूबर 2014) (Learn how and when to remove this template message) |
तथ्य यह है कि अधिकतम बंधन ऊर्जा मध्यम आकार के नाभिक में पाई जाती है, यह दो विरोधी बलों के प्रभावों में दुविधा का परिणाम है जिनकी अलग-अलग सीमा विशेषताएँ हैं। आकर्षक परमाणु बल (प्रबल परमाणु बल), जो प्रोटॉन और न्यूट्रॉन को एक-दूसरे से समान रूप से बांधता है, दूरी के साथ इस बल में तीव्रता से घातीय कमी के कारण इसकी सीमा सीमित होती है। हालाँकि, विकर्षक विद्युत चुम्बकीय बल, जो नाभिक को अलग करने के लिए प्रोटॉन के मध्य कार्य करता है, दूरी के साथ बहुत धीरे-धीरे कम हो जाता है (दूरी के व्युत्क्रम वर्ग के रूप में)। व्यास में लगभग चार न्यूक्लियॉन से बड़े नाभिक के लिए, अतिरिक्त प्रोटॉन का अतिरिक्त प्रतिकारक बल किसी भी बंधन ऊर्जा को पूर्ण करता है जो अतिरिक्त प्रबल बल अन्योन्यक्रिया के परिणामस्वरूप आगे जोड़े गए न्यूक्लियॉन के मध्य होता है। जैसे-जैसे उनका आकार बढ़ता है, ऐसे नाभिक कम प्रबलता से बंधे होते हैं, हालांकि उनमें से अधिकांश अभी भी स्थिर हैं। अंत में, 209 से अधिक न्यूक्लियॉन (व्यास में लगभग 6 न्यूक्लियॉन से बड़े) वाले सभी नाभिक स्थिर होने के लिए बहुत बड़े होते हैं और छोटे नाभिकों में स्वतःस्फूर्त क्षय के अधीन होते हैं।
परमाणु संलयन सबसे हल्के तत्वों को अधिक प्रबलता से बंधे तत्वों (जैसे हाइड्रोजन को हीलियम में) में मिलाकर ऊर्जा उत्पन्न करता है, और परमाणु विखंडन सबसे भारी तत्वों (जैसे यूरेनियम और प्लूटोनियम) को अधिक प्रबलता से बंधे तत्वों (जैसे बेरियम और क्रिप्टॉन) में विभाजित करके ऊर्जा उत्पन्न करता है। कुछ हल्के तत्वों (जैसे लिथियम) का परमाणु विखंडन इसलिए होता है क्योंकि हीलियम-4 एक उत्पाद है और थोड़े भारी तत्वों की तुलना में अधिक प्रबलता से बंधा हुआ तत्व है। दोनों प्रक्रियाएँ ऊर्जा उत्पन्न करती हैं क्योंकि उत्पादों के द्रव्यमान का योग प्रतिक्रियाशील नाभिक के द्रव्यमान के योग से कम होता है।
जैसा कि ऊपर ड्यूटेरियम के उदाहरण में देखा गया है, परमाणु बंधन ऊर्जाएं इतनी बड़ी हैं कि उन्हें द्रव्यमान और ऊर्जा की समानता के अनुसार, आंशिक द्रव्यमान कमी के रूप में सरलता से मापा जा सकता है। परमाणु बंधन ऊर्जा केवल विमुक्त ऊर्जा (और द्रव्यमान) की मात्रा है, जब मुक्त न्यूक्लियॉन का एक संग्रह परमाणु नाभिक बनाने के लिए एक साथ जुड़ जाता है।
परमाणु बंधन ऊर्जा की गणना नाभिक के द्रव्यमान में अंतर और नाभिक बनाने वाले मुक्त न्यूट्रॉन और प्रोटॉन की संख्या के द्रव्यमान के योग से की जा सकती है। एक बार जब यह द्रव्यमान अंतर, जिसे द्रव्यमान दोष या द्रव्यमान कमी कहा जाता है, ज्ञात हो जाता है, तो आइंस्टीन का द्रव्यमान-ऊर्जा तुल्यता सूत्र E = mc2 का उपयोग किसी भी नाभिक की बंधन ऊर्जा की गणना करने के लिए किया जा सकता है। प्रारंभिक परमाणु भौतिक विज्ञानी इस मान की गणना को "संकुलन गुणांक" गणना के रूप में संदर्भित करते थे।
उदाहरण के लिए, डाल्टन(1 Da) को 12C परमाणु के द्रव्यमान के 1/12 के रूप में परिभाषित किया गया है - लेकिन 1H परमाणु (जो एक प्रोटॉन और इलेक्ट्रॉन है) का परमाणु द्रव्यमान 1.007825 Da है, इसलिए 12C में प्रत्येक न्यूक्लियॉन लुप्त हो गया है, औसतन, इसके द्रव्यमान का लगभग 0.8% बंधन ऊर्जा के रूप में होता है।
परमाणु बंधन ऊर्जा के लिए अर्धअनुभभार्य सूत्र
Z प्रोटॉन और N न्यूट्रॉन सहित A न्यूक्लियॉन वाले नाभिक के लिए, प्रति न्यूक्लियॉन बंधन ऊर्जा (EB) के लिए एक अर्ध-अनुभवजन्य सूत्र है:
पहला पद इसे संतृप्ति योगदान कहा जाता है और यह सुनिश्चित करता है कि प्रति न्यूक्लियॉन बंधन ऊर्जा पहले सन्निकटन तक सभी नाभिकों के लिए समान है। पद एक सतह विभव प्रभाव है और यह परमाणु सतह पर स्थित न्यूक्लियॉन की संख्या के समानुपाती होता है; यह हल्के नाभिकों के लिए सबसे बड़ा है। पद कूलम्ब स्थिरवैद्युत प्रतिकर्षण है; जैसे-जैसे Z बढ़ता है यह और अधिक महत्वपूर्ण हो जाता है। समरूपता सुधार पद इस तथ्य को ध्यान में रखता है कि अन्य प्रभावों की अनुपस्थिति में सबसे स्थिर व्यवस्था में प्रोटॉन और न्यूट्रॉन की समान संख्या होती है; इसका कारण यह है कि नाभिक में n-p अन्योन्यक्रिया n-n या p-p अन्योन्यक्रिया से अधिक प्रबल है। युग्म पद विशुद्ध रूप से अनुभवजन्य है; यह सम-सम नाभिकों के लिए + और विषम-विषम नाभिकों के लिए - है। जब A विषम होता है, तो युग्म पद समान रूप से शून्य होता है।
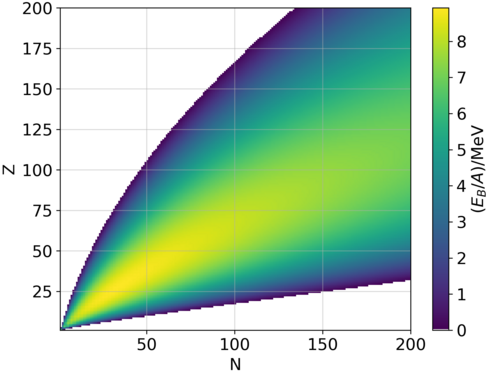
प्रयोगात्मक रूप से मापे गए परमाणु न्यूक्लाइड द्रव्यमान से निकाले गए उदाहरण मान
निम्न तालिका कुछ बंधन ऊर्जाओं और द्रव्यमान दोष मानों को सूचीबद्ध करती है।[22] यह भी ध्यान दें कि हम 1 Da = 931.494028(23) MeV/c2 का उपयोग करते हैं। बंधन ऊर्जा की गणना करने के लिए हम सूत्र Z (mp + me) + N mn − mnuclide का उपयोग करते हैं जहां Z न्यूक्लाइड में प्रोटॉन की संख्या और N उनके न्यूट्रॉन की संख्या को दर्शाता है। हम mp = 938.2720813(58) MeV/c2, me = 0.5109989461(30) MeV/c2 और mn = 939.5654133(58) MeV/c2 लेते हैं। अक्षर A, Z और N (न्यूक्लाइड में न्यूक्लियॉन की संख्या) के योग को दर्शाता है। यदि हम मानते हैं कि संदर्भ न्यूक्लियॉन में न्यूट्रॉन का द्रव्यमान है (ताकि गणना की गई सभी "कुल" बंधन ऊर्जा अधिकतम हो) तो हम कुल बंधन ऊर्जा को नाभिक के द्रव्यमान और A मुक्त न्यूट्रॉन के संग्रह के द्रव्यमान के अंतर के रूप में परिभाषित कर सकते हैं। दूसरे शब्दों में, यह (Z + N) mn − mnuclide होगा। "प्रति न्यूक्लियॉन कुल बंधन ऊर्जा" यह मान A से विभाजित होगा।
| न्यूक्लाइड | Z | N | द्रव्यमान की अधिकता | कुल द्रव्यमान | कुल द्रव्यमान / A | कुल बंधन ऊर्जा / A | द्रव्यमान क्षति | बंधन ऊर्जा | बंधन ऊर्जा / A |
|---|---|---|---|---|---|---|---|---|---|
| 56Fe | 26 | 30 | −60.6054 एमईवी | 55.934937 डीए | 0.9988372 डीए | 9.1538 एमईवी | 0.528479 डीए | 492.275 एमईवी | 8.7906 एमईवी |
| 58Fe | 26 | 32 | −62.1534 एमईवी | 57.932276 डीए | 0.9988496 डीए | 9.1432 एमईवी | 0.547471 डीए | 509.966 एमईवी | 8.7925 एमईवी |
| 60Ni | 28 | 32 | −64.472 एमईवी | 59.93079 डीए | 0.9988464 डीए | 9.1462 एमईवी | 0.565612 डीए | 526.864 एमईवी | 8.7811 एमईवी |
| 62Ni | 28 | 34 | −66.7461 एमईवी | 61.928345 डीए | 0.9988443 डीए | 9.1481 एमईवी | 0.585383 डीए | 545.281 एमईवी | 8.7948 एमईवी |
56Fe में इस तालिका में सूचीबद्ध चार न्यूक्लाइडों में से सबसे कम न्यूक्लियॉन-विशिष्ट द्रव्यमान है, लेकिन इसका अर्थ यह नहीं है कि यह प्रति हैड्रॉन सबसे प्रबल बाध्य परमाणु है, जब तक कि प्रारंभिक हैड्रॉन का विकल्प पूर्णतया से मुक्त न हो। यदि न्यूक्लाइड बनाने के लिए 56 न्यूक्लिऑन की अनुमति दी जाती है तो आयरन सबसे बड़ी ऊर्जा छोड़ता है - यदि आवश्यक हो तो एक को दूसरे में बदलना, प्रति हैड्रॉन में उच्चतम बंधन ऊर्जा, हैड्रॉन में प्रोटॉन Z की समान संख्या और कुल न्यूक्लियॉन A के रूप में प्रारम्भ होता है जैसा कि बाध्य नाभिक, 62Ni में होता है। इस प्रकार, किसी नाभिक की कुल बंधन ऊर्जा का वास्तविक निरपेक्ष मान इस बात पर निर्भर करता है कि हमें किस चीज़ से नाभिक का निर्माण करने की अनुमति है। यदि द्रव्यमान संख्या A के सभी नाभिकों को A न्यूट्रॉन से निर्मित करने की अनुमति दी जाए, तो 56Fe प्रति न्यूक्लियॉन सबसे अधिक ऊर्जा विमुक्त करेगा, क्योंकि इसमें 62Ni की तुलना में प्रोटॉन का एक बड़ा अंश है। हालाँकि, यदि नाभिक का निर्माण केवल उतनी ही संख्या में प्रोटॉन और न्यूट्रॉन से किया जाना आवश्यक है, जो उनमें उपस्थित हैं, तो प्रति न्यूक्लियॉन निकल -62 सबसे कसकर बंधा हुआ नाभिक है।
| न्यूक्लाइड | Z | N | द्रव्यमान की अधिकता | कुल द्रव्यमान | कुल द्रव्यमान / A | कुल बंधन ऊर्जा / A | द्रव्यमान क्षति | बंधन ऊर्जा | बंधन ऊर्जा / A |
|---|---|---|---|---|---|---|---|---|---|
| n | 0 | 1 | 8.0716 एमईवी | 1.008665 डीए | 1.008665 डीए | 0.0000 एमईवी | 0 डीए | 0 एमईवी | 0 एमईवी |
| 1H | 1 | 0 | 7.2890 एमईवी | 1.007825 डीए | 1.007825 डीए | 0.7826 एमईवी | 0.0000000146 डीए | 0.0000136 एमईवी | 13.6 ईवी |
| 2H | 1 | 1 | 13.13572 एमईवी | 2.014102 डीए | 1.007051 डीए | 1.50346 एमईवी | 0.002388 डीए | 2.22452 एमईवी | 1.11226 एमईवी |
| 3H | 1 | 2 | 14.9498 एमईवी | 3.016049 डीए | 1.005350 डीए | 3.08815 एमईवी | 0.0091058 डीए | 8.4820 एमईवी | 2.8273 एमईवी |
| 3He | 2 | 1 | 14.9312 एमईवी | 3.016029 डीए | 1.005343 डीए | 3.09433 एमईवी | 0.0082857 डीए | 7.7181 एमईवी | 2.5727 एमईवी |
उपरोक्त तालिका में यह देखा जा सकता है कि न्यूट्रॉन के क्षय के साथ-साथ ट्रिटियम के हीलियम-3 में परिवर्तन से ऊर्जा निकलती है; इसलिए, समान संख्या में न्यूट्रॉन के द्रव्यमान (और कुल हैड्रोन की संख्या के अनुसार एक हल्की स्थिति) के विरुद्ध मापा जाने पर यह एक प्रबल बाध्य नई स्थिति को प्रकट करता है। इस तरह की प्रतिक्रियाएं न्यूट्रॉन और प्रोटॉन की पहले से तय N और Z संख्या से गणना की गई बंधन ऊर्जा में परिवर्तन से प्रेरित नहीं होती हैं, बल्कि प्रतिक्रिया के साथ न्यूक्लाइड/प्रति न्यूक्लियॉन के कुल द्रव्यमान में कमी आती हैं (ध्यान दें कि हाइड्रोजन-1 के लिए ऊपर दी गई बंधन ऊर्जा परमाणु बंधन ऊर्जा है, न कि परमाणु बंधन ऊर्जा जो शून्य होगी)।
संदर्भ
- ↑ 1.0 1.1 1.2 1.3 "Nuclear binding energy". How to solve for nuclear binding energy. Guides to solving many of the types of quantitative problems found in Chemistry 116. Purdue University. July 2010. Retrieved 2010-07-10. Guides
- ↑ Nave, Rod (July 2010). "Nuclear Binding Energy". Hyperphysics – a free web resource from GSU. Georgia State University. Retrieved 2010-07-11.
- ↑ "Nuclear Energy". Energy Education is an interactive curriculum supplement for secondary-school science students, funded by the U. S. Department of Energy and the Texas State Energy Conservation Office (SECO). U. S. Department of Energy and the Texas State Energy Conservation Office (SECO). July 2010. Archived from the original on 2011-02-26. Retrieved 2010-07-10.
- ↑ 4.0 4.1 Stern, Dr. David P. (September 23, 2004). "Nuclear Physics". "From Stargazers to Starships" Public domain content. NASA website. Retrieved 2010-07-11.
- ↑ 5.0 5.1 5.2 5.3 5.4 5.5 Stern, Dr. David P. (November 15, 2004). "A Review of Nuclear Structure". "From Stargazers to Starships" Public domain content. NASA website. Retrieved 2010-07-11.
- ↑ "It's Elemental – The Element Helium". education.jlab.org. Retrieved 2019-11-05.
- ↑ Frisch, David H.; Thorndike, Alan M. (1964). प्राथमिक कण. Princeton, New Jersey: David Van Nostrand. pp. 11–12.
- ↑ "20.8: Converting Mass to Energy: Mass Defect and Nuclear Binding Energy". Chemistry LibreTexts (in English). 2016-03-11. Retrieved 2019-11-05.
- ↑ Pourshahian, Soheil (2017-09-01). "परमाणु भौतिकी से मास स्पेक्ट्रल विश्लेषण तक बड़े पैमाने पर दोष". Journal of the American Society for Mass Spectrometry (in English). 28 (9): 1836–1843. Bibcode:2017JASMS..28.1836P. doi:10.1007/s13361-017-1741-9. ISSN 1879-1123. PMID 28733967. S2CID 34178643.
- ↑ Lilley, J.S. (2006). Nuclear Physics: Principles and Applications (Repr. with corrections Jan. 2006. ed.). Chichester: J. Wiley. pp. 7. ISBN 0-471-97936-8.
- ↑ "प्राकृतिक शक्तियों की अंतःक्रिया पर" (in English). 1854. Retrieved 2022-12-24.
- ↑ 12.0 12.1 12.2 12.3 12.4 12.5 12.6 12.7 12.8 12.9 Stern, Dr. David P. (February 11, 2009). "Nuclear Binding Energy". "From Stargazers to Starships" Public domain content. NASA website. Retrieved 2010-07-11.
- ↑ The energy released is slightly less than the binding energy of helium because the starting point is four protons, rather than two protons and two neutrons.
- ↑ N R Sree Harsha, "The tightly bound nuclei in the liquid drop model", Eur. J. Phys. 39 035802 (2018), doi:10.1088/1361-6404/aaa345
- ↑ "सीसे को सोने में बदलना". Archived from the original on 2011-07-17. Retrieved 2010-05-04.
- ↑ "Marie Curie – X-rays and Uranium Rays". aip.org. Retrieved 2006-04-10.
- ↑ Jung, M.; et al. (1992). "First observation of bound-state β− decay". Physical Review Letters. 69 (15): 2164–2167. Bibcode:1992PhRvL..69.2164J. doi:10.1103/PhysRevLett.69.2164. PMID 10046415.
- ↑ Bosch, F.; et al. (1996). "Observation of bound-state beta minus decay of fully ionized 187Re: 187Re–187Os Cosmochronometry". Physical Review Letters. 77 (26): 5190–5193. Bibcode:1996PhRvL..77.5190B. doi:10.1103/PhysRevLett.77.5190. PMID 10062738.
- ↑ Fewell, M. P. (1995). "उच्चतम माध्य बंधन ऊर्जा वाला परमाणु न्यूक्लाइड". American Journal of Physics. 63 (7): 653–658. Bibcode:1995AmJPh..63..653F. doi:10.1119/1.17828.
- ↑ M.P. Fewell, 1995
- ↑ From the difference of binding energy, 5.467 = 642.891 − 545.262 − 92.162, values from Einstein Online.
- ↑ Jagdish K. Tuli, Nuclear Wallet Cards, 7th edition, April 2005, Brookhaven National Laboratory, US National Nuclear Data Center
बाहरी संबंध
 Media related to परमाणु बंधन ऊर्जा at Wikimedia Commons
Media related to परमाणु बंधन ऊर्जा at Wikimedia Commons
