द्रव्य का संरक्षण: Difference between revisions
(para edited) |
(minor changes) |
||
| Line 33: | Line 33: | ||
CH<sub>4</sub> + 2O<sub>2</sub> → CO<sub>2</sub> + 2H<sub>2</sub>O | CH<sub>4</sub> + 2O<sub>2</sub> → CO<sub>2</sub> + 2H<sub>2</sub>O | ||
जहां [[:hi:मिथेन|मीथेन]] का एक [[:hi:अणु|अणु]] ( | जहां [[:hi:मिथेन|मीथेन]] का एक [[:hi:अणु|अणु]] (CH<sub>4</sub>) और दो [[:hi:ऑक्सीजन|ऑक्सीजन]] के अणु (O<sub>2</sub>) [[:hi:कार्बन डाईऑक्साइड|कार्बन डाइऑक्साइड]] के एक अणु (CO<sub>2</sub>) और दो [[:hi:जल|जल]] के अणुओं (H<sub>2</sub>O) में परिवर्तित हो जाते हैं। अभिक्रिया में शुरू में चार [[:hi:हाइड्रोजन|हाइड्रोजन]] परमाणु, चार ऑक्सीजन परमाणु और एक कार्बन परमाणु मौजूद हैं तथा अभिक्रिया पश्चात् उत्पाद के अणुओं की संख्या समान है यह संख्या द्रव्यमान के संरक्षण के सिद्धांत से प्राप्त की जा सकती है। | ||
समय के साथ किसी दिए गए सिस्टम के बड़े पैमाने पर वितरण का पालन करके कई [[:hi:अभियान्त्रिकी| | समय के साथ किसी दिए गए सिस्टम के बड़े पैमाने पर वितरण का पालन करके कई [[:hi:अभियान्त्रिकी|अभियान्त्रिकी]] समस्याओं का समाधान किया जाता है; इस पद्धति को [[:hi:द्रव्यमान संतुलन|द्रव्यमान संतुलन]] के रूप में जाना जाता है। | ||
==इतिहास== | ==इतिहास== | ||
[[File:M.V. Lomonosov by L.Miropolskiy after G.C.Prenner (1787, RAN).jpg|thumb|रूसी वैज्ञानिक [[:hi:मिखाइल लोमोनोसोव|मिखाइल लोमोनोसोव]] ने 1756 में प्रयोगों द्वारा बड़े पैमाने पर संरक्षण के कानून की खोज की, और इस निष्कर्ष पर पहुंचे कि [[:hi:फ्लॉजिस्टन सिद्धांत|फ्लॉजिस्टन सिद्धांत]] गलत है। <ref>{{Cite book|title=Entropy and Information|edition=illustrated|first=Mikhail V.|last=Volkenstein|publisher=[[Springer Science & Business Media]]|year=2009|isbn=978-3-0346-0078-1|page=20|url=https://books.google.com/books?id=v6noGJ4YJz4C}} [https://books.google.com/books?id=v6noGJ4YJz4C&pg=PA20&dq=mass+conservation+lomonosov Extract of page 20]</ref> <ref>{{Cite book|title=Energy and Mass in Relativity Theory|first=Lev Borisovič|last=Okuň|publisher=[[World Scientific]]|year=2009|isbn=978-981-281-412-8|page=253|url=https://books.google.com/books?id=OjgTS12V0VUC}} [https://books.google.com/books?id=OjgTS12V0VUC&pg=PA253&dq=mass+conservation+lomonosov Extract of page 253]</ref> <ref>{{Cite book|title=Early Russian Organic Chemists and Their Legacy|edition=illustrated|first=David|last=Lewis|publisher=Springer Science & Business Media|year=2012|isbn=978-3-642-28219-5|page=29|url=https://books.google.com/books?id=KaDEDmzwhlsC}} [https://books.google.com/books?id=KaDEDmzwhlsC&pg=PA29&dq=mass+conservation+lomonosov+phlogiston Extract of page 29]</ref>|313x313px]] | [[File:M.V. Lomonosov by L.Miropolskiy after G.C.Prenner (1787, RAN).jpg|thumb|रूसी वैज्ञानिक [[:hi:मिखाइल लोमोनोसोव|मिखाइल लोमोनोसोव]] ने 1756 में प्रयोगों द्वारा बड़े पैमाने पर संरक्षण के कानून की खोज की, और इस निष्कर्ष पर पहुंचे कि [[:hi:फ्लॉजिस्टन सिद्धांत|फ्लॉजिस्टन सिद्धांत]] गलत है। <ref>{{Cite book|title=Entropy and Information|edition=illustrated|first=Mikhail V.|last=Volkenstein|publisher=[[Springer Science & Business Media]]|year=2009|isbn=978-3-0346-0078-1|page=20|url=https://books.google.com/books?id=v6noGJ4YJz4C}} [https://books.google.com/books?id=v6noGJ4YJz4C&pg=PA20&dq=mass+conservation+lomonosov Extract of page 20]</ref> <ref>{{Cite book|title=Energy and Mass in Relativity Theory|first=Lev Borisovič|last=Okuň|publisher=[[World Scientific]]|year=2009|isbn=978-981-281-412-8|page=253|url=https://books.google.com/books?id=OjgTS12V0VUC}} [https://books.google.com/books?id=OjgTS12V0VUC&pg=PA253&dq=mass+conservation+lomonosov Extract of page 253]</ref> <ref>{{Cite book|title=Early Russian Organic Chemists and Their Legacy|edition=illustrated|first=David|last=Lewis|publisher=Springer Science & Business Media|year=2012|isbn=978-3-642-28219-5|page=29|url=https://books.google.com/books?id=KaDEDmzwhlsC}} [https://books.google.com/books?id=KaDEDmzwhlsC&pg=PA29&dq=mass+conservation+lomonosov+phlogiston Extract of page 29]</ref>|313x313px]] | ||
Revision as of 12:06, 18 July 2022
भौतिकी एवं रसायन विज्ञान में, द्रव्यमान के संरक्षण के नियम या सिद्धांत के अनुसार वह बंद निकाय जिसमे पदार्थ एवं ऊर्जा का स्थानांतरण अनिवार्य न हो तथा इनकी मात्रा न तो जोड़ी जा सकती है और न ही घटाई जा सकती है, अत: निकाय का द्रव्यमान संरक्षित (निकाय का द्रव्यमान समय के साथ स्थिर) रहता है।
इस नियम का तात्पर्य है कि द्रव्यमान को न तो उत्पन्न किया जा सकता है और न ही नष्ट किया जा सकता है, हालांकि इसे अंतरिक्ष में पुनर्व्यवस्थित किया जा सकता है, या इससे जुड़ी संस्थाओं को रूप में बदला जा सकता है। उदाहरण के लिए, रासायनिक अभिक्रियाओं में, अभिक्रिया से पहले अभिकारकों का द्रव्यमान अभिक्रिया के बाद के अभिकारकों के द्रव्यमान के बराबर होता है। इस प्रकार, विलगित निकाय में किसी भी रासायनिक अभिक्रिया और कम-ऊर्जा कि उष्मागतिकी प्रक्रियाओं के दौरान, अभिकारकों या उपादान का कुल द्रव्यमान उत्पादों के द्रव्यमान के बराबर होना चाहिए।
रसायन विज्ञान, यांत्रिकी और द्रव गतिकी में द्रव्यमान संरक्षण की अवधारणा का व्यापक रूप से उपयोग किया जाता है। ऐतिहासिक रूप से, रासायनिक अभिक्रियाओं में द्रव्यमान का संरक्षण मिखाइल लोमोनोसोव द्वारा स्वतंत्र रूप से प्रमाणित किया गया था और बाद में 18 वीं शताब्दी के अंत में एंटोनी लावोसियर द्वारा पुनः खोजा गया था। कीमिया से आधुनिक प्राकृतिक रसायन विज्ञान की प्रगति में इस नियम का महत्वपूर्ण महत्व था।
वास्तव में, द्रव्यमान का संरक्षण केवल सन्निकटत धारण करता है और चिरसम्मत यांत्रिकी में पूर्वधारणाओं की श्रृंखला का हिस्सा माना जाता है। द्रव्यमान-ऊर्जा तुल्यता के सिद्धांत के तहत क्वांटम यांत्रिकी और विशेष सापेक्षता के नियमों का पालन करने के लिए नियमो को संशोधित किया जाना है, जिसके अनुसार ऊर्जा और द्रव्यमान एक संरक्षित मात्रा बनाते हैं। अत्याधिक ऊर्जावान प्रणालियों (जैसे परमाणु अभिक्रियाओं और कण भौतिकी में कण-प्रतिकण विनाश) के लिए द्रव्यमान का संरक्षण नहीं होता।
वह निकाय जिसमे ऊर्जा तथा पदर्थ दोनो का ही विनिमय होता है, खुला निकाय कैहलाता है तथा खुले निकाय का द्रव्यमान संरक्षित नहीं होता है। हालांकि, जब तक रेडियोधर्मिता या नाभिकीय अभिक्रिया शामिल नहीं होती हैं, ऊर्जा, यांत्रिक कार्य, या विद्युत चुम्बकीय विकिरण जैसी प्रणालियों से निकलने (या प्रवेश) वाली ऊर्जा की मात्रा अक्सर सिस्टम के द्रव्यमान में कमी (या वृद्धि) के रूप में मापने के लिए बहुत छोटी होती है।
सामान्य सापेक्षता को ध्यान में रखकर, उन प्रणालियों के लिए जिनमें बड़े गुरुत्वाकर्षण क्षेत्र शामिल हैं, इस प्रकार विभिन्न परिभाषाओं के अधीन द्रव्यमान-ऊर्जा संरक्षण एक अधिक जटिल अवधारणा बन जाती है, विशेष सापेक्षता कि तुलना में द्रव्यमान और ऊर्जा उतनी ही सख्ती से और सरलता से संरक्षित नहीं होते है।
सूत्रीकरण और उदाहरण
| Part of a series on |
| सातत्यक यांत्रिकी |
|---|
द्रव्यमान के संरक्षण का नियम केवल चिरसम्मत यांत्रिकी में सूत्रित किया जा सकता है, जिसमें विलगित निकाय से जुड़े ऊर्जा परिमाण से बहुत छोटा होता है, जहां विरामावस्था में निकाय कि विशिष्ट वस्तु का निर्देश तंत्र में मापा गया द्रव्यमान है, और प्रकाश की गति है।
द्रव यांत्रिकी और सातत्य यांत्रिकी के क्षेत्र में द्रव्यमान संरक्षण के नियम को सांतत्य समीकरण का उपयोग करके गणित में अवकल रूप में सूत्रित किया जा सकता है।
जहां घनत्व (द्रव्यमान प्रति इकाई आयतन), समय, विचलन, और प्रवाह वेग क्षेत्र है।
द्रव्यमान के लिए सांतत्य समीकरण की व्याख्या निम्नलिखित है। किसी समय अंतराल में निकाय में द्रव्यमान का परिवर्तन समान समय अंतराल में निकाय के पारगमित द्रव्यमान के बराबर होता है। यदि पदार्थ अंदर जाता है तो सकारात्मक और यदि पदार्थ बाहर जाता है तो नकारात्मक। संपूर्ण विलगित निकाय के लिए, इस स्थिति का तात्पर्य है कि कुल द्रव्यमान (निकाय में सभी घटकों के द्रव्यमान का योग) समय के साथ परिवर्तित नहीं होता है, अर्थात
जहां वह अवकलन है जो निकाय के संपूर्ण अयतन पर समकालन को परिभाषित करता है।
द्रव्यमान के लिए सांतत्य समीकरण द्रव गतिकी के यूलर समीकरणों का हिस्सा है। कई अन्य संवहन-प्रसार समीकरण निकाय में द्रव्यमान और पदार्थ के संरक्षण और प्रवाह का वर्णन करते हैं।
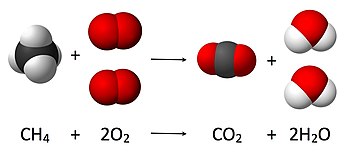
रसायन विज्ञान में, रासायनिक अभिक्रिया, या रससमीकरणमिति (स्टोइकोमेट्री) में अभिकारक और उत्पादों की मात्रा की गणना, द्रव्यमान के संरक्षण के सिद्धांत के आधार पर की जाती है। सिद्धांत का तात्पर्य है कि रासायनिक अभिक्रिया के दौरान अभिकारकों का कुल द्रव्यमान उत्पादों के कुल द्रव्यमान के बराबर होता है। उदाहरण के लिए, निम्नलिखित अभिक्रिया में
CH4 + 2O2 → CO2 + 2H2O
जहां मीथेन का एक अणु (CH4) और दो ऑक्सीजन के अणु (O2) कार्बन डाइऑक्साइड के एक अणु (CO2) और दो जल के अणुओं (H2O) में परिवर्तित हो जाते हैं। अभिक्रिया में शुरू में चार हाइड्रोजन परमाणु, चार ऑक्सीजन परमाणु और एक कार्बन परमाणु मौजूद हैं तथा अभिक्रिया पश्चात् उत्पाद के अणुओं की संख्या समान है यह संख्या द्रव्यमान के संरक्षण के सिद्धांत से प्राप्त की जा सकती है।
समय के साथ किसी दिए गए सिस्टम के बड़े पैमाने पर वितरण का पालन करके कई अभियान्त्रिकी समस्याओं का समाधान किया जाता है; इस पद्धति को द्रव्यमान संतुलन के रूप में जाना जाता है।
इतिहास


प्राचीन यूनानी दर्शन में एक महत्वपूर्ण विचार यह था कि " कुछ भी नहीं से कुछ नहीं आता है ", ताकि जो अभी मौजूद है वह हमेशा अस्तित्व में रहे: कोई भी नया पदार्थ अस्तित्व में नहीं आ सकता जहां पहले कोई नहीं था। इसका एक स्पष्ट बयान, आगे के सिद्धांत के साथ कि कुछ भी नहीं गुजर सकता है, एम्पेडोकल्स (सी।चौथी शताब्दी ईसा पूर्व): "क्योंकि जो कुछ नहीं है उससे कुछ भी आना असंभव है, और यह नहीं लाया या सुना जा सकता है कि जो पूरी तरह से नष्ट हो जाना चाहिए।"[4]
संरक्षण का एक और सिद्धांत तीसरी शताब्दी ईसा पूर्व के आसपास एपिकुरस द्वारा कहा गया था, जिन्होंने ब्रह्मांड की प्रकृति का वर्णन करते हुए लिखा था कि "चीजों की समग्रता हमेशा वैसी ही थी जैसी अब है, और हमेशा रहेगी"। [5]
रसायन विज्ञान में खोजें
18 वीं शताब्दी तक रासायनिक प्रतिक्रियाओं के दौरान द्रव्यमान के संरक्षण के सिद्धांत का व्यापक रूप से उपयोग किया गया था और प्रयोगों के दौरान एक महत्वपूर्ण धारणा थी, यहां तक कि एक परिभाषा औपचारिक रूप से स्थापित होने से पहले, [6] जैसा कि जोसेफ ब्लैक, हेनरी कैवेन्डिश और के कार्यों में देखा जा सकता है। जीन रे । [7] इस सिद्धांत को रेखांकित करने वाले पहले व्यक्ति 1756 में मिखाइल लोमोनोसोव थे। उन्होंने इसे प्रयोगों द्वारा प्रदर्शित किया हो सकता है और निश्चित रूप से 1748 में लियोनहार्ड यूलर के साथ पत्राचार में सिद्धांत पर चर्चा की थी, [8] हालांकि इस विषय पर उनके दावे को कभी-कभी चुनौती दी जाती है। [9] [10] सोवियत भौतिक विज्ञानी याकोव डोर्फ़मैन के अनुसार:
प्रयोगों की एक और अधिक परिष्कृत श्रृंखला बाद में एंटोनी लावोज़ियर द्वारा की गई जिन्होंने 1773 में अपना निष्कर्ष व्यक्त किया और द्रव्यमान के संरक्षण के सिद्धांत को लोकप्रिय बनाया। सिद्धांत के प्रदर्शनों ने तत्कालीन लोकप्रिय फ्लॉजिस्टन सिद्धांत को खारिज कर दिया, जिसमें कहा गया था कि दहन और गर्मी प्रक्रियाओं में द्रव्यमान प्राप्त या खो सकता है।
गैसों के भार पर पृथ्वी के वायुमंडल के उत्प्लावन प्रभाव के कारण सहस्राब्दियों तक द्रव्यमान का संरक्षण अस्पष्ट था। उदाहरण के लिए, लकड़ी का एक टुकड़ा जलने के बाद कम वजन का होता है; ऐसा लगता है कि इसका कुछ द्रव्यमान गायब हो जाता है, या बदल जाता है या खो जाता है। यह तब तक अस्वीकृत नहीं था जब तक कि सावधानीपूर्वक प्रयोग नहीं किए गए थे जिसमें जंग लगने जैसी रासायनिक प्रतिक्रियाओं को सीलबंद कांच के शीशियों में होने दिया गया था; यह पाया गया कि रासायनिक प्रतिक्रिया ने सीलबंद कंटेनर और उसकी सामग्री के वजन को नहीं बदला। 17वीं शताब्दी में वैक्यूम पंप के आविष्कार तक तराजू का उपयोग करके गैसों को तौलना संभव नहीं था।
एक बार समझ में आ गया, कीमिया से आधुनिक रसायन विज्ञान की प्रगति में द्रव्यमान के संरक्षण का बहुत महत्व था। एक बार जब प्रारंभिक रसायनज्ञों ने महसूस किया कि रासायनिक पदार्थ कभी गायब नहीं होते हैं, लेकिन केवल समान वजन वाले अन्य पदार्थों में परिवर्तित हो जाते हैं, तो ये वैज्ञानिक पहली बार पदार्थों के परिवर्तनों के मात्रात्मक अध्ययन शुरू कर सकते हैं। बड़े पैमाने पर संरक्षण का विचार और एक अनुमान है कि कुछ "तात्विक पदार्थ" भी रासायनिक प्रतिक्रियाओं द्वारा दूसरों में परिवर्तित नहीं किए जा सकते हैं, बदले में रासायनिक तत्वों की समझ के साथ-साथ यह विचार भी आया कि सभी रासायनिक प्रक्रियाएं और परिवर्तन (जैसे जलना और चयापचय प्रतिक्रियाएं) इन रासायनिक तत्वों की अपरिवर्तनीय मात्रा या भार के बीच की प्रतिक्रियाएं हैं।
लैवोज़ियर के अग्रणी कार्य के बाद, जीन स्टास के व्यापक प्रयोगों ने रासायनिक प्रतिक्रियाओं में इस कानून की स्थिरता का समर्थन किया, [11] भले ही वे अन्य इरादों के साथ किए गए थे। उनके शोध [12] [13] ने संकेत दिया कि कुछ प्रतिक्रियाओं में हानि या लाभ 1,00,000 में 2 से 4 भागों से अधिक नहीं हो सकता था। [14] एक ओर लवॉज़ियर द्वारा लक्षित और प्राप्त की गई सटीकता में अंतर, और दूसरी ओर मॉर्ले और स्टास द्वारा, बहुत बड़ा है। [15]
आधुनिक भौतिकी
विशेष सापेक्षता के आगमन के साथ द्रव्यमान के संरक्षण के नियम को चुनौती दी गई थी। 1905 में अल्बर्ट आइंस्टीन के एनस मिराबिलिस पेपर में से एक में, उन्होंने द्रव्यमान और ऊर्जा के बीच एक समानता का सुझाव दिया था। इस सिद्धांत में कई दावे निहित थे, जैसे कि यह विचार कि एक प्रणाली की आंतरिक ऊर्जा पूरे सिस्टम के द्रव्यमान में योगदान कर सकती है, या उस द्रव्यमान को विद्युत चुम्बकीय विकिरण में परिवर्तित किया जा सकता है। हालाँकि, जैसा कि मैक्स प्लैंक ने बताया, आइंस्टीन के सिद्धांत द्वारा भविष्यवाणी की गई रासायनिक ऊर्जा के निष्कर्षण या जोड़ के परिणामस्वरूप द्रव्यमान में परिवर्तन इतना छोटा है कि इसे उपलब्ध उपकरणों से नहीं मापा जा सकता है और इसे एक परीक्षण के रूप में प्रस्तुत नहीं किया जा सकता है। विशेष सापेक्षता का। आइंस्टीन ने अनुमान लगाया कि नई खोजी गई रेडियोधर्मिता से जुड़ी ऊर्जाएं उन्हें उत्पन्न करने वाले सिस्टम के द्रव्यमान की तुलना में काफी महत्वपूर्ण थीं, ताकि उनके द्रव्यमान के परिवर्तन को मापा जा सके, एक बार प्रतिक्रिया की ऊर्जा को सिस्टम से हटा दिया गया था। यह बाद में वास्तव में संभव साबित हुआ, हालांकि यह अंततः 1932 में पहली कृत्रिम परमाणु रूपांतरण प्रतिक्रिया थी, जिसे कॉकक्रॉफ्ट और वाल्टन द्वारा प्रदर्शित किया गया था, जो ऊर्जा लाभ के साथ बड़े पैमाने पर नुकसान के बारे में आइंस्टीन के सिद्धांत का पहला सफल परीक्षण साबित हुआ।
द्रव्यमान के संरक्षण के नियम और ऊर्जा के संरक्षण के समान नियम को अंततः एक अधिक सामान्य सिद्धांत द्वारा खारिज कर दिया गया जिसे द्रव्यमान-ऊर्जा तुल्यता के रूप में जाना जाता है। विशेष सापेक्षता भी द्रव्यमान और ऊर्जा की अवधारणा को फिर से परिभाषित करती है, जिसे एक दूसरे के स्थान पर इस्तेमाल किया जा सकता है और संदर्भ के फ्रेम के सापेक्ष परिभाषित किया जाता है। स्थिरता के लिए कई मात्राओं को परिभाषित किया जाना था, जैसे कि एक कण का शेष द्रव्यमान (कण के बाकी फ्रेम में द्रव्यमान) और सापेक्षतावादी द्रव्यमान (दूसरे फ्रेम में)। उत्तरार्द्ध शब्द आमतौर पर कम बार प्रयोग किया जाता है।
सामान्यीकरण
विशेष सापेक्षता
विशेष सापेक्षता में, यदि सिस्टम खुला है और ऊर्जा निकलती है तो द्रव्यमान का संरक्षण लागू नहीं होता है। हालाँकि, यह पूरी तरह से बंद (पृथक) सिस्टम पर लागू होता रहता है। यदि ऊर्जा एक प्रणाली से बच नहीं सकती है, तो इसका द्रव्यमान कम नहीं हो सकता है। सापेक्षता सिद्धांत में, जब तक किसी प्रणाली के भीतर किसी भी प्रकार की ऊर्जा को बरकरार रखा जाता है, यह ऊर्जा द्रव्यमान प्रदर्शित करती है।
इसके अलावा, द्रव्यमान को पदार्थ से अलग किया जाना चाहिए, क्योंकि अलग-अलग प्रणालियों में पदार्थ पूरी तरह से संरक्षित नहीं हो सकता है, भले ही ऐसी प्रणालियों में द्रव्यमान हमेशा संरक्षित होता है। हालांकि, रसायन विज्ञान में पदार्थ इतना लगभग संरक्षित है कि परमाणु युग तक पदार्थ संरक्षण के उल्लंघन को मापा नहीं गया था, और पदार्थ संरक्षण की धारणा रसायन विज्ञान और अन्य अध्ययनों में अधिकांश प्रणालियों में एक महत्वपूर्ण व्यावहारिक अवधारणा बनी हुई है जिसमें उच्च ऊर्जा शामिल नहीं है। रेडियोधर्मिता और परमाणु प्रतिक्रियाएं ।
ऊर्जा की रासायनिक मात्रा से जुड़ा द्रव्यमान मापने के लिए बहुत छोटा है
कुछ प्रकार की खुली प्रणालियों के द्रव्यमान में परिवर्तन जहां परमाणुओं या बड़े कणों को बाहर निकलने की अनुमति नहीं है, लेकिन अन्य प्रकार की ऊर्जा (जैसे प्रकाश या गर्मी) को प्रवेश करने, बचने या विलय करने की अनुमति है, 19 वीं शताब्दी के दौरान किसी का ध्यान नहीं गया। क्योंकि रासायनिक अभिक्रियाओं में ऊष्मीय या विकिरण ऊर्जा की छोटी मात्रा के जोड़ या हानि से जुड़े द्रव्यमान में परिवर्तन बहुत कम होता है। (सैद्धांतिक रूप से, अलग-अलग प्रणालियों में किए गए प्रयोगों के लिए द्रव्यमान बिल्कुल नहीं बदलेगा जहां गर्मी और काम की अनुमति या बाहर नहीं थी। )
ऊर्जा का ह्रास न होने पर जन संरक्षण सही रहता है
सापेक्षतावादी द्रव्यमान के संरक्षण का तात्पर्य एकल पर्यवेक्षक (या एकल जड़त्वीय फ्रेम से दृश्य) के दृष्टिकोण से है क्योंकि जड़त्वीय फ्रेम बदलने से सिस्टम के लिए कुल ऊर्जा (सापेक्ष ऊर्जा) में परिवर्तन हो सकता है, और यह मात्रा सापेक्षतावादी द्रव्यमान को निर्धारित करती है।
यह सिद्धांत कि कणों की एक प्रणाली का द्रव्यमान उनके बाकी द्रव्यमानों के योग के बराबर होना चाहिए, भले ही शास्त्रीय भौतिकी में सच हो, विशेष सापेक्षता में गलत हो सकता है। इसका कारण यह है कि बाकी द्रव्यमानों को आसानी से नहीं जोड़ा जा सकता है, यह ऊर्जा के अन्य रूपों, जैसे गतिज और संभावित ऊर्जा, और बड़े पैमाने पर कणों जैसे फोटॉन को ध्यान में नहीं रखता है, जो सभी के कुल द्रव्यमान को प्रभावित कर सकते हैं (या नहीं) सिस्टम
एक प्रणाली में बड़े पैमाने पर कणों को स्थानांतरित करने के लिए, विभिन्न कणों के बाकी द्रव्यमानों की जांच करना भी कई अलग-अलग जड़त्वीय अवलोकन फ़्रेमों को पेश करने के बराबर है (जो कि कुल सिस्टम ऊर्जा और गति को संरक्षित करने के लिए निषिद्ध है), और यह भी कि जब एक के बाकी फ्रेम में कण, यह प्रक्रिया अन्य कणों के गति को अनदेखा करती है, जो सिस्टम द्रव्यमान को प्रभावित करती है यदि अन्य कण इस फ्रेम में गति में हैं।
विशेष प्रकार के द्रव्यमान के लिए जिसे अपरिवर्तनीय द्रव्यमान कहा जाता है, पूरे बंद सिस्टम के लिए अवलोकन के जड़त्वीय फ्रेम को बदलने से सिस्टम के अपरिवर्तनीय द्रव्यमान के माप पर कोई प्रभाव नहीं पड़ता है, जो विभिन्न पर्यवेक्षकों के लिए भी संरक्षित और अपरिवर्तनीय (अपरिवर्तनीय) दोनों रहता है। पूरी प्रणाली। अपरिवर्तनीय द्रव्यमान ऊर्जा और संवेग का एक प्रणाली संयोजन है, जो किसी भी पर्यवेक्षक के लिए अपरिवर्तनीय है, क्योंकि किसी भी जड़त्वीय फ्रेम में, विभिन्न कणों की ऊर्जा और गति हमेशा एक ही मात्रा में जोड़ते हैं (संवेग नकारात्मक हो सकता है, इसलिए अतिरिक्त मात्रा एक घटाव)। गति फ्रेम के केंद्र में देखे जाने पर अपरिवर्तनीय द्रव्यमान प्रणाली का सापेक्ष द्रव्यमान होता है। यह न्यूनतम द्रव्यमान है जिसे एक प्रणाली प्रदर्शित कर सकती है, जैसा कि सभी संभावित जड़त्वीय फ्रेम से देखा जाता है।
दोनों सापेक्षतावादी और अपरिवर्तनीय द्रव्यमान का संरक्षण जोड़ी उत्पादन द्वारा बनाए गए कणों की प्रणालियों पर भी लागू होता है, जहां नए कणों के लिए ऊर्जा अन्य कणों की गतिज ऊर्जा से आ सकती है, या एक या एक से अधिक फोटॉन से एक प्रणाली के हिस्से के रूप में जिसमें अन्य कण शामिल हैं। फोटान फिर, जब नए कण बनते हैं तो न तो सापेक्षतावादी और न ही पूरी तरह से बंद (अर्थात पृथक) प्रणालियों का अपरिवर्तनीय द्रव्यमान बदलता है। हालांकि, विभिन्न जड़त्वीय पर्यवेक्षक इस संरक्षित द्रव्यमान के मूल्य पर असहमत होंगे, यदि यह सापेक्षतावादी द्रव्यमान है (यानी, सापेक्षतावादी द्रव्यमान संरक्षित है लेकिन अपरिवर्तनीय नहीं है)। हालांकि, सभी पर्यवेक्षक संरक्षित द्रव्यमान के मूल्य पर सहमत होते हैं यदि मापा जा रहा द्रव्यमान अपरिवर्तनीय द्रव्यमान है (यानी, अपरिवर्तनीय द्रव्यमान संरक्षित और अपरिवर्तनीय दोनों है)।
द्रव्यमान-ऊर्जा तुल्यता सूत्र गैर- पृथक प्रणालियों में एक अलग भविष्यवाणी देता है, क्योंकि यदि ऊर्जा को एक प्रणाली से बचने की अनुमति दी जाती है, तो सापेक्ष द्रव्यमान और अपरिवर्तनीय द्रव्यमान दोनों भी बच जाएंगे। इस मामले में, द्रव्यमान-ऊर्जा तुल्यता सूत्र भविष्यवाणी करता है कि किसी प्रणाली के द्रव्यमान में परिवर्तन ऊर्जा के जोड़े या घटाए जाने के कारण उसकी ऊर्जा में परिवर्तन से जुड़ा है: परिवर्तनों को शामिल करने वाला यह रूप वह रूप था जिसमें यह प्रसिद्ध समीकरण मूल रूप से आइंस्टीन द्वारा प्रस्तुत किया गया था। इस अर्थ में, किसी भी प्रणाली में बड़े पैमाने पर परिवर्तन की व्याख्या केवल तभी की जाती है जब सिस्टम से जोड़ी या हटाई गई ऊर्जा के द्रव्यमान को ध्यान में रखा जाता है।
सूत्र का तात्पर्य है कि बाध्य प्रणालियों में एक अपरिवर्तनीय द्रव्यमान (सिस्टम के लिए बाकी द्रव्यमान) उनके भागों के योग से कम होता है, यदि सिस्टम को बाध्य करने के बाद बाध्यकारी ऊर्जा को सिस्टम से बचने की अनुमति दी गई है। यह सिस्टम संभावित ऊर्जा को किसी अन्य प्रकार की सक्रिय ऊर्जा में परिवर्तित करके हो सकता है, जैसे गतिज ऊर्जा या फोटॉन, जो आसानी से एक बाध्य प्रणाली से बच जाते हैं। सिस्टम मास में अंतर, जिसे मास डिफेक्ट कहा जाता है, बाध्य सिस्टम में बाध्यकारी ऊर्जा का एक उपाय है - दूसरे शब्दों में, सिस्टम को अलग करने के लिए आवश्यक ऊर्जा। द्रव्यमान दोष जितना अधिक होगा, बंधन ऊर्जा उतनी ही अधिक होगी। बाध्यकारी ऊर्जा (जिसमें स्वयं द्रव्यमान होता है) को जारी किया जाना चाहिए (प्रकाश या गर्मी के रूप में) जब भागों को बाध्य प्रणाली बनाने के लिए गठबंधन किया जाता है, और यही कारण है कि जब ऊर्जा प्रणाली छोड़ती है तो बाध्य प्रणाली का द्रव्यमान कम हो जाता है। [16] कुल अपरिवर्तनीय द्रव्यमान वास्तव में संरक्षित होता है, जब बाध्यकारी ऊर्जा का द्रव्यमान जो बच गया है, को ध्यान में रखा जाता है।
सामान्य सापेक्षता
सामान्य सापेक्षता में, इस तरह के विस्तार की लाल पारी के कारण, अंतरिक्ष के विस्तार की मात्रा में फोटॉन का कुल अपरिवर्तनीय द्रव्यमान घट जाएगा। इसलिए द्रव्यमान और ऊर्जा दोनों का संरक्षण सिद्धांत में ऊर्जा में किए गए विभिन्न सुधारों पर निर्भर करता है, इस तरह की प्रणालियों की बदलती गुरुत्वाकर्षण संभावित ऊर्जा के कारण।
यह सभी देखें
संदर्भ
- ↑ Volkenstein, Mikhail V. (2009). Entropy and Information (illustrated ed.). Springer Science & Business Media. p. 20. ISBN 978-3-0346-0078-1. Extract of page 20
- ↑ Okuň, Lev Borisovič (2009). Energy and Mass in Relativity Theory. World Scientific. p. 253. ISBN 978-981-281-412-8. Extract of page 253
- ↑ Lewis, David (2012). Early Russian Organic Chemists and Their Legacy (illustrated ed.). Springer Science & Business Media. p. 29. ISBN 978-3-642-28219-5. Extract of page 29
- ↑ Fr. 12; see pp.291–2 of Kirk, G. S.; J. E. Raven; Malcolm Schofield (1983). The Presocratic Philosophers (2 ed.). Cambridge: Cambridge University Press. ISBN 978-0-521-27455-5.
- ↑ Long, A. A.; D. N. Sedley (1987). "Epicureanism: The principals of conservation". The Hellenistic Philosophers. Vol 1: Translations of the principal sources with philosophical commentary. Cambridge: Cambridge University Press. pp. 25–26. ISBN 978-0-521-27556-9.
- ↑ Whitaker, Robert D. (1975-10-01). "An historical note on the conservation of mass". Journal of Chemical Education. 52 (10): 658. Bibcode:1975JChEd..52..658W. doi:10.1021/ed052p658. ISSN 0021-9584.
- ↑ Robert D. Whitaker, "An Historical Note on the Conservation of Mass", Journal of Chemical Education, 52, 10, 658-659, Oct 75
- ↑ Pismen, Len (2018). The Swings of Science: From Complexity to Simplicity and Back. Springer. p. 41. ISBN 978-3-319-99777-3.
- ↑ Pomper, Philip (October 1962). "Lomonosov and the Discovery of the Law of the Conservation of Matter in Chemical Transformations". Ambix. 10 (3): 119–127. doi:10.1179/amb.1962.10.3.119.
- ↑ Lomonosov, Mikhail Vasil’evich (1970). Mikhail Vasil'evich Lomonosov on the Corpuscular Theory. Henry M. Leicester (trans.). Cambridge, Mass.: Harvard University Press. Introduction, p. 25.
- ↑ Matthew Moncrieff Pattison Muir, The Elements of Chemistry (1904)
- ↑ Nouv. Recherches sur les lois des proportions chimiques (1865) 152, 171, 189
- ↑ "Conservation of Mass in Chemical Changes"Journal - Chemical Society, London, Vol.64, Part 2 Chemical Society (Great Britain)
- ↑ William Edwards Henderson, A Course in General Chemistry (1921)
- ↑ Ida Freund, The study of Chemical Composition: an account of its method and historical development, with illustrative quotations (1904)
- ↑ Kenneth R. Lang, Astrophysical Formulae, Springer (1999), ISBN 3-540-29692-1