मैंगनीज (III) ऑक्साइड
| |
| Names | |
|---|---|
| Other names
डायमैंगनीज ट्राइऑक्साइड, मैंगनीज सेक्विऑक्साइड, मैंगनीज ऑक्साइड, मैंगनीज ऑक्साइड
| |
| Identifiers | |
3D model (JSmol)
|
|
| ChemSpider | |
PubChem CID
|
|
| RTECS number |
|
| UNII | |
| |
| |
| Properties | |
| Mn2O3 | |
| Molar mass | 157.8743 g/mol |
| Appearance | brown or black crystalline |
| Density | 4.50 g/cm3 |
| Melting point | 888 °C (1,630 °F; 1,161 K) (alpha form) 940 °C, decomposes (beta form) |
| 0.00504 g/100 mL (alpha form) 0.01065 g/100 mL (beta form) | |
| Solubility | insoluble in ethanol, acetone soluble in acid, ammonium chloride |
| +14,100·10−6 cm3/mol | |
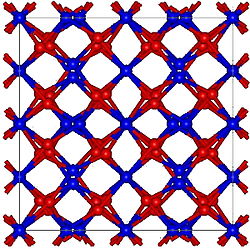
| Structure[1] | |
| Bixbyite, cI80 | |
| Ia3 (No. 206) | |
a = 942 pm
| |
| Thermochemistry | |
Std molar
entropy (S⦵298) |
110 J·mol−1·K−1[2] |
Std enthalpy of
formation (ΔfH⦵298) |
−971 kJ·mol−1[2] |
| Hazards | |
| NFPA 704 (fire diamond) | |
| Related compounds | |
Other anions
|
मैंगनीज ट्राइफ्लोराइड, मैंगनीज (III) एसीटेट |
Other cations
|
क्रोमियम (III) ऑक्साइड, आयरन (III) ऑक्साइड |
Related compounds
|
मैंगनीज(II) ऑक्साइड, मैंगनीज डाइऑक्साइड |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
मैंगनीज (III) ऑक्साइड सूत्र Mn2O3 वाला एक रासायनिक यौगिक है। यह प्रकृति में खनिज बिक्सबाइट के रूप में होता है (हाल ही में बिक्सबाइट (Mn) में बदला गया है)[3][4] और फेराइट्स और थर्मिस्टर्स के उत्पादन में उपयोग किया जाता है।
उपक्रम और रसायन
MnO2 को हवा में 800°C से कम गर्म करने पर α-Mn2O3 उत्पन्न होता है (उच्च तापमान Mn3O4 उत्पन्न करता है)।[5] γ-Mn2O3 मैंगनीज (II) हाइड्रॉक्साइड के निर्जलीकरण के बाद ऑक्सीकरण द्वारा उत्पादित किया जाता है।[5] नैनो-क्रिस्टलीय Mn2O3 की उपक्रम की सूचना दी गई है, उदाहरण के लिए MnII लवणों के ऑक्सीकरण या MnO2 की कमी वाले संश्लेषण सम्मिलित होते है।[6][7][8]
मैंगनीज (III) ऑक्साइड एक क्षारीय सेल में रेडॉक्स प्रतिक्रिया से बनता है:
- 2 MnO2 + Zn → Mn2O3 + ZnO
मैंगनीज (III) ऑक्साइड Mn2O3 को MnOOH मैंगनीज (III) ऑक्सीहाइड्रॉक्साइड के साथ भ्रमित नहीं होना चाहिए। Mn2O3 के विपरीत, MnOOH एक यौगिक है जो लगभग 300 °C पर विघटित होकर MnO2 बनाता है।[9]
संरचना
Mn2O3 कई अन्य संक्रमण धातु आक्साइड के विपरीत होता है जिसमें यह कोरन्डम (Al2O3) संरचना को नहीं अपनाता है।[5] सामान्यतः दो रूपों को पहचाना जाता है, α-Mn2O3 और γ-Mn2O3,[10] चूंकि CaIrO3 संरचना के साथ एक उच्च दबाव रूप भी बताया गया है।[11]
α-Mn2O3 में क्यूबिक बिक्सबाइट संरचना होती है, जो C-टाइप रेयर अर्थ सेक्वियोऑक्साइड (पियर्सन प्रतीक cI80, स्पेस ग्रुप Ia3, #206) का एक उदाहरण है। बिक्सबाइट संरचना को Fe3+ की थोड़ी मात्रा की उपस्थिति से स्थिर पाया जाता है, शुद्ध Mn2O3 में एक ऑर्थोरोम्बिक संरचना होती है (पियर्सन प्रतीक oP24, अंतरिक्ष समूह Pbca, #61)।[12] α-Mn2O3 80 K पर प्रतिलौह चुंबकीय संक्रमण से गुजरता है।[13]
γ-Mn2O3 में Mn3O4 की स्पिनल से संबंधित एक संरचना है जहां ऑक्साइड आयन क्यूबिक क्लोज पैक होता है। यह γ-Fe2O3 और Fe3O4 के बीच संबंध के समान होता है।[10]γ-Mn2O3 39 K के नील तापमान के साथ फेरी चुम्बकत्व होता है।[14]
ε-Mn2O3 एक समकोणिक इल्मेनाइट संरचना होती है, जिसमें मैंगनीज के धनायन ऑक्सीकरण 2+ और 4+ में समान रूप से विभाजित होता है। ε-Mn2O3 210 K के नील तापमान के साथ प्रतिलौहचुंबकीय होता है।[15]
संदर्भ
- ↑ Chandiran, Kalaiselvi; Murugesan, Ramesh Aravind; Balaji, Revathi; Andrews, Nirmala Grace; Pitchaimuthu, Sudhagar; Nagamuthu Raja, Krishna Chandar (2020-07-03). "Long single crystalline α-Mn2O3 nanorods: facile synthesis and photocatalytic application". Materials Research Express. IOP Publishing. 7 (7): 074001. doi:10.1088/2053-1591/ab9fbd. ISSN 2053-1591. S2CID 225561660.
- ↑ 2.0 2.1 Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. p. A22. ISBN 978-0-618-94690-7.
- ↑ "Bixbyite-(Mn)".
- ↑ IMA 21-H: Redefinition of bixbyite and definition of bixbyite-(Fe) and bixbyite-(Mn). CNMNC Newsletter, 64, 2021; Mineralogical Magazine, 85, 2021).
- ↑ 5.0 5.1 5.2 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. p. 1049. ISBN 978-0-08-037941-8.
- ↑ Shuijin Lei; Kaibin Tang; Zhen Fang; Qiangchun Liu; Huagui Zheng (2006). "Preparation of α-Mn2O3 and MnO from thermal decomposition of MnCO3 and control of morphology". Materials Letters. 60: 53. doi:10.1016/j.matlet.2005.07.070.
- ↑ Zhong-Yong Yuan; Tie-Zhen Ren; Gaohui Du; Bao-Lian Su (2004). "A facile preparation of single-crystalline α-Mn2O3 nanorods by ammonia-hydrothermal treatment of MnO2". Chemical Physics Letters. 389 (1–3): 83. doi:10.1016/j.cplett.2004.03.064.
- ↑ Navin Chandra; Sanjeev Bhasin; Meenakshi Sharma; Deepti Pal (2007). "A room temperature process for making Mn2O3 nano-particles and γ-MnOOH nano-rods". Materials Letters. 61 (17): 3728. doi:10.1016/j.matlet.2006.12.024.
- ↑ Thomas Kohler; Thomas Armbruster; Eugen Libowitzky (1997). "Hydrogen Bonding and Jahn-Teller Distortion in Groutite,α-MnOOH, and Manganite,γ-MnOOH, and Their Relations to the Manganese Dioxides Ramsdellite and Pyrolusite". Journal of Solid State Chemistry. 133 (2): 486–500. doi:10.1006/jssc.1997.7516.
- ↑ 10.0 10.1 Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ↑ High Pressure Phase transition in Mn2O3 to the CaIrO3-type Phase Santillan, J.; Shim, S. American Geophysical Union, Fall Meeting 2005, abstract #MR23B-0050
- ↑ Geller S. (1971). "Structure of α-Mn2O3, (Mn0.983Fe0.017)2O3 and (Mn0.37Fe0.63)2O3 and relation to magnetic ordering". Acta Crystallogr B. 27 (4): 821. doi:10.1107/S0567740871002966.
- ↑ Geller S. (1970). "Magnetic and Crystallographic Transitions in Sc+, Cr+, and Ga+ Substituted Mn2O3". Physical Review B. 1 (9): 3763. doi:10.1103/physrevb.1.3763.
- ↑ Kim S. H; Choi B. J; Lee G.H.; Oh S. J.; Kim B.; Choi H. C.; Park J; Chang Y. (2005). "Ferrimagnetism in γ-Manganese Sesquioxide (γ−Mn2O3) Nanoparticles". Journal of the Korean Physical Society. 46 (4): 941.
- ↑ Ovsyannikov, Sergey V.; Tsirlin, Alexander A.; Korobeynikov, Igor V.; Morozova, Natalia V.; Aslandukova, Alena A.; Steinle-Neumann, Gerd; Chariton, Stella; Khandarkhaeva, Saiana; Glazyrin, Konstantin; Wilhelm, Fabrice; Rogalev, Andrei; Dubrovinsky, Leonid (2021-09-06). "Synthesis of Ilmenite-type ε-Mn 2 O 3 and Its Properties". Inorganic Chemistry (in English). 60 (17): 13348–13358. doi:10.1021/acs.inorgchem.1c01666. ISSN 0020-1669. PMID 34415155. S2CID 237242460.
