आंशिक मोलर गुण
ऊष्मप्रवैगिकी में, एक आंशिक मोलर गुण एक मात्रा है जो निरंतर तापमान और दबाव पर मिश्रण की मोलर संरचना में परिवर्तन के साथ एक विलयन या मिश्रण की व्यापक गुणों की भिन्नता का वर्णन करती है। यह ब्याज के घटक की राशि (मोल्स की संख्या) के संबंध में विस्तृत संपत्ति का आंशिक व्युत्पन्न है। किसी मिश्रण के प्रत्येक विस्तृत गुण का संगत आंशिक मोलर गुण होता है।
परिभाषा
आंशिक मोलर आयतन को मोटे तौर पर उस योगदान के रूप में समझा जाता है जो मिश्रण का एक घटक विलयन के समग्र आयतन में बनाता है। यद्यपि, इसके अलावा भी बहुत कुछ है:
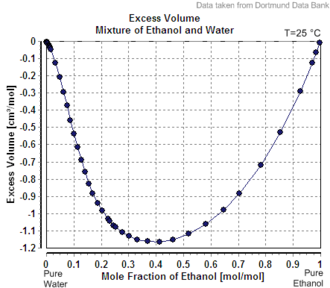
जब 25 °C पर जल की एक बड़ी मात्रा में एक मोल जल मिलाया जाता है, तो आयतन 18 सेमी3 बढ़ जाता है। इस प्रकार शुद्ध जल का मोलर आयतन 18 cm3 mol-1 बताया जाएगा। यद्यपि, शुद्ध इथेनॉल की एक बड़ी मात्रा में एक मोल जल मिलाने से केवल 14 सेमी3 की मात्रा में वृद्धि होती है। वृद्धि के भिन्न होने का कारण यह है कि जल के अणुओं की एक निश्चित संख्या द्वारा घेरा गया आयतन आसपास के अणुओं की पहचान पर निर्भर करता है। मान14 सेमी3 को इथेनॉल में जल का आंशिक मोलर आयतन कहा जाता है।
सामान्य तौर पर, किसी मिश्रण में पदार्थ X का आंशिक मोलर आयतन, मिश्रण में जोड़े गए X के प्रति मोल आयतन में परिवर्तन होता है।
मिश्रण के घटकों के आंशिक मोलर की मात्रा मिश्रण की संरचना के साथ भिन्न होती है, क्योंकि मिश्रण में अणुओं का वातावरण संरचना के साथ बदलता है। यह बदलता हुआ आणविक वातावरण है (और अणुओं के बीच परस्पर क्रियाओं का परिणामी परिवर्तन) जिसके परिणामस्वरूप मिश्रण के ऊष्मप्रवैगिकी गुणों में परिवर्तन होता है क्योंकि इसकी संरचना बदल जाती है।
अगर, द्वारा , एक मिश्रण की एक सामान्य व्यापक संपत्ति को दर्शाता है, यह हमेशा सच होगा कि यह दबाव पर निर्भर करता है (), तापमान (), और मिश्रण के प्रत्येक घटक की मात्रा (मोल में मापा गया, N) में मापा जाता है। क्यू घटकों वाले मिश्रण के लिए, इसे इस रूप में व्यक्त किया जाता है
अब यदि तापमान T और दबाव P को स्थिर रखा जाए, डिग्री 1 का एक सजातीय कार्य है, क्योंकि मिश्रण में प्रत्येक घटक की मात्रा को दोगुना करने से दोगुनी हो जाएगी . अधिक सामान्यतः, किसी के लिए :
सजातीय फलन के लिए यूलर की प्रारंभिक प्रमेय, इसका तात्पर्य है[1]
जहाँ आंशिक मोलर है घटक का के रूप में परिभाषित:
सजातीय फलन के लिए यूलर की दूसरी प्रमेय, डिग्री 0 का एक सजातीय कार्य है ((अर्थात, एक गहन संपत्ति है) जिसका अर्थ है कि किसी के लिए :
विशेष रूप से, लेना जहाँ , किसी के पास
जहाँ घटक के मोल अंश के रूप में व्यक्त की जाने वाली सांद्रता है .चूंकि मोलर अंश संबंध को संतुष्ट करते हैं
xiस्वतंत्र नहीं हैं, और आंशिक मोलर गुण केवल का एक फलन है मोल अंश: