18-इलेक्ट्रॉन नियम
18-इलेक्ट्रॉन नियम अंगूठे का एक रसायन शास्त्र नियम है जो मुख्य रूप से स्थिर संक्रमण धातु परिसरों, विशेष रूप से ऑर्गोमेटेलिक यौगिक ों के लिए सूत्रों की भविष्यवाणी और तर्कसंगत बनाने के लिए उपयोग किया जाता है।[1] नियम इस तथ्य पर आधारित है कि संक्रमण धातुओं के इलेक्ट्रॉन विन्यास में संयोजकता कक्षीय में पांच (एन -1) डी ऑर्बिटल्स, एक एनएस ऑर्बिटल और तीन एनपी ऑर्बिटल्स होते हैं, जहां एन मुख्य क्वांटम संख्या होता है। ये ऑर्बिटल्स सामूहिक रूप से 18 इलेक्ट्रॉनों को या तो बॉन्डिंग या नॉनबॉन्डिंग इलेक्ट्रॉन जोड़े के रूप में समायोजित कर सकते हैं। इसका मतलब यह है कि इन नौ परमाणु ऑर्बिटल्स के लिगैंड ऑर्बिटल्स के संयोजन से नौ परमाणु कक्षक बनते हैं जो या तो मेटल-लिगैंड बॉन्डिंग या नॉन-बॉन्डिंग होते हैं। जब एक धातु परिसर में 18 संयोजी इलेक्ट्रॉन होते हैं, तो कहा जाता है कि इस अवधि में महान गैस के समान इलेक्ट्रॉन विन्यास प्राप्त हुआ है। नियम धातुओं के परिसरों के लिए सहायक नहीं है जो संक्रमण धातु नहीं हैं, और दिलचस्प या उपयोगी संक्रमण धातु परिसर नियम का उल्लंघन करेंगे क्योंकि नियम से विचलित होने वाले परिणाम प्रतिक्रियाशीलता पर पड़ते हैं। यह नियम पहली बार 1921 में अमेरिकी रसायनज्ञ इरविंग लैंगमुइर द्वारा प्रस्तावित किया गया था।[1][2]
प्रयोज्यता
नियम उपयोगी रूप से स्पिन राज्यों (डी इलेक्ट्रॉनों) के लिए सूत्रों की भविष्यवाणी करता है | सीआर, एमएन, फे, और सह ट्रायड्स के कम-स्पिन परिसरों। प्रसिद्ध उदाहरणों में फेरोसीन , आयरन पेंटाकार्बोनिल , क्रोमियम कार्बोनिल और निकल कार्बोनिल शामिल हैं। एक परिसर में लिगैंड्स 18-इलेक्ट्रॉन नियम की प्रयोज्यता निर्धारित करते हैं। सामान्य तौर पर, नियम का पालन करने वाले कॉम्प्लेक्स कम से कम आंशिक रूप से पाई बैकबॉन्डिंग | π-स्वीकर्ता लिगैंड (जिसे π-एसिड के रूप में भी जाना जाता है) से बना होता है। इस तरह के लिगैंड में एक बहुत मजबूत लिगैंड क्षेत्र होता है, जो परिणामी आणविक ऑर्बिटल्स की ऊर्जा को कम करता है ताकि वे अनुकूल रूप से कब्जा कर सकें। विशिष्ट लिगेंड में ओलेफिन , फॉस्फीन लिगैंड और कार्बोनिल शामिल हैं। -एसिड के परिसरों में आमतौर पर कम-ऑक्सीकरण अवस्था में धातु होती है। ऑक्सीकरण अवस्था और लिगेंड की प्रकृति के बीच संबंध को बैकबॉन्डिंग के ढांचे के भीतर युक्तिसंगत बनाया गया है।
प्रतिक्रियाशीलता के परिणाम
18-इलेक्ट्रॉन नियम का पालन करने वाले यौगिक आमतौर पर निष्क्रिय होते हैं। उदाहरणों में शामिल हैं Hexamminecobalt(III) क्लोराइड|[Co(NH .)3)6]क्ली3, मोलिब्डेनम कार्बोनिल | मो (सीओ)6, और फेरोसाइनाइड|[Fe(CN)6]4−. ऐसे मामलों में, सामान्य रूप से लिगैंड एक्सचेंज विघटनकारी प्रतिस्थापन तंत्र के माध्यम से होता है, जिसमें प्रतिक्रिया की दर एक लिगैंड के पृथक्करण की दर से निर्धारित होती है। दूसरी ओर, 18-इलेक्ट्रॉन यौगिक प्रोटॉन जैसे इलेक्ट्रोफाइल के प्रति अत्यधिक प्रतिक्रियाशील हो सकते हैं, और ऐसी प्रतिक्रियाएं तंत्र में सहयोगी होती हैं, एसिड-बेस प्रतिक्रियाएं होती हैं।
18 से कम वैलेंस इलेक्ट्रॉनों वाले कॉम्प्लेक्स बढ़ी हुई प्रतिक्रियाशीलता दिखाते हैं। इस प्रकार, 18-इलेक्ट्रॉन नियम अक्सर एक स्टोइकोमेट्रिक या कटैलिसीस अर्थ में गैर-प्रतिक्रिया के लिए एक नुस्खा है।
डुओडेक्टेट नियम
कम्प्यूटेशनल निष्कर्ष बताते हैं कि धातु पर वैलेंस पी-ऑर्बिटल्स मेटल-लिगैंड बॉन्डिंग में भाग लेते हैं, हालांकि कमजोर रूप से।[3] हालांकि, वेनहोल्ड और लैंडिस प्राकृतिक बॉन्ड ऑर्बिटल्स के संदर्भ में मेटल-लिगैंड बॉन्डिंग में मेटल पी-ऑर्बिटल्स की गणना नहीं करते हैं,[4] हालांकि ये ऑर्बिटल्स अभी भी बेसिस सेट (रसायन विज्ञान) के रूप में शामिल हैं। इसके परिणामस्वरूप पांच डी-ऑर्बिटल्स और केवल एक एस-ऑर्बिटल के लिए डुओडेक्टेट (12-इलेक्ट्रॉन) नियम होता है।
सामान्य रसायन विज्ञान समुदाय में वर्तमान सर्वसम्मति यह है कि मुख्य समूह तत्वों के लिए एकवचन ऑक्टेट नियम के विपरीत, संक्रमण धातुएं 12-इलेक्ट्रॉन या 18-इलेक्ट्रॉन नियम का सख्ती से पालन नहीं करती हैं, लेकिन यह नियम निचले बाउंड और ऊपरी बाउंड वैलेंस का वर्णन करते हैं। क्रमशः इलेक्ट्रॉन गणना।[5][6] इस प्रकार, जबकि संक्रमण धातु डी-ऑर्बिटल और एस-ऑर्बिटल बॉन्डिंग आसानी से होती है, बॉन्डिंग में उच्च ऊर्जा और अधिक स्थानिक रूप से फैलाने वाले पी-ऑर्बिटल्स की भागीदारी केंद्रीय परमाणु और समन्वय वातावरण पर निर्भर करती है।[7][8]
अपवाद
-दाता या -दाता लिगैंड धातु के कक्षकों के साथ छोटी बातचीत के साथ एक कमजोर लिगैंड क्षेत्र सिद्धांत की ओर ले जाते हैं जो टी की ऊर्जा को बढ़ाता है2g कक्षक ये आणविक ऑर्बिटल्स गैर-बंधन कक्षीय बन जाते हैं | नॉन-बॉन्डिंग या कमजोर एंटी-बॉन्डिंग ऑर्बिटल्स (छोटे Δ)oct) इसलिए, इलेक्ट्रॉन को जोड़ने या हटाने से जटिल स्थिरता पर बहुत कम प्रभाव पड़ता है। इस मामले में, डी-इलेक्ट्रॉनों की संख्या पर कोई प्रतिबंध नहीं है और 12-22 इलेक्ट्रॉनों वाले कॉम्प्लेक्स संभव हैं। छोटाoct ई . भरना बनाता हैg* संभव (>18 ई−) और π-दाता लिगेंड्स t . बना सकते हैं2g प्रतिरक्षी (<18 ई-)। इस प्रकार के लिगैंड स्पेक्ट्रोकेमिकल श्रृंखला श्रृंखला के निम्न-से-मध्यम भाग में स्थित होते हैं। उदाहरण के लिए: [TiF6]2− (Ti(IV), d0, 12 ई-), [सह (छोटा)3)6]3+ (सह(III), डी6, 18 और-), [Cu(OH .)2)6]2+ (Cu(II), d9, 21 और-)।
धातु आयनों के संदर्भ में,oct समूह में नीचे की ओर बढ़ने के साथ-साथ ऑक्सीकरण संख्या में भी वृद्धि होती है। मजबूत लिगैंड क्षेत्र स्पिन राज्यों (डी इलेक्ट्रॉनों) की ओर ले जाते हैं | कम-स्पिन कॉम्प्लेक्स जो 18-इलेक्ट्रॉन नियम के कुछ अपवादों का कारण बनते हैं।
16-इलेक्ट्रॉन कॉम्प्लेक्स
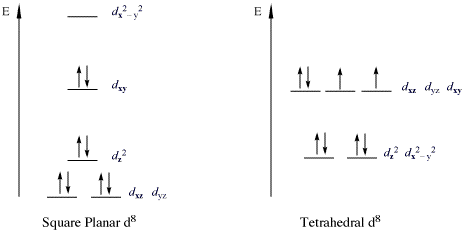
18e नियम का उल्लंघन करने वाले परिसरों का एक महत्वपूर्ण वर्ग धातु d . के साथ 16-इलेक्ट्रॉन परिसर हैं8 कॉन्फ़िगरेशन। सभी स्पिन राज्य (डी इलेक्ट्रॉन) | हाई-स्पिन डी8 धातु आयन ऑक्टाहेड्रल आणविक ज्यामिति (या टेट्राहेड्रल आणविक ज्यामिति ) हैं, लेकिन स्पिन राज्यों (d इलेक्ट्रॉनों)|लो-स्पिन d8 धातु आयन सभी वर्गाकार समतलीय होते हैं। स्क्वायर-प्लानर लो-स्पिन डी के महत्वपूर्ण उदाहरण8 धातु आयन Rh(I), Ir(I), Ni(II), Pd(II), और Pt(II) हैं। नीचे दिए गए चित्र में निम्न-स्पिन वर्ग-प्लानर परिसरों में d उपकोश का विभाजन दिखाया गया है। उदाहरण विशेष रूप से कोबाल्ट और निकल ट्रायड्स के डेरिवेटिव के लिए प्रचलित हैं। इस तरह के यौगिक आमतौर पर वर्ग समतलीय होते हैं। सबसे प्रसिद्ध उदाहरण वास्का का परिसर है (IrCl(CO)(PPh .)3)2), [पीटीसीएल4]2−, और Zeise's Salt [PtCl3(द2-सी2H4)]-. ऐसे परिसरों में, डीz2 कक्षीय दोगुना व्यस्त और गैर-बंधन है।
 कई उत्प्रेरक चक्र परिसरों के माध्यम से संचालित होते हैं जो 18-इलेक्ट्रॉन और स्क्वायर-प्लानर 16-इलेक्ट्रॉन कॉन्फ़िगरेशन के बीच वैकल्पिक होते हैं। उदाहरणों में मोनसेंटो एसिटिक एसिड संश्लेषण , हाइड्रोजनीकरण , हाइड्रोफॉर्माइलेशन , ओलेफिन आइसोमेरिज़ेशन और कुछ एल्केन पोलीमराइज़ेशन शामिल हैं।
कई उत्प्रेरक चक्र परिसरों के माध्यम से संचालित होते हैं जो 18-इलेक्ट्रॉन और स्क्वायर-प्लानर 16-इलेक्ट्रॉन कॉन्फ़िगरेशन के बीच वैकल्पिक होते हैं। उदाहरणों में मोनसेंटो एसिटिक एसिड संश्लेषण , हाइड्रोजनीकरण , हाइड्रोफॉर्माइलेशन , ओलेफिन आइसोमेरिज़ेशन और कुछ एल्केन पोलीमराइज़ेशन शामिल हैं।
अन्य उल्लंघनों को धातु केंद्र पर लिगेंड के प्रकार के अनुसार वर्गीकृत किया जा सकता है।
भारी लिगेंड
भारी लिगैंड्स लिगैंड्स के पूर्ण पूरक के दृष्टिकोण को रोक सकते हैं जो धातु को 18 इलेक्ट्रॉन कॉन्फ़िगरेशन प्राप्त करने की अनुमति देगा। उदाहरण:
- तिवारी (नियोपेंटाइल )4 (8 और-)
- पेंटामेथिलसाइक्लोपेंटाडीन |सीपी*2आप (सी2H4) (16 और-)
- वैनेडियम हेक्साकार्बोनिल|वी(सीओ)6(17 और-)
- सीपी*सीआर(सीओ)3 (17 और-)
- पं.(पर्ट-ब्यूटाइल|टीबु3)2 (14 और-)
- सह (नॉरबोर्निल )4 (13 और-)
- [FeCp2]+ (17 और-)
कभी-कभी ऐसे कॉम्प्लेक्स भारी लिगैंड के हाइड्रोकार्बन ढांचे के साथ एगोस्टिक इंटरैक्शन में संलग्न होते हैं। उदाहरण के लिए:
- डब्ल्यू (सीओ)3[पी (सी6H11)3]2 16 ई . है− लेकिन एक C–H बांड और W केंद्र के बीच एक छोटा संबंध है।
- साइक्लोपेंटैडीन (पीएमई .)3)वी(CHCMe3) (14 और−, प्रतिचुंबकीय) में 'alkylidene-H' के साथ एक छोटा V–H आबंध होता है, इसलिए यौगिक का विवरण Cp(PMe) के बीच कहीं होता है।3)वी(CHCMe3) और सीपी (पीएमई .)3) वी (एच) (सीसीएमई .)3).
हाई-स्पिन कॉम्प्लेक्स
हाई-स्पिन धातु परिसरों ने अकेले ही कक्षा में कब्जा कर लिया है और इसमें कोई खाली कक्षा नहीं हो सकती है जिसमें लिगैंड इलेक्ट्रॉन घनत्व दान कर सकते हैं। सामान्य तौर पर, कॉम्प्लेक्स में कुछ या कोई -अम्लीय लिगैंड नहीं होते हैं। ये अकेले कब्जे वाले ऑर्बिटल्स रेडिकल लिगैंड्स (जैसे, ऑक्सीजन ) के अकेले कब्जे वाले ऑर्बिटल्स के साथ संयोजन कर सकते हैं, या लिगैंड फील्ड थ्योरी लिगैंड के अलावा इलेक्ट्रॉन-पेयरिंग का कारण बन सकता है, इस प्रकार एक खाली ऑर्बिटल बना सकता है जिसमें यह दान कर सकता है। उदाहरण:
- सीआरसीएल3(टेट्राहाइड्रोफुरान )3 (15 ई-)
- [एमएन(एच2ओ)6]2+ (17 और-)
- [के साथ (एच2ओ)6]2+ (21 ई .)-, नीचे टिप्पणियाँ देखें)
दृढ़ता से -दान करने वाले लिगैंड वाले परिसर अक्सर 18-इलेक्ट्रॉन नियम का उल्लंघन करते हैं। इन लिगैंड्स में फ्लोराइड (F .) शामिल हैं−), संक्रमण धातु ऑक्सो कॉम्प्लेक्स (O .)2−), संक्रमण धातु नाइट्रिडो कॉम्प्लेक्स (N .)3−), एल्कोक्साइड ्स (RO .)−), और संक्रमण धातु इमिडो कॉम्प्लेक्स (RN .)2−)। उदाहरण:
- [CrO4]2− (16 और-)
- मो (= एनआर)2क्लोरीन2 (12 और-)
बाद के मामले में, मो को नाइट्रोजन अकेला जोड़े का पर्याप्त दान है (इसलिए यौगिक को 16 ई के रूप में भी वर्णित किया जा सकता है)- यौगिक)। इसे Mo-N बॉन्ड की छोटी लंबाई और Mo-N-C(R) कोण से देखा जा सकता है, जो लगभग 180° है। प्रति-उदाहरण:
- ट्रांस-WO2(मैं2पीसीएच2चौधरी2एसएमई2)2 (18 और-)
- सीपी*रेओ3 (18 और-)
इन मामलों में, एम = ओ बांड शुद्ध दोहरे बंधन हैं (यानी, धातु को ऑक्सीजन के अकेले जोड़े का कोई दान नहीं), जैसा कि अपेक्षाकृत लंबी बंधन दूरी में परिलक्षित होता है।
π-दान करने वाले लिगेंड्स
लिगैंड्स जहां समन्वयक परमाणु गैर-बंधन वाले अकेले जोड़े को सहन करते हैं, अक्सर असंतृप्त परिसरों को स्थिर करते हैं। धातु एमाइड और एल्कोक्साइड अक्सर 18e नियम का उल्लंघन करते हैं
प्रभावों का संयोजन
उपरोक्त कारक कभी-कभी गठबंधन कर सकते हैं। उदाहरणों में शामिल
- सीपी*वीओसीएल2 (14 और-)
- टाइटेनियम (IV) क्लोराइड | TiCl4(8 और-)
उच्च इलेक्ट्रॉन मायने रखता है
कुछ संकुलों में 18 से अधिक इलेक्ट्रॉन होते हैं। उदाहरण:
- कोबाल्टोसिन (19 ई .)-)
- निकेलोसीन (20 ई-)
- Hexaaquacopper(II) आयन [Cu(H .)2ओ)6]2+ (21 ई .)- </सुप>)
- टीएम (सीओ)8- (TM = Sc, Y, La) (20 e-)
अक्सर, ऐसे मामले जहां कॉम्प्लेक्स में 18 से अधिक वैलेंस इलेक्ट्रॉनों को इलेक्ट्रोस्टैटिक बलों के लिए जिम्मेदार ठहराया जाता है - धातु अपने सकारात्मक चार्ज को संतुलित करने की कोशिश करने के लिए लिगैंड्स को अपनी ओर आकर्षित करती है, और इसके साथ समाप्त होने वाले इलेक्ट्रॉनों की संख्या महत्वहीन है। मेटालोसीन के मामले में, साइक्लोपेंटैडिएनिल लिगैंड की केलेशन प्रकृति धातु के साथ अपने बंधन को स्थिर करती है। निम्नलिखित दो अवलोकन कुछ हद तक संतोषजनक हैं: कोबाल्टोसिन एक मजबूत इलेक्ट्रॉन दाता है, जो आसानी से 18-इलेक्ट्रॉन कोबाल्टोसेनियम केशन का निर्माण करता है; और निकेलोसिन 18-इलेक्ट्रॉन कॉम्प्लेक्स देने के लिए सबस्ट्रेट्स के साथ प्रतिक्रिया करता है, उदा। सीपीएनआईसीएल (पीआर .)3) और मुफ्त सीपीएच।
निकलोसीन के मामले में, अतिरिक्त दो इलेक्ट्रॉन ऑर्बिटल्स में हैं जो कमजोर रूप से धातु-कार्बन प्रतिरक्षी हैं; यही कारण है कि यह अक्सर प्रतिक्रियाओं में भाग लेता है जहां एम-सी बांड टूट जाते हैं और धातु की इलेक्ट्रॉन संख्या 18 में बदल जाती है।[9] 20-इलेक्ट्रॉन सिस्टम टीएम (सीओ)8− (TM = Sc, Y, La) का घन (O .) होता हैh) संतुलन ज्यामिति और एक सिंगलेट (1आ1g) इलेक्ट्रॉनिक ग्राउंड स्टेट। a के साथ एक अधिकृत संयोजकता MO है2u समरूपता, जो धातु AOs के योगदान के बिना केवल लिगैंड ऑर्बिटल्स द्वारा बनाई गई है। लेकिन व्यसन TM(CO)8- (TM=Sc, Y, La) 18-इलेक्ट्रॉन नियम को पूरा करते हैं, जब कोई केवल उन वैलेंस इलेक्ट्रॉनों पर विचार करता है, जो धातु-लिगैंड बॉन्डिंग ऑर्बिटल्स पर कब्जा कर लेते हैं।[10]
यह भी देखें
संदर्भ
- ↑ 1.0 1.1 Langmuir, I. (1921). "वैलेंस के प्रकार". Science. 54 (1386): 59–67. Bibcode:1921Sci....54...59L. doi:10.1126/science.54.1386.59. PMID 17843674.
- ↑ Jensen, William B. (2005). "18-इलेक्ट्रॉन नियम की उत्पत्ति". J. Chem. Educ. 82 (1): 28. Bibcode:2005JChEd..82...28J. doi:10.1021/ed082p28.
- ↑ Frenking, Gernot; Shaik, Sason, eds. (May 2014). "Chapter 7: Chemical bonding in Transition Metal Compounds". रासायनिक बंधन: आवर्त सारणी के पार रासायनिक बंधन. Wiley-VCH. ISBN 978-3-527-33315-8.
- ↑ Landis, C. R.; Weinhold, F. (2007). "मुख्य समूह और संक्रमण धातु बंधन में वैलेंस और अतिरिक्त-वैलेंस ऑर्बिटल्स". J. Comput. Chem. 28 (1): 198–203. doi:10.1002/jcc.20492. PMID 17063478.
- ↑ Frenking, Gernot; Fröhlich, Nikolaus (2000). "संक्रमण-धातु यौगिकों में बंधन की प्रकृति". Chem. Rev. 100 (2): 717–774. doi:10.1021/cr980401l. PMID 11749249.
- ↑ Zhao, Lili; Holzmann, Nicole; Schwerdtfeger, Peter; Frenking, Gernot (2019). "मुख्य-समूह यौगिकों के रासायनिक बंधन और बंधन मॉडल". Chem. Rev. 119 (14): 8781–8845. doi:10.1021/acs.chemrev.8b00722. PMID 31251603. S2CID 195761899.
- ↑ Bayse, Craig; Hall, Michael (1999). "समरूपता विश्लेषण द्वारा सरल संक्रमण धातु पॉलीहाइड्राइड परिसरों की ज्यामिति की भविष्यवाणी". J. Am. Chem. Soc. 121 (6): 1348–1358. doi:10.1021/ja981965+.
- ↑ King, R.B. (2000). "होमोलेप्टिक संक्रमण धातु हाइड्राइड आयनों में संरचना और बंधन". Coordination Chemistry Reviews. 200–202: 813–829. doi:10.1016/S0010-8545(00)00263-0.
- ↑ Girolami, Gregory; Rauchfuss, Thomas; Angelici, Robert (1999). "Experiment 20". अकार्बनिक रसायन विज्ञान में संश्लेषण और तकनीक. Sausalito, California: University Science Books. ISBN 978-0-935702-48-4.
- ↑ Jin, Jiaye; Yang, Tao; Xin, Ke; Wang, Guanjun; Jin, Xiaoyang; Zhou, Mingfei; Frenking, Gernot (2018-04-25). "समूह तीन संक्रमण धातुओं [टीएम (सीओ) 8] - (टीएम = एससी, वाई, ला) और 18-इलेक्ट्रॉन नियम के ऑक्टाकार्बोनिल आयन कॉम्प्लेक्स". Angewandte Chemie International Edition (in English). 57 (21): 6236–6241. doi:10.1002/anie.201802590. ISSN 1433-7851. PMID 29578636.
अग्रिम पठन
- Tolman, C. A. (1972). "The 16 and 18 electron rule in organometallic chemistry and homogeneous catalysis". Chem. Soc. Rev. 1 (3): 337. doi:10.1039/CS9720100337.