अम्ल: Difference between revisions
(text) |
|||
| Line 25: | Line 25: | ||
=== अरहेनियस एसिड === | === अरहेनियस एसिड === | ||
[[File:Arrhenius2.jpg|thumb|150px|स्वंते अरहेनियस]]1884 में, [[ Svante Arrhenius ]] ने अम्लता के गुणों को [[ हाइड्रोजन आयन | हाइड्रोजन आयनों]] | [[File:Arrhenius2.jpg|thumb|150px|स्वंते अरहेनियस]]1884 में, [[ Svante Arrhenius ]] ने अम्लता के गुणों को [[ हाइड्रोजन आयन | हाइड्रोजन आयनों]](H+) के लिए जिम्मेदार ठहराया, जिसे बाद में प्रोटॉन या हाइड्रोन के रूप में वर्णित किया गया। अरहेनियस एसिड एक ऐसा पदार्थ है, जिसे पानी में मिलाने पर, पानी में H+ आयनों की सांद्रता बढ़ जाती है।<ref name="Oxtoby8th"/><ref name="Ebbing"/>ध्यान दें कि रसायनज्ञ अक्सर एच + (एक्यू) लिखते हैं और एसिड-बेस प्रतिक्रियाओं का वर्णन करते समय हाइड्रोजन आयन का उल्लेख करते हैं लेकिन मुक्त हाइड्रोजन नाभिक, एक प्रोटॉन, पानी में अकेले मौजूद नहीं होता है, यह हाइड्रोनियम आयन (एच 3 ओ +) या अन्य रूपों के रूप में मौजूद होता है ( एच5ओ2+, एच9ओ4+)। इस प्रकार, एक अरहेनियस एसिड को एक ऐसे पदार्थ के रूप में भी वर्णित किया जा सकता है जो पानी में मिलाने पर हाइड्रोनियम आयनों की सांद्रता को बढ़ाता है। उदाहरणों में हाइड्रोजन क्लोराइड और एसिटिक एसिड जैसे आणविक पदार्थ शामिल हैं। | ||
दूसरी ओर, | दूसरी ओर, अरहेनियस बेस एक ऐसा पदार्थ है जो पानी में घुलने पर[[ हीड्राकसीड | हाइड्रॉक्साइड]](OH-) आयनों की सांद्रता को बढ़ाता है। इससे हाइड्रोनियम की सांद्रता कम हो जाती है क्योंकि आयन H2O अणु बनाने के लिए प्रतिक्रिया करते हैं: | ||
: | :H<sub>3</sub>O{{su|p=+|b=(aq)}} + OH{{su|p=−|b=(aq)}} ⇌ H<sub>2</sub>O<sub>(liq)</sub> + H<sub>2</sub>O<sub>(liq)</sub> | ||
इस संतुलन के कारण, हाइड्रोनियम की सांद्रता में कोई भी वृद्धि हाइड्रॉक्साइड की सांद्रता में कमी के साथ होती है। इस प्रकार, एक अरहेनियस एसिड को भी कहा जा सकता है जो हाइड्रॉक्साइड एकाग्रता को कम करता है, जबकि एक अरहेनियस बेस इसे बढ़ाता है। | इस संतुलन के कारण, हाइड्रोनियम की सांद्रता में कोई भी वृद्धि हाइड्रॉक्साइड की सांद्रता में कमी के साथ होती है। इस प्रकार, एक अरहेनियस एसिड को भी कहा जा सकता है जो हाइड्रॉक्साइड एकाग्रता को कम करता है, जबकि एक अरहेनियस बेस इसे बढ़ाता है। | ||
एक अम्लीय घोल में, हाइड्रोनियम आयनों की सांद्रता | एक अम्लीय घोल में, हाइड्रोनियम आयनों की सांद्रता 10−7 मोल प्रति लीटर से अधिक होती है। चूँकि pH को हाइड्रोनियम आयनों की सांद्रता के ऋणात्मक लघुगणक के रूप में परिभाषित किया जाता है, इसलिए अम्लीय विलयनों का pH इस प्रकार 7 से कम होता है। | ||
===ब्रोंस्टेड-लोरी एसिड | ===ब्रोंस्टेड-लोरी एसिड=== | ||
{{Main|Brønsted–Lowry acid–base theory}} | {{Main|Brønsted–Lowry acid–base theory}} | ||
[[File:Acetic-acid-dissociation-3D-balls.png|thumb|350px|alt=Acetic acid, CH<sub>3</sub>COOH, एक मिथाइल समूह, CH . से बना है<sub>3</sub>, एक कार्बोक्सिलेट समूह, COOH के लिए रासायनिक रूप से बाध्य। कार्बोक्सिलेट समूह एक प्रोटॉन खो सकता है और इसे पानी के अणु को दान कर सकता है, एच<sub>2</sub>0, एक एसीटेट आयन CH . को पीछे छोड़ते हुए<sub>3</sub>सीओओ- और हाइड्रोनियम केशन एच . बनाना<sub>3</sub>ओ। यह एक संतुलन प्रतिक्रिया है, इसलिए रिवर्स प्रक्रिया भी हो सकती है। एक कमजोर एसिड, [[ एसीटेट ]] आयन और [[ हाइड्रोनियम ]] आयन देने के लिए संतुलन प्रतिक्रिया में पानी के लिए एक प्रोटॉन (हाइड्रोजन आयन, हरे रंग में हाइलाइट किया गया) दान करता है। लाल: ऑक्सीजन, काला: कार्बन, सफेद: हाइड्रोजन।]]जबकि अरहेनियस अवधारणा कई प्रतिक्रियाओं का वर्णन करने के लिए उपयोगी है, यह इसके दायरे में भी काफी सीमित है। 1923 में, रसायनज्ञ जोहान्स निकोलस ब्रोंस्टेड और थॉमस मार्टिन लोरी ने स्वतंत्र रूप से | [[File:Acetic-acid-dissociation-3D-balls.png|thumb|350px|alt=Acetic acid, CH<sub>3</sub>COOH, एक मिथाइल समूह, CH . से बना है<sub>3</sub>, एक कार्बोक्सिलेट समूह, COOH के लिए रासायनिक रूप से बाध्य। कार्बोक्सिलेट समूह एक प्रोटॉन खो सकता है और इसे पानी के अणु को दान कर सकता है, एच<sub>2</sub>0, एक एसीटेट आयन CH . को पीछे छोड़ते हुए<sub>3</sub>सीओओ- और हाइड्रोनियम केशन एच . बनाना<sub>3</sub>ओ। यह एक संतुलन प्रतिक्रिया है, इसलिए रिवर्स प्रक्रिया भी हो सकती है। एक कमजोर एसिड, [[ एसीटेट ]] आयन और [[ हाइड्रोनियम ]] आयन देने के लिए संतुलन प्रतिक्रिया में पानी के लिए एक प्रोटॉन (हाइड्रोजन आयन, हरे रंग में हाइलाइट किया गया) दान करता है। लाल: ऑक्सीजन, काला: कार्बन, सफेद: हाइड्रोजन।]]जबकि अरहेनियस अवधारणा कई प्रतिक्रियाओं का वर्णन करने के लिए उपयोगी है, यह इसके दायरे में भी काफी सीमित है। 1923 में, रसायनज्ञ जोहान्स निकोलस ब्रोंस्टेड और थॉमस मार्टिन लोरी ने स्वतंत्र रूप से मान्यता दी कि एसिड-बेस प्रतिक्रियाओं में एक प्रोटॉन का स्थानांतरण शामिल है। ब्रोंस्टेड-लोरी एसिड (या बस ब्रोंस्टेड एसिड) एक प्रजाति है जो ब्रोंस्टेड-लोरी बेस को एक प्रोटॉन दान करती है।<ref name="Ebbing" />ब्रोंस्टेड-लोरी एसिड-बेस सिद्धांत के अरहेनियस सिद्धांत पर कई फायदे हैं। सिरका को अपना विशिष्ट स्वाद देने वाले कार्बनिक अम्ल एसिटिक अम्ल (CH3COOH) की निम्नलिखित अभिक्रियाओं पर विचार कीजिए: | ||
:{{chem2|CH3COOH + H2O <-> CH3COO- + H3O+}} | :{{chem2|CH3COOH + H2O <-> CH3COO- + H3O+}} | ||
:{{chem2|CH3COOH + NH3 <-> CH3COO− + NH4+}} | :{{chem2|CH3COOH + NH3 <-> CH3COO− + NH4+}} | ||
दोनों सिद्धांत आसानी से पहली प्रतिक्रिया का वर्णन करते हैं: | दोनों सिद्धांत आसानी से पहली प्रतिक्रिया का वर्णन करते हैं: CH3COOH एक अरहेनियस एसिड के रूप में कार्य करता है क्योंकि यह पानी में घुलने पर H3O+ के स्रोत के रूप में कार्य करता है, और यह पानी के लिए एक प्रोटॉन दान करके ब्रोंस्टेड एसिड के रूप में कार्य करता है। दूसरे उदाहरण में CH3COOH उसी परिवर्तन से गुजरता है, इस मामले में अमोनिया (NH3) को एक प्रोटॉन दान करता है, लेकिन एक एसिड की अरहेनियस परिभाषा से संबंधित नहीं है क्योंकि प्रतिक्रिया हाइड्रोनियम का उत्पादन नहीं करती है। फिर भी, CH3COOH एक अरहेनियस और एक ब्रोंस्टेड-लोरी एसिड दोनों है। | ||
ब्रोंस्टेड-लोरी सिद्धांत का उपयोग गैर-जलीय घोल या गैस चरण में | ब्रोंस्टेड-लोरी सिद्धांत का उपयोग गैर-जलीय घोल या गैस चरण में आणविक यौगिकों की प्रतिक्रियाओं का वर्णन करने के लिए किया जा सकता है। हाइड्रोजन क्लोराइड (HCl) और अमोनिया कई अलग-अलग परिस्थितियों में मिलकर [[ अमोनियम क्लोराइड |अमोनियम क्लोराइड]] ,NH4Cl बनाते हैं। जलीय घोल में HCl हाइड्रोक्लोरिक एसिड के रूप में व्यवहार करता है और हाइड्रोनियम और क्लोराइड आयनों के रूप में मौजूद होता है। निम्नलिखित प्रतिक्रियाएं अरहेनियस की परिभाषा की सीमाओं को दर्शाती हैं: | ||
# | # H<sub>3</sub>O{{su|p=+|b=(aq)}} + Cl{{su|p=−|b=(aq)}} + NH<sub>3</sub> → क्ल{{su|p=−|b=(aq)}} + एनएच{{su|b=4|p=+}}<sub>(aq)</sub> + एच<sub>2</sub>हे | ||
# एचसीएल<sub>(benzene)</sub> + एनएच<sub>3(benzene)</sub> → एनएच<sub>4</sub>क्लोरीन<sub>(s)</sub> | # एचसीएल<sub>(benzene)</sub> + एनएच<sub>3(benzene)</sub> → एनएच<sub>4</sub>क्लोरीन<sub>(s)</sub> | ||
# एचसीएल<sub>(g)</sub> + एनएच<sub>3(g)</sub> → एनएच<sub>4</sub>क्लोरीन<sub>(s)</sub> | # एचसीएल<sub>(g)</sub> + एनएच<sub>3(g)</sub> → एनएच<sub>4</sub>क्लोरीन<sub>(s)</sub> | ||
Revision as of 09:56, 24 November 2022
एसिड एक अणु या आयन है जो या तो प्रोटॉन (यानी हाइड्रोजन आयन, H+) दान करने में सक्षम है, जिसे ब्रोंस्टेड-लोरी एसिड के रूप में जाना जाता है, या एक इलेक्ट्रॉन जोड़ी के साथ एक सहसंयोजक बंधनबनाता है, जिसे लुईस एसिड के रूप में जाना जाता है।[1]
एसिड की पहली श्रेणी प्रोटॉन दाताओं, या ब्रोंस्टेड-लोरी एसिड हैं।जलीय घोलके विशेष मामले में, प्रोटॉन दाता हाइड्रोनियम आयनH3O+ बनाते हैं और उन्हें अरहेनियस एसिड के रूप में जाना जाता है। ब्रोंस्टेड और लोरी ने गैर-जलीय सॉल्वैंट्स को शामिल करने के लिए अरहेनियस सिद्धांत को सामान्यीकृत किया। ब्रोंस्टेड या अरहेनियस एसिडमें आमतौर पर एक रासायनिक संरचना से बंधे हाइड्रोजन परमाणु होते हैं जो एच + के नुकसान के बाद भी ऊर्जावान रूप से अनुकूल होते हैं।
जलीय अरहेनियस एसिड में विशिष्ट गुण होते हैं जो एक एसिड का व्यावहारिक विवरण प्रदान करते हैं।[2]एसिड खट्टे स्वाद के साथ जलीय घोल बनाते हैं, नीले लिटमसको लाल कर सकते हैं, और लवण बनाने के लिए क्षार और कुछ धातुओं (जैसे कैल्शियम )के साथ प्रतिक्रिया कर सकते हैं। एसिड शब्द लैटिनएसिडस से लिया गया है, जिसका अर्थ है 'खट्टा'। [3]एसिड के एक जलीय घोल का पीएच 7से कम होता है और इसे बोलचाल की भाषा में "एसिड" (जैसा कि "एसिड में घुला हुआ") भी कहा जाता है, जबकि सख्त परिभाषा केवल विलेय को संदर्भित करती है।[1]कम पीएच का अर्थ है उच्च अम्लता, और इस प्रकार समाधान में सकारात्मक हाइड्रोजन आयनों की उच्च सांद्रता। अम्ल के गुण वाले रसायन या पदार्थ अम्लीय कहलाते हैं।
सामान्य जलीय अम्लों में हाइड्रोक्लोरिक एसिड (हाईड्रोजन क्लोराईडका एक घोल जो पेट में गैस्ट्रिक अम्लमें पाया जाता है और पाचन एंजाइमों को सक्रिय करता है), एसिटिक एसिड (सिरका इस तरल का एक पतला जलीय घोल है), सल्फ्यूरिक एसिड (कार बैटरी में प्रयुक्त) शामिल हैं। और साइट्रिक एसिड(खट्टे फलों में पाया जाता है)। जैसा कि इन उदाहरणों से पता चलता है, एसिड (बोलचाल के अर्थ में) समाधान या शुद्ध पदार्थ हो सकते हैं, और एसिड से प्राप्त किया जा सकता है (सख्त[1]अर्थ में) जो ठोस, तरल या गैस हैं। मजबूत एसिड और कुछ केंद्रित कमजोर एसिड संक्षारक पदार्थ हैं, लेकिन कार्बोरेन और बोरिक एसिड जैसे अपवाद हैं।
एसिड की दूसरी श्रेणी लुईस एसिडहैं, जो एक इलेक्ट्रॉन जोड़ी के साथ एक सहसंयोजक बंधन बनाते हैं। एक उदाहरण बोरॉन ट्राइफ्लोराइड(बीएफ 3) है, जिसके बोरॉन परमाणु में एक खाली परमाणु कक्षीयहोता है जो एक आधार में एक परमाणु पर इलेक्ट्रॉनों की एक अकेली जोड़ी साझा करके एक सहसंयोजक बंधन बना सकता है, उदाहरण के लिए अमोनिया(एनएच 3) में नाइट्रोजन परमाणु। लुईस ने इसे ब्रोंस्टेड परिभाषा के सामान्यीकरण के रूप में माना, ताकि एक एसिड एक रासायनिक प्रजाति है जो इलेक्ट्रॉन जोड़े को सीधे या समाधान में प्रोटॉन (एच +) जारी करके स्वीकार करता है, जो तब इलेक्ट्रॉन जोड़े को स्वीकार करता है। हाइड्रोजन क्लोराइड, एसिटिक एसिड, और अधिकांश अन्य ब्रोंस्टेड-लोरी एसिड एक इलेक्ट्रॉन जोड़ी के साथ एक सहसंयोजक बंधन नहीं बना सकते हैं, और इसलिए लुईस एसिड नहीं हैं।[4] इसके विपरीत, कई लुईस एसिड अरहेनियस या ब्रोंस्टेड-लोरी एसिड नहीं हैं। आधुनिक शब्दावली में, एक एसिड परोक्ष रूप से ब्रोंस्टेड एसिड होता है न कि लुईस एसिड, क्योंकि रसायनज्ञ लगभग हमेशा लुईस एसिड को स्पष्ट रूप से लुईस एसिड के रूप में संदर्भित करते हैं।[4]
परिभाषाएं और अवधारणाएं
आधुनिक परिभाषाएँ सभी अम्लों के लिए सामान्य मूलभूत रासायनिक प्रतिक्रियाओं से संबंधित हैं।
रोज़मर्रा की ज़िंदगी में पाए जाने वाले अधिकांश एसिड जलीय घोल होते हैं, या पानी में घुल सकते हैं, इसलिए अरहेनियस और ब्रोंस्टेड-लोरी की परिभाषाएँ सबसे अधिक प्रासंगिक हैं।
ब्रोंस्टेड-लोरी परिभाषा सबसे व्यापक रूप से इस्तेमाल की जाने वाली परिभाषा है; जब तक अन्यथा निर्दिष्ट न हो, अम्ल-क्षार अभिक्रियाओं को एक अम्ल से क्षार में एक प्रोटॉन (H+) का स्थानांतरण शामिल माना जाता है।
हाइड्रोनियम आयन तीनों परिभाषाओं के अनुसार अम्ल होते हैं। हालांकि अल्कोहल और एमाइन ब्रोंस्टेड-लोरी एसिड हो सकते हैं, लेकिन वे अपने ऑक्सीजन और नाइट्रोजन परमाणुओं पर इलेक्ट्रॉनों के अकेले जोड़े के कारण लुईस बेस के रूप में भी कार्य कर सकते हैं।
अरहेनियस एसिड
1884 में, Svante Arrhenius ने अम्लता के गुणों को हाइड्रोजन आयनों(H+) के लिए जिम्मेदार ठहराया, जिसे बाद में प्रोटॉन या हाइड्रोन के रूप में वर्णित किया गया। अरहेनियस एसिड एक ऐसा पदार्थ है, जिसे पानी में मिलाने पर, पानी में H+ आयनों की सांद्रता बढ़ जाती है।[4][5]ध्यान दें कि रसायनज्ञ अक्सर एच + (एक्यू) लिखते हैं और एसिड-बेस प्रतिक्रियाओं का वर्णन करते समय हाइड्रोजन आयन का उल्लेख करते हैं लेकिन मुक्त हाइड्रोजन नाभिक, एक प्रोटॉन, पानी में अकेले मौजूद नहीं होता है, यह हाइड्रोनियम आयन (एच 3 ओ +) या अन्य रूपों के रूप में मौजूद होता है ( एच5ओ2+, एच9ओ4+)। इस प्रकार, एक अरहेनियस एसिड को एक ऐसे पदार्थ के रूप में भी वर्णित किया जा सकता है जो पानी में मिलाने पर हाइड्रोनियम आयनों की सांद्रता को बढ़ाता है। उदाहरणों में हाइड्रोजन क्लोराइड और एसिटिक एसिड जैसे आणविक पदार्थ शामिल हैं।
दूसरी ओर, अरहेनियस बेस एक ऐसा पदार्थ है जो पानी में घुलने पर हाइड्रॉक्साइड(OH-) आयनों की सांद्रता को बढ़ाता है। इससे हाइड्रोनियम की सांद्रता कम हो जाती है क्योंकि आयन H2O अणु बनाने के लिए प्रतिक्रिया करते हैं:
- H3O+
(aq) + OH−
(aq) ⇌ H2O(liq) + H2O(liq)
इस संतुलन के कारण, हाइड्रोनियम की सांद्रता में कोई भी वृद्धि हाइड्रॉक्साइड की सांद्रता में कमी के साथ होती है। इस प्रकार, एक अरहेनियस एसिड को भी कहा जा सकता है जो हाइड्रॉक्साइड एकाग्रता को कम करता है, जबकि एक अरहेनियस बेस इसे बढ़ाता है।
एक अम्लीय घोल में, हाइड्रोनियम आयनों की सांद्रता 10−7 मोल प्रति लीटर से अधिक होती है। चूँकि pH को हाइड्रोनियम आयनों की सांद्रता के ऋणात्मक लघुगणक के रूप में परिभाषित किया जाता है, इसलिए अम्लीय विलयनों का pH इस प्रकार 7 से कम होता है।
ब्रोंस्टेड-लोरी एसिड
जबकि अरहेनियस अवधारणा कई प्रतिक्रियाओं का वर्णन करने के लिए उपयोगी है, यह इसके दायरे में भी काफी सीमित है। 1923 में, रसायनज्ञ जोहान्स निकोलस ब्रोंस्टेड और थॉमस मार्टिन लोरी ने स्वतंत्र रूप से मान्यता दी कि एसिड-बेस प्रतिक्रियाओं में एक प्रोटॉन का स्थानांतरण शामिल है। ब्रोंस्टेड-लोरी एसिड (या बस ब्रोंस्टेड एसिड) एक प्रजाति है जो ब्रोंस्टेड-लोरी बेस को एक प्रोटॉन दान करती है।[5]ब्रोंस्टेड-लोरी एसिड-बेस सिद्धांत के अरहेनियस सिद्धांत पर कई फायदे हैं। सिरका को अपना विशिष्ट स्वाद देने वाले कार्बनिक अम्ल एसिटिक अम्ल (CH3COOH) की निम्नलिखित अभिक्रियाओं पर विचार कीजिए:
- CH3COOH + H2O ⇌ CH3COO− + H3O+
- CH3COOH + NH3 ⇌ CH3COO− + NH+4
दोनों सिद्धांत आसानी से पहली प्रतिक्रिया का वर्णन करते हैं: CH3COOH एक अरहेनियस एसिड के रूप में कार्य करता है क्योंकि यह पानी में घुलने पर H3O+ के स्रोत के रूप में कार्य करता है, और यह पानी के लिए एक प्रोटॉन दान करके ब्रोंस्टेड एसिड के रूप में कार्य करता है। दूसरे उदाहरण में CH3COOH उसी परिवर्तन से गुजरता है, इस मामले में अमोनिया (NH3) को एक प्रोटॉन दान करता है, लेकिन एक एसिड की अरहेनियस परिभाषा से संबंधित नहीं है क्योंकि प्रतिक्रिया हाइड्रोनियम का उत्पादन नहीं करती है। फिर भी, CH3COOH एक अरहेनियस और एक ब्रोंस्टेड-लोरी एसिड दोनों है।
ब्रोंस्टेड-लोरी सिद्धांत का उपयोग गैर-जलीय घोल या गैस चरण में आणविक यौगिकों की प्रतिक्रियाओं का वर्णन करने के लिए किया जा सकता है। हाइड्रोजन क्लोराइड (HCl) और अमोनिया कई अलग-अलग परिस्थितियों में मिलकर अमोनियम क्लोराइड ,NH4Cl बनाते हैं। जलीय घोल में HCl हाइड्रोक्लोरिक एसिड के रूप में व्यवहार करता है और हाइड्रोनियम और क्लोराइड आयनों के रूप में मौजूद होता है। निम्नलिखित प्रतिक्रियाएं अरहेनियस की परिभाषा की सीमाओं को दर्शाती हैं:
- H3O+
(aq) + Cl−
(aq) + NH3 → क्ल−
(aq) + एनएच+
4(aq) + एच2हे - एचसीएल(benzene) + एनएच3(benzene) → एनएच4क्लोरीन(s)
- एचसीएल(g) + एनएच3(g) → एनएच4क्लोरीन(s)
एसिटिक एसिड प्रतिक्रियाओं के साथ, दोनों परिभाषाएं पहले उदाहरण के लिए काम करती हैं, जहां पानी विलायक है और हाइड्रोनियम आयन एचसीएल विलेय द्वारा बनता है। अगली दो प्रतिक्रियाओं में आयनों का निर्माण शामिल नहीं है लेकिन फिर भी प्रोटॉन-स्थानांतरण प्रतिक्रियाएं हैं। दूसरी प्रतिक्रिया में हाइड्रोजन क्लोराइड और अमोनिया (बेंजीन में घुले हुए) एक बेंजीन विलायक में और तीसरे गैसीय एचसीएल और एनएच में ठोस अमोनियम क्लोराइड बनाने के लिए प्रतिक्रिया करते हैं।3 ठोस बनाने के लिए गठबंधन करें।
लुईस एसिड
1923 में गिल्बर्ट एन. लुईस द्वारा एक तिहाई, केवल मामूली रूप से संबंधित अवधारणा प्रस्तावित की गई थी, जिसमें एसिड-बेस विशेषताओं के साथ प्रतिक्रियाएं शामिल हैं जिनमें प्रोटॉन स्थानांतरण शामिल नहीं है। लुईस एसिड एक ऐसी प्रजाति है जो किसी अन्य प्रजाति से इलेक्ट्रॉनों की एक जोड़ी को स्वीकार करती है; दूसरे शब्दों में, यह एक इलेक्ट्रॉन जोड़ी स्वीकर्ता है।[5]ब्रोंस्टेड एसिड-बेस प्रतिक्रियाएं प्रोटॉन ट्रांसफर प्रतिक्रियाएं हैं जबकि लुईस एसिड-बेस प्रतिक्रियाएं इलेक्ट्रॉन जोड़ी स्थानांतरण हैं। कई लुईस एसिड ब्रोंस्टेड-लोरी एसिड नहीं हैं। एसिड-बेस केमिस्ट्री के संदर्भ में निम्नलिखित प्रतिक्रियाओं का वर्णन कैसे किया जाता है, इसकी तुलना करें:
- File:LewisAcid.pngपहली प्रतिक्रिया में एक फ्लोराइड , F-, टेट्राफ्लोरोबोरेट उत्पाद बनाने के लिए बोरॉन ट्राइफ्लोराइड को एक अकेला जोड़ा देता है। फ्लोराइड रासायनिक संयोजन इलेक्ट्रॉन ों की एक जोड़ी खो देता है क्योंकि बी-एफ बंधन में साझा किए गए इलेक्ट्रॉन दो परमाणु परमाणु नाभिक के बीच अंतरिक्ष के क्षेत्र में स्थित होते हैं और इसलिए फ्लोराइड नाभिक से अधिक दूर होते हैं, क्योंकि वे अकेले फ्लोराइड आयन में होते हैं। बीएफ3 एक लुईस एसिड है क्योंकि यह फ्लोराइड से इलेक्ट्रॉन जोड़ी को स्वीकार करता है। इस प्रतिक्रिया को ब्रोंस्टेड सिद्धांत के संदर्भ में वर्णित नहीं किया जा सकता है क्योंकि कोई प्रोटॉन स्थानांतरण नहीं है। दूसरी प्रतिक्रिया को किसी भी सिद्धांत का उपयोग करके वर्णित किया जा सकता है। एक प्रोटॉन को एक अनिर्दिष्ट ब्रोंस्टेड एसिड से अमोनिया, एक ब्रोंस्टेड बेस में स्थानांतरित किया जाता है; वैकल्पिक रूप से, अमोनिया एक लुईस बेस के रूप में कार्य करता है और हाइड्रोजन आयन के साथ एक बंधन बनाने के लिए इलेक्ट्रॉनों की एक अकेली जोड़ी को स्थानांतरित करता है। इलेक्ट्रॉन जोड़ी प्राप्त करने वाली प्रजाति लुईस एसिड है; उदाहरण के लिए, H . में ऑक्सीजन परमाणु3O+ जब एच-ओ बांड में से एक टूट जाता है और बांड में साझा किए गए इलेक्ट्रॉनों को ऑक्सीजन पर स्थानीयकृत किया जाता है, तो इलेक्ट्रॉनों की एक जोड़ी प्राप्त करता है। संदर्भ के आधार पर, लुईस एसिड को ऑक्सीकरण एजेंट या वैद्युतकणसंचलन के रूप में भी वर्णित किया जा सकता है। कार्बनिक ब्रोंस्टेड एसिड, जैसे एसिटिक, साइट्रिक, या ऑक्सालिक एसिड, लुईस एसिड नहीं हैं।[4]वे पानी में वियोजित होकर एक लुईस अम्ल, H . उत्पन्न करते हैं+, लेकिन साथ ही साथ लुईस बेस (एसीटेट, साइट्रेट, या ऑक्सालेट, क्रमशः उल्लिखित एसिड के लिए) के बराबर मात्रा में उत्पन्न करते हैं। यह लेख ज्यादातर लुईस एसिड के बजाय ब्रोंस्टेड एसिड से संबंधित है।
वियोजन और संतुलन
अम्लों की अभिक्रियाओं को अक्सर इस रूप में सामान्यीकृत किया जाता है HA ⇌ H+ + A−, जहाँ HA अम्ल को दर्शाता है और A- संयुग्म अम्ल है। इस प्रतिक्रिया को प्रोटोलिसिस कहा जाता है। अम्ल के प्रोटोनेटेड रूप (HA) को कभी-कभी मुक्त अम्ल भी कहा जाता है।[6] एसिड-बेस संयुग्म जोड़े एक प्रोटॉन द्वारा भिन्न होते हैं, और एक प्रोटॉन (क्रमशः प्रोटोनेशन और अवक्षेपण ) को जोड़ने या हटाने के द्वारा परस्पर परिवर्तित किया जा सकता है। ध्यान दें कि एसिड आवेशित प्रजाति हो सकता है और संयुग्म आधार तटस्थ हो सकता है, जिस स्थिति में सामान्यीकृत प्रतिक्रिया योजना को लिखा जा सकता है HA+ ⇌ H+ + A. घोल में अम्ल और उसके संयुग्मी क्षार के बीच एक रासायनिक संतुलन होता है। संतुलन स्थिरांक K, विलयन में अणुओं या आयनों की साम्यावस्था सांद्रता की अभिव्यक्ति है। कोष्ठक एकाग्रता को इंगित करते हैं, जैसे कि [H2O] का अर्थ है H . की सांद्रता2O. अम्ल वियोजन स्थिरांक Ka आम तौर पर एसिड-बेस प्रतिक्रियाओं के संदर्भ में प्रयोग किया जाता है। K . का संख्यात्मक मानa उत्पाद की सांद्रता के उत्पाद (गणित) (गुणा) के बराबर होता है, जो अभिकारकों की सांद्रता से विभाजित होता है, जहाँ अभिकारक अम्ल (HA) होता है और उत्पाद संयुग्म आधार और H होते हैं।+</सुप>.
दो अम्लों के प्रबल होने पर K . अधिक होगाa कमजोर एसिड की तुलना में; मजबूत एसिड के लिए हाइड्रोजन आयनों का एसिड से अनुपात अधिक होगा क्योंकि मजबूत एसिड में अपने प्रोटॉन को खोने की प्रवृत्ति अधिक होती है। क्योंकि K . के लिए संभावित मानों की सीमाa परिमाण के कई आदेशों को फैलाता है, एक अधिक प्रबंधनीय स्थिरांक, pKa अधिक बार उपयोग किया जाता है, जहां pKa = -लॉग10 Ka. प्रबल अम्लों का pK छोटा होता हैa कमजोर एसिड की तुलना में। प्रयोगात्मक रूप से निर्धारित pKa 25 डिग्री सेल्सियस पर जलीय घोल में अक्सर पाठ्यपुस्तकों और संदर्भ सामग्री में उद्धृत किया जाता है।
नामकरण
अरहेनियस एसिड का नाम उनके आयनों के अनुसार रखा गया है। शास्त्रीय नामकरण प्रणाली में, आयनिक प्रत्यय को हटा दिया जाता है और निम्न तालिका के अनुसार एक नए प्रत्यय के साथ प्रतिस्थापित किया जाता है। उपसर्ग हाइड्रो- का उपयोग तब किया जाता है जब एसिड सिर्फ हाइड्रोजन और एक अन्य तत्व से बना होता है। उदाहरण के लिए, एचसीएल में क्लोराइड अपने आयनों के रूप में होता है, इसलिए हाइड्रो-उपसर्ग का उपयोग किया जाता है, और -आइड प्रत्यय नाम को हाइड्रोक्लोरिक एसिड बनाता है।
शास्त्रीय नामकरण प्रणाली:
| Anion prefix | Anion suffix | Acid prefix | Acid suffix | Example |
|---|---|---|---|---|
| per | ate | per | ic acid | perchloric acid (HClO4) |
| ate | ic acid | chloric acid (HClO3) | ||
| ite | ous acid | chlorous acid (HClO2) | ||
| hypo | ite | hypo | ous acid | hypochlorous acid (HClO) |
| ide | hydro | ic acid | hydrochloric acid (HCl) |
IUPAC नामकरण प्रणाली में, जलीय को केवल आयनिक यौगिक के नाम में जोड़ा जाता है। इस प्रकार, हाइड्रोजन क्लोराइड के लिए, एक एसिड समाधान के रूप में, IUPAC नाम जलीय हाइड्रोजन क्लोराइड है।
अम्ल शक्ति
एक एसिड की ताकत एक प्रोटॉन को खोने की उसकी क्षमता या प्रवृत्ति को दर्शाती है। एक मजबूत एसिड वह है जो पानी में पूरी तरह से अलग हो जाता है; दूसरे शब्दों में, एक प्रबल अम्ल HA का एक मोल (इकाई) पानी में घुल जाता है जिससे H का एक मोल प्राप्त होता है।+ और संयुग्मी आधार का एक मोल, A-, और कोई भी प्रोटोनेटेड एसिड HA नहीं। इसके विपरीत, एक कमजोर एसिड केवल आंशिक रूप से अलग हो जाता है और संतुलन पर एसिड और संयुग्म आधार दोनों समाधान में होते हैं। हाइड्रोक्लोरिक एसिड (HCl), हाइड्रोआयोडिक एसिड (HI), हाइड्रोब्रोमिक एसिड (HBr), परक्लोरिक तेजाब (HClO) मजबूत एसिड के उदाहरण हैं।4), नाइट्रिक अम्ल (HNO .)3) और सल्फ्यूरिक एसिड (H .)2इसलिए4) पानी में इनमें से प्रत्येक अनिवार्य रूप से 100% आयनित होता है। एक एसिड जितना मजबूत होता है, उतनी ही आसानी से वह एक प्रोटॉन खो देता है, H+</सुप>. दो प्रमुख कारक जो अवक्षेपण की आसानी में योगदान करते हैं, वे हैं एच-ए बॉन्ड की रासायनिक ध्रुवीयता और परमाणु ए का आकार, जो एच-ए बॉन्ड की ताकत को निर्धारित करता है। संयुग्म आधार की स्थिरता के संदर्भ में एसिड की ताकत पर भी अक्सर चर्चा की जाती है।
मजबूत एसिड में एक बड़ा एसिड पृथक्करण स्थिरांक होता है, Ka और एक अधिक नकारात्मक pKa कमजोर एसिड की तुलना में।
सल्फोनिक एसिड , जो कार्बनिक ऑक्सीएसिड हैं, मजबूत एसिड का एक वर्ग है। एक सामान्य उदाहरण टोल्यूनिसल्फ़ोनिक एसिड (टॉसिलिक एसिड) है। सल्फ्यूरिक एसिड के विपरीत, सल्फोनिक एसिड ठोस हो सकते हैं। वास्तव में, polystyrene सल्फोनेट में क्रियाशील पॉलीस्टाइनिन एक ठोस दृढ़ता से अम्लीय प्लास्टिक है जो फ़िल्टर करने योग्य है।
सुपर एसिड 100% सल्फ्यूरिक एसिड से अधिक मजबूत एसिड होते हैं। सुपरएसिड के उदाहरण फ्लोरोएंटिमोनिक एसिड , मैजिक एसिड और पर्क्लोरिक एसिड हैं। सुपरएसिड आयनिक, क्रिस्टलीय हाइड्रोनियम लवण देने के लिए पानी को स्थायी रूप से प्रोटॉन कर सकते हैं। वे कार्बोकेशन को मात्रात्मक रूप से स्थिर भी कर सकते हैं।
जबकि कूa एक एसिड यौगिक की ताकत को मापता है, एक जलीय एसिड समाधान की ताकत पीएच द्वारा मापा जाता है, जो समाधान में हाइड्रोनियम की एकाग्रता का संकेत है। पानी में एक एसिड यौगिक के एक साधारण समाधान का पीएच यौगिक के कमजोर पड़ने और यौगिक के K . द्वारा निर्धारित किया जाता हैa.
गैर-जलीय घोल में लुईस एसिड की ताकत
लुईस एसिड को ईसीडब्ल्यू मॉडल में वर्गीकृत किया गया है और यह दिखाया गया है कि एसिड की ताकत का कोई एक क्रम नहीं है।[7] लुईस एसिड की सापेक्ष स्वीकर्ता ताकत, बेस की एक श्रृंखला की ओर, अन्य लुईस एसिड की तुलना में, ईसीडब्ल्यू मॉडल द्वारा सचित्र किया जा सकता है।सीबी प्लॉट।[8][9] यह दिखाया गया है कि लुईस एसिड की ताकत के क्रम को परिभाषित करने के लिए कम से कम दो गुणों पर विचार किया जाना चाहिए। पियर्सन के गुणात्मक HSAB सिद्धांत के लिए दो गुण HSAB सिद्धांत और शक्ति हैं जबकि ड्रैगो के मात्रात्मक ECW मॉडल के लिए दो गुण इलेक्ट्रोस्टैटिक और सहसंयोजक हैं।
रासायनिक विशेषताएं
मोनोप्रोटिक एसिड
मोनोप्रोटिक एसिड, जिसे मोनोबैसिक एसिड के रूप में भी जाना जाता है, वे एसिड होते हैं जो विघटन (रसायन विज्ञान) (कभी-कभी आयनीकरण कहा जाता है) की प्रक्रिया के दौरान प्रति अणु एक प्रोटॉन दान करने में सक्षम होते हैं जैसा कि नीचे दिखाया गया है (एचए द्वारा दर्शाया गया है):
- HA (aq) + H2O (l) ⇌ H3O+ (aq) + A− (aq) कa
खनिज अम्ल ों में मोनोप्रोटिक अम्लों के सामान्य उदाहरणों में हाइड्रोक्लोरिक अम्ल (HCl) और नाइट्रिक अम्ल (HNO .) शामिल हैं3) दूसरी ओर, कार्बनिक अम्ल ों के लिए शब्द मुख्य रूप से एक कार्बोज़ाइलिक तेजाब समूह की उपस्थिति को इंगित करता है और कभी-कभी इन एसिड को मोनोकारबॉक्सिलिक एसिड के रूप में जाना जाता है। कार्बनिक अम्लों के उदाहरणों में चींटी का तेजाब (HCOOH), एसिटिक एसिड (CH .) शामिल हैं3COOH) और बेंज़ोइक अम्ल (C .)6H5सीओओएच)।
पॉलीप्रोटिक एसिड
पॉलीप्रोटिक एसिड, जिसे पॉलीबेसिक एसिड भी कहा जाता है, मोनोप्रोटिक एसिड के विपरीत, प्रति एसिड अणु में एक से अधिक प्रोटॉन दान करने में सक्षम होते हैं, जो प्रति अणु केवल एक प्रोटॉन दान करते हैं। विशिष्ट प्रकार के पॉलीप्रोटिक एसिड के अधिक विशिष्ट नाम होते हैं, जैसे कि डिप्रोटिक (या डिबासिक) एसिड (दान करने के लिए दो संभावित प्रोटॉन), और ट्राइप्रोटिक (या ट्राइबेसिक) एसिड (दान करने के लिए तीन संभावित प्रोटॉन)। कुछ मैक्रोमोलेक्यूल्स जैसे प्रोटीन और न्यूक्लिक एसिड में बहुत बड़ी संख्या में अम्लीय प्रोटॉन हो सकते हैं।[10] एक द्विध्रुवीय अम्ल (यहाँ H . द्वारा दर्शाया गया है)2ए) पीएच के आधार पर एक या दो पृथक्करण से गुजर सकता है। प्रत्येक पृथक्करण का अपना पृथक्करण स्थिरांक होता है, Ka1 और केa2.
- H2A (aq) + H2O (l) ⇌ H3O+ (aq) + HA− (aq) कa1
- HA− (aq) + H2O (l) ⇌ H3O+ (aq) + A2− (aq) कa2
पहला पृथक्करण स्थिरांक आमतौर पर दूसरे (यानी, K .) से अधिक होता हैa1 > केa2) उदाहरण के लिए, सल्फ्यूरिक एसिड (H .)2इसलिए4) बाइसल्फेट आयन (HSO .) बनाने के लिए एक प्रोटॉन दान कर सकता है−
4), जिसके लिए Ka1 बहुत बड़ी है; फिर यह सल्फेट आयन (SO .) बनाने के लिए दूसरा प्रोटॉन दान कर सकता है2−
4), जिसमें Ka2 मध्यवर्ती शक्ति है। बड़ा कूa1 पहले पृथक्करण के लिए सल्फ्यूरिक को एक मजबूत एसिड बनाता है। इसी तरह, कमजोर अस्थिर कार्बोनिक एसिड (H2CO3) बिकारबोनिट आयन बनाने के लिए एक प्रोटॉन खो सकता है (HCO−
3) और कार्बोनेट आयन बनाने के लिए एक सेकंड खो देते हैं (CO .)2−
3) दोनों केa मान छोटे हैं, लेकिन Ka1 > केa2 .
एक ट्राइप्रोटिक एसिड (H .)3ए) एक, दो, या तीन हदबंदी से गुजर सकता है और तीन हदबंदी स्थिरांक हैं, जहां Ka1 > केa2 > केa3.
- H3A (aq) + H2O (l) ⇌ H3O+ (aq) + H2A− (aq) कa1
- H2A− (aq) + H2O (l) ⇌ H3O+ (aq) + HA2− (aq) कa2
- HA2− (aq) + H2O (l) ⇌ H3O+ (aq) + A3− (aq) कa3
ट्राइप्रोटिक एसिड का एक अकार्बनिक उदाहरण ऑर्थोफोस्फोरिक एसिड (H .) है3बाद में4), आमतौर पर सिर्फ फॉस्फोरिक एसिड कहा जाता है। H . प्राप्त करने के लिए तीनों प्रोटॉन क्रमिक रूप से नष्ट हो सकते हैं2बाद में−
4, फिर एचपीओ2−
4, और अंत में पीओ3−
4, ऑर्थोफास्फेट आयन, जिसे आमतौर पर केवल फॉस्फेट कहा जाता है। भले ही मूल फॉस्फोरिक एसिड अणु पर तीन प्रोटॉन की स्थिति समतुल्य हो, क्रमिक Ka मान भिन्न होते हैं क्योंकि यदि संयुग्म आधार अधिक नकारात्मक रूप से चार्ज होता है तो प्रोटॉन खोने के लिए यह ऊर्जावान रूप से कम अनुकूल होता है। ट्राइप्रोटिक एसिड का एक कार्बनिक यौगिक उदाहरण साइट्रिक एसिड है, जो अंत में सिट्रट आयन बनाने के लिए क्रमिक रूप से तीन प्रोटॉन खो सकता है।
हालांकि प्रत्येक हाइड्रोजन आयन का बाद में नुकसान कम अनुकूल है, सभी संयुग्म आधार समाधान में मौजूद हैं। प्रत्येक प्रजाति के लिए भिन्नात्मक एकाग्रता, α (अल्फा) की गणना की जा सकती है। उदाहरण के लिए, एक सामान्य डिप्रोटिक एसिड समाधान में 3 प्रजातियां उत्पन्न करेगा: एच2ए, एचए-, और A2−. आंशिक सांद्रता की गणना नीचे दी गई है जब या तो पीएच दिया जाता है (जिसे [एच . में परिवर्तित किया जा सकता है)+]) या एसिड की सांद्रता इसके सभी संयुग्म आधारों के साथ:
दिए गए K . के लिए pH के विरुद्ध इन भिन्नात्मक सांद्रता का एक प्लॉट1 और के2, को बजरम प्लॉट के रूप में जाना जाता है। उपरोक्त समीकरणों में एक पैटर्न देखा गया है और इसे सामान्य n-प्रोटिक एसिड में विस्तारित किया जा सकता है जिसे i-times से हटा दिया गया है:
जहां के0 = 1 और अन्य K- पद अम्ल के लिए वियोजन स्थिरांक हैं।
तटस्थीकरण
न्यूट्रलाइज़ेशन (रसायन विज्ञान) एक एसिड और एक बेस के बीच की प्रतिक्रिया है, जो एक नमक (रसायन विज्ञान) और न्यूट्रलाइज़्ड बेस का उत्पादन करता है; उदाहरण के लिए, हाइड्रोक्लोरिक एसिड और सोडियम हाइड्रॉक्साइड सोडियम क्लोराइड और पानी बनाते हैं:
- एचसीएल(aq) + NaOH(aq) → एच2O(l) + NaCl(aq)
न्यूट्रलाइजेशन अनुमापन का आधार है, जहां एक पीएच संकेतक तुल्यता बिंदु दिखाता है जब एक एसिड में एक आधार के मोल की समान संख्या जोड़ दी जाती है। अक्सर यह गलत तरीके से माना जाता है कि न्यूट्रलाइजेशन का परिणाम पीएच 7.0 के साथ होना चाहिए, जो कि प्रतिक्रिया के दौरान समान एसिड और बेस स्ट्रेंथ के साथ ही होता है।
अम्ल से कमजोर क्षार के साथ उदासीनीकरण से दुर्बल अम्लीय लवण प्राप्त होता है। एक उदाहरण कमजोर अम्लीय अमोनियम क्लोराइड है, जो मजबूत एसिड हाइड्रोजन क्लोराइड और कमजोर आधार अमोनिया से उत्पन्न होता है। इसके विपरीत, एक कमजोर एसिड को एक मजबूत आधार के साथ बेअसर करने से एक कमजोर मूल नमक (जैसे, हाइड्रोजिन फ्लोराइड और सोडियम हाइड्रॉक्साइड से सोडियम फ्लोराइड ) मिलता है।
कमजोर अम्ल-कमजोर क्षार संतुलन
एक प्रोटोनेटेड एसिड के लिए एक प्रोटॉन खोने के लिए, सिस्टम का पीएच pK . से ऊपर उठना चाहिएa एसिड का। H . की घटी हुई सांद्रताउस मूल समाधान में + संतुलन को संयुग्मित आधार रूप (एसिड का अवक्षेपित रूप) की ओर स्थानांतरित कर देता है। निचले-पीएच (अधिक अम्लीय) समाधानों में, पर्याप्त मात्रा में एच . होता है+ घोल में सांद्रण जिससे अम्ल अपने प्रोटोनेटेड रूप में बना रहता है।
दुर्बल अम्लों और उनके संयुग्मी क्षारकों के लवणों के विलयन बफर विलयन बनाते हैं।
अनुमापन
एक जलीय घोल में एक एसिड की एकाग्रता का निर्धारण करने के लिए, एक एसिड-बेस टाइट्रेशन आमतौर पर किया जाता है। एक ज्ञात सांद्रता के साथ एक मजबूत आधार समाधान, आमतौर पर NaOH या KOH, जोड़ा गया आधार की मात्रा के साथ संकेतक के रंग परिवर्तन के अनुसार एसिड समाधान को बेअसर करने के लिए जोड़ा जाता है।[11] किसी क्षार द्वारा अनुमापित अम्ल के अनुमापन वक्र में दो अक्ष होते हैं, जिसमें आधार आयतन x-अक्ष पर और विलयन का pH मान y-अक्ष पर होता है। विलयन में क्षार मिलाने पर विलयन का pH हमेशा ऊपर जाता है।
उदाहरण: डिप्रोटिक एसिड
प्रत्येक डिप्रोटिक एसिड अनुमापन वक्र के लिए, बाएं से दाएं, दो मध्य बिंदु, दो तुल्यता बिंदु और दो बफर क्षेत्र हैं।[13]
तुल्यता अंक
क्रमिक वियोजन प्रक्रियाओं के कारण, द्विप्रोटिक अम्ल के अनुमापन वक्र में दो तुल्यता बिंदु होते हैं।[14] पहला तुल्यता बिंदु तब होता है जब पहले आयनीकरण से सभी पहले हाइड्रोजन आयनों का अनुमापन किया जाता है।[15] दूसरे शब्दों में, OH . की मात्रा− जोड़ा गया H . की मूल राशि के बराबर है2पहले तुल्यता बिंदु पर ए। दूसरा तुल्यता बिंदु तब होता है जब सभी हाइड्रोजन आयनों का अनुमापन किया जाता है। इसलिए, OH . की मात्रा− जोड़ा गया H . की मात्रा के दोगुने के बराबर है2इस समय ए. एक मजबूत आधार द्वारा अनुमापित एक कमजोर डिप्रोटिक एसिड के लिए, दूसरा तुल्यता बिंदु समाधान में परिणामी लवण के हाइड्रोलिसिस के कारण 7 से ऊपर पीएच पर होना चाहिए।[15]किसी भी तुल्यता बिंदु पर, आधार की एक बूंद जोड़ने से प्रणाली में पीएच मान में सबसे तेज वृद्धि होगी।
बफर क्षेत्र और मध्य बिंदु
द्विप्रोटिक अम्ल के अनुमापन वक्र में दो मध्यबिंदु होते हैं जहां pH=pKa. चूँकि दो भिन्न K . हैंa मान, पहला मध्यबिंदु pH=pK . पर होता हैa1 और दूसरा pH=pK . पर होता हैa2.[16] वक्र का प्रत्येक खंड जिसके केंद्र में एक मध्य बिंदु होता है, बफर क्षेत्र कहलाता है। क्योंकि बफर क्षेत्रों में एसिड और उसके संयुग्म आधार होते हैं, यह पीएच परिवर्तनों का विरोध कर सकता है जब आधार को अगले समकक्ष बिंदुओं तक जोड़ा जाता है।[5]
अम्लों के अनुप्रयोग
उद्योग में
आधुनिक उद्योग में लगभग सभी प्रक्रियाओं के उपचार में एसिड मौलिक अभिकर्मक हैं। सल्फ्यूरिक एसिड, एक डिप्रोटिक एसिड, उद्योग में सबसे व्यापक रूप से इस्तेमाल किया जाने वाला एसिड है, और यह दुनिया में सबसे अधिक उत्पादित औद्योगिक रसायन भी है। यह मुख्य रूप से उर्वरक, डिटर्जेंट, बैटरी और रंगों के उत्पादन में उपयोग किया जाता है, साथ ही अशुद्धियों को दूर करने जैसे कई उत्पादों के प्रसंस्करण में भी उपयोग किया जाता है।[17] 2011 के आंकड़ों के अनुसार, दुनिया में सल्फ्यूरिक एसिड का वार्षिक उत्पादन लगभग 200 मिलियन टन था।[18] उदाहरण के लिए, फॉस्फेट खनिज फॉस्फेट उर्वरकों के उत्पादन के लिए फॉस्फोरिक एसिड का उत्पादन करने के लिए सल्फ्यूरिक एसिड के साथ प्रतिक्रिया करते हैं, और जिंक ऑक्साइड को सल्फ्यूरिक एसिड में घोलकर, घोल को शुद्ध करके और इलेक्ट्रोइनिंग द्वारा जस्ता का उत्पादन किया जाता है।
रासायनिक उद्योग में, अम्ल उदासीनीकरण अभिक्रिया में लवण उत्पन्न करने के लिए अभिक्रिया करते हैं। उदाहरण के लिए, नाइट्रिक एसिड अमोनिया के साथ प्रतिक्रिया करके अमोनियम नाइट्रेट , एक उर्वरक का उत्पादन करता है। इसके अतिरिक्त, एस्टर का उत्पादन करने के लिए कार्बोक्जिलिक एसिड अल्कोहल के साथ एस्टरीफिकेशन हो सकता है।
एसिड का उपयोग अक्सर धातुओं से जंग और अन्य जंग को हटाने के लिए किया जाता है, जिसे अचार (धातु) के रूप में जाना जाता है। उनका उपयोग गीला सेल बैटरी में इलेक्ट्रोलाइट के रूप में किया जा सकता है, जैसे कार बैटरी में सल्फ्यूरिक एसिड।
भोजन में
टारटरिक एसिड कुछ सामान्य रूप से इस्तेमाल किए जाने वाले खाद्य पदार्थों जैसे कच्चे आम और इमली का एक महत्वपूर्ण घटक है। प्राकृतिक फलों और सब्जियों में भी एसिड होता है। संतरे, नींबू और अन्य खट्टे फलों में साइट्रिक एसिड मौजूद होता है। टमाटर, पालक, और विशेष रूप से स्टार फल और एक प्रकार का फल में ऑक्सालिक एसिड मौजूद होता है; ऑक्सालिक एसिड की उच्च सांद्रता के कारण रूबर्ब के पत्ते और कच्चे कैरम्बोला जहरीले होते हैं। एस्कॉर्बिक अम्ल (विटामिन सी) मानव शरीर के लिए एक आवश्यक विटामिन है और आंवला (फाइलेन्थस एम्ब्लिका ), नींबू, खट्टे फल और अमरूद जैसे खाद्य पदार्थों में मौजूद होता है।
कई एसिड विभिन्न प्रकार के खाद्य पदार्थों में एडिटिव्स के रूप में पाए जा सकते हैं, क्योंकि वे अपना स्वाद बदलते हैं और परिरक्षकों के रूप में काम करते हैं। फॉस्फोरिक एसिड, उदाहरण के लिए, कोला पेय का एक घटक है। एसिटिक अम्ल का उपयोग दैनिक जीवन में सिरके के रूप में किया जाता है। साइट्रिक एसिड का उपयोग सॉस और अचार में परिरक्षक के रूप में किया जाता है।
कार्बोनिक एसिड सबसे आम एसिड एडिटिव्स में से एक है जिसे व्यापक रूप से शीतल पेय में जोड़ा जाता है। निर्माण प्रक्रिया के दौरान, CO2 आमतौर पर कार्बोनिक एसिड उत्पन्न करने के लिए इन पेय में घुलने के लिए दबाव डाला जाता है। कार्बोनिक एसिड बहुत अस्थिर होता है और पानी में विघटित हो जाता है और CO2 कमरे के तापमान और दबाव पर। इसलिए, जब इस प्रकार के शीतल पेय की बोतलें या डिब्बे खोले जाते हैं, तो शीतल पेय सीओ के रूप में फीके और पुतले बन जाते हैं।2 बुलबुले निकलते हैं।[19] कुछ एसिड दवाओं के रूप में उपयोग किए जाते हैं। एसिटाइलसैलीसिलिक अम्ल (एस्पिरिन) का उपयोग दर्द निवारक के रूप में और बुखार को कम करने के लिए किया जाता है।
मानव शरीर में
मानव शरीर में अम्ल महत्वपूर्ण भूमिका निभाते हैं। पेट में मौजूद हाइड्रोक्लोरिक एसिड बड़े और जटिल खाद्य अणुओं को तोड़कर पाचन में सहायता करता है। शरीर के ऊतकों की वृद्धि और मरम्मत के लिए आवश्यक प्रोटीन के संश्लेषण के लिए अमीनो अम्ल की आवश्यकता होती है। शरीर के ऊतकों की वृद्धि और मरम्मत के लिए भी फैटी एसिड की आवश्यकता होती है। न्यूक्लिक एसिड डीएनए और आरएनए के निर्माण और जीन के माध्यम से संतानों को लक्षणों के संचारण के लिए महत्वपूर्ण हैं। कार्बोनिक एसिड शरीर में पीएच संतुलन बनाए रखने के लिए महत्वपूर्ण है।
मानव शरीर में विभिन्न प्रकार के कार्बनिक और अकार्बनिक यौगिक होते हैं, उनमें से डाइकारबॉक्सिलिक अम्ल कई जैविक व्यवहारों में एक आवश्यक भूमिका निभाते हैं। उनमें से कई एसिड अमीनो एसिड होते हैं, जो मुख्य रूप से प्रोटीन के संश्लेषण के लिए सामग्री के रूप में काम करते हैं।[20] अन्य कमजोर एसिड शरीर के पीएच को बड़े पैमाने पर होने वाले परिवर्तनों से बचाने के लिए अपने संयुग्म आधारों के साथ बफर के रूप में काम करते हैं जो कोशिकाओं के लिए हानिकारक होंगे।[21] बाकी डाइकारबॉक्सिलिक एसिड भी मानव शरीर में विभिन्न जैविक रूप से महत्वपूर्ण यौगिकों के संश्लेषण में भाग लेते हैं।
अम्ल उत्प्रेरण
एसिड का उपयोग औद्योगिक और कार्बनिक रसायन विज्ञान में उत्प्रेरक के रूप में किया जाता है; उदाहरण के लिए, गैसोलीन का उत्पादन करने के लिए alkylation प्रक्रिया में सल्फ्यूरिक एसिड का उपयोग बहुत बड़ी मात्रा में किया जाता है। कुछ एसिड, जैसे सल्फ्यूरिक, फॉस्फोरिक और हाइड्रोक्लोरिक एसिड, निर्जलीकरण प्रतिक्रिया और संक्षेपण प्रतिक्रियाओं को भी प्रभावित करते हैं। जैव रसायन में, कई एंजाइम एसिड कटैलिसीस को नियोजित करते हैं।[22]
जैविक घटना
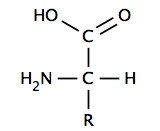
कई जैविक रूप से महत्वपूर्ण अणु अम्ल होते हैं। न्यूक्लिक अम्ल , जिसमें अम्लीय फॉस्फेट होता है, में डीएनए और आरएनए शामिल हैं। न्यूक्लिक एसिड में आनुवंशिक कोड होता है जो जीव की कई विशेषताओं को निर्धारित करता है, और माता-पिता से संतानों को पारित किया जाता है। डीएनए में प्रोटीन के संश्लेषण के लिए रासायनिक खाका होता है, जो अमीनो एसिड सबयूनिट्स से बना होता है। कोशिका झिल्ली में फॉस्फोलिपिड जैसे वसा अम्ल एस्टर होते हैं।
एक α-एमिनो एसिड में एक केंद्रीय कार्बन (α या अल्फा और बीटा कार्बन) होता है जो एक कार्बाक्सिल समूह (इस प्रकार वे कार्बोक्जिलिक एसिड होते हैं), एक अमाइन समूह, एक हाइड्रोजन परमाणु और एक चर समूह के साथ सहसंयोजक बंधित होता है। चर समूह, जिसे आर समूह या साइड चेन भी कहा जाता है, एक विशिष्ट अमीनो एसिड की पहचान और कई गुणों को निर्धारित करता है। ग्लाइसिन में, सबसे सरल अमीनो एसिड, आर समूह एक हाइड्रोजन परमाणु है, लेकिन अन्य सभी अमीनो एसिड में हाइड्रोजन से बंधे एक या अधिक कार्बन परमाणु होते हैं, और इसमें सल्फर, ऑक्सीजन या नाइट्रोजन जैसे अन्य तत्व हो सकते हैं। ग्लाइसीन के अपवाद के साथ, प्राकृतिक रूप से पाए जाने वाले अमीनो एसिड चिरलिटी (रसायन विज्ञान) हैं और लगभग हमेशा चिरायता (रसायन विज्ञान) # कॉन्फ़िगरेशन द्वारा: डी- और एल-|<छोटा>एल</छोटा>-कॉन्फ़िगरेशन में पाए जाते हैं। कुछ जीवाणु कोशिका भित्ति में पाए जाने वाले पेप्टिडोग्लाइकन में कुछ <छोटे>डी</छोटे> -एमिनो एसिड होते हैं। शारीरिक पीएच पर, आमतौर पर लगभग 7, मुक्त अमीनो एसिड एक आवेशित रूप में मौजूद होते हैं, जहां अम्लीय कार्बोक्सिल समूह (-COOH) एक प्रोटॉन (-COO) खो देता है।−) और मूल अमीन समूह (-NH .)2) एक प्रोटॉन प्राप्त करता है (-NH+
3) मूल या अम्लीय साइड चेन वाले अमीनो एसिड के अपवाद के साथ पूरे अणु में एक शुद्ध तटस्थ चार्ज होता है और एक ज़्विटेरियन होता है। उदाहरण के लिए, एस्पार्टिक अम्ल में एक प्रोटोनेटेड एमाइन और दो डिप्रोटोनेटेड कार्बोक्सिल समूह होते हैं, जो शारीरिक पीएच पर −1 के शुद्ध चार्ज के लिए होते हैं।
फैटी एसिड और फैटी एसिड डेरिवेटिव कार्बोक्जिलिक एसिड का एक और समूह है जो जीव विज्ञान में महत्वपूर्ण भूमिका निभाते हैं। इनमें लंबी हाइड्रोकार्बन श्रृंखलाएं और एक सिरे पर एक कार्बोक्जिलिक एसिड समूह होता है। लगभग सभी जीवों की कोशिका झिल्ली मुख्य रूप से फ़ॉस्फ़ोलिपिड बाइलेयर से बनी होती है, जो ध्रुवीय, हाइड्रोफिलिक फॉस्फेट प्रमुख समूहों के साथ हाइड्रोफोबिक फैटी एसिड एस्टर का एक मिसेल है। झिल्ली में अतिरिक्त घटक होते हैं, जिनमें से कुछ अम्ल-क्षार प्रतिक्रियाओं में भाग ले सकते हैं।
मनुष्यों और कई अन्य जानवरों में, हाइड्रोक्लोरिक एसिड पेट के भीतर स्रावित गैस्ट्रिक एसिड का एक हिस्सा है जो प्रोटीन और बहुशर्करा को हाइड्रोलाइज करने में मदद करता है, साथ ही निष्क्रिय प्रो-एंजाइम, [[ पित्त का एक प्रधान अंश ोजेन ]] को पाचन एंजाइम, पेप्सिन में परिवर्तित करता है। कुछ जीव रक्षा के लिए अम्ल उत्पन्न करते हैं; उदाहरण के लिए, चींटियाँ फॉर्मिक एसिड का उत्पादन करती हैं।
अम्ल-क्षार संतुलन स्तनधारी श्वास को विनियमित करने में महत्वपूर्ण भूमिका निभाता है। आणविक ऑक्सीजन गैस (O2) सेलुलर श्वसन को संचालित करता है, वह प्रक्रिया जिसके द्वारा जानवर भोजन में संग्रहीत रासायनिक संभावित ऊर्जा को छोड़ते हैं, कार्बन डाइआक्साइड (CO .) का उत्पादन करते हैं2) उपोत्पाद के रूप में। फेफड़ों में ऑक्सीजन और कार्बन डाइऑक्साइड का आदान-प्रदान होता है, और शरीर वेंटिलेशन (फिजियोलॉजी) की दर को समायोजित करके ऊर्जा की बदलती मांगों का जवाब देता है। उदाहरण के लिए, परिश्रम की अवधि के दौरान शरीर तेजी से संग्रहित कार्बोहाइड्रेट और वसा को तोड़ता है, जिससे CO . निकलता है2 रक्त प्रवाह में। रक्त CO . जैसे जलीय घोलों में2 कार्बोनिक एसिड और बाइकार्बोनेट आयन के साथ संतुलन में मौजूद है।
- CO2 + H2O ⇌ H2CO3 ⇌ H+ + HCO−3
यह पीएच में कमी है जो मस्तिष्क को तेजी से और गहरी सांस लेने का संकेत देती है, अतिरिक्त CO . को बाहर निकालती है2 और O . के साथ कोशिकाओं को फिर से आपूर्ति करना2.
कोशिका झिल्ली आमतौर पर चार्ज या बड़े, ध्रुवीय अणुओं के लिए अभेद्य होती है क्योंकि lipophilicity फैटी एसाइल चेन उनके आंतरिक भाग में होती है। कई फार्मास्युटिकल एजेंटों सहित कई जैविक रूप से महत्वपूर्ण अणु, कार्बनिक कमजोर एसिड होते हैं जो झिल्ली को उनके प्रोटोनेटेड, अपरिवर्तित रूप में पार कर सकते हैं लेकिन उनके चार्ज रूप में नहीं (यानी, संयुग्म आधार के रूप में)। इस कारण से कई दवाओं की गतिविधि को एंटासिड या अम्लीय खाद्य पदार्थों के उपयोग से बढ़ाया या बाधित किया जा सकता है। हालांकि, आवेशित रूप अक्सर रक्त और साइटोसोल , दोनों जलीय वातावरण में अधिक घुलनशील होता है। जब कोशिका के भीतर तटस्थ पीएच की तुलना में बाह्य वातावरण अधिक अम्लीय होता है, तो कुछ एसिड अपने तटस्थ रूप में मौजूद होंगे और झिल्ली में घुलनशील होंगे, जिससे वे फॉस्फोलिपिड बाइलेयर को पार कर सकेंगे। एसिड जो इंट्रासेल्युलर पीएच में एक प्रोटॉन खो देते हैं, उनके घुलनशील, आवेशित रूप में मौजूद होंगे और इस प्रकार साइटोसोल के माध्यम से अपने लक्ष्य तक फैलने में सक्षम होंगे। आइबुप्रोफ़ेन , एस्पिरिन और पेनिसिलिन दवाओं के उदाहरण हैं जो कमजोर एसिड हैं।
सामान्य अम्ल
खनिज अम्ल (अकार्बनिक अम्ल)
- हाइड्रोजन हैलाइड और उनके समाधान: हाइड्रोफ्लुओरिक अम्ल (एचएफ), हाइड्रोक्लोरिक एसिड (एचसीएल), हाइड्रोब्रोमिक एसिड (एचबीआर), हाइड्रोयोडिक एसिड (एचआई)
- हैलोजन ऑक्सोएसिड: हाइपोक्लोरस तेजाब (HClO), क्लोरस अम्ल (HClO .)2), क्लोरिक अम्ल (HClO .)3), पर्क्लोरिक अम्ल (HClO .)4), और ब्रोमीन और आयोडीन के अनुरूप एनालॉग्स
- हाइपोफ्लोरस एसिड (HFO), फ्लोरीन के लिए एकमात्र ज्ञात ऑक्सोएसिड।
- सल्फ्यूरिक अम्ल (H .)2इसलिए4)
- फ्लोरोसल्फ्यूरिक एसिड (HSO .)3एफ)
- नाइट्रिक एसिड (HNO3)
- फॉस्फोरिक एसिड (H3बाद में4)
- फ्लोरोएंटिमोनिक एसिड (HSbF .)6)
- फ्लोरोबोरिक एसिड (HBF .)4)
- हेक्साफ्लोरोफॉस्फोरिक एसिड (एचपीएफ)6)
- क्रोमिक अम्ल (H .)2सीआरओ4)
- बोरिक एसिड (H3बो3)
सल्फोनिक एसिड
एक सल्फोनिक एसिड का सामान्य सूत्र RS(=O) होता है2-OH, जहाँ R एक कार्बनिक मूलक है।
- मीथेनसल्फोनिक एसिड (या मेसिलिक एसिड, सीएच3इसलिए3एच)
- एथेनसल्फोनिक एसिड (या एसाइलिक एसिड, सीएच3चौधरी2इसलिए3एच)
- बेंजीनसल्फोनिक एसिड (या बेसिलिक एसिड, सी6H5इसलिए3एच)
- p-Toluenesulfonic एसिड (या टॉसिलिक एसिड, CH3C6H4इसलिए3एच)
- ट्राइफ्लोरोमेथेनसल्फोनिक एसिड (या ट्राइफ्लिक एसिड, CF3इसलिए3एच)
- पॉलीस्टाइनिन सल्फोनिक एसिड (सल्फ़ोनेटेड पॉलीस्टाइनिन, [सीएच2सीएच(सी6H4)इसलिए3एच]n)
कार्बोक्जिलिक एसिड
एक कार्बोक्जिलिक एसिड का सामान्य सूत्र R-C(O)OH होता है, जहां R एक कार्बनिक मूलक है। कार्बोक्सिल समूह -C(O)OH में एक कार्बोनिल समूह, C=O, और एक हाइड्रॉकसिल समूह, O-H होता है।
- एसिटिक अम्ल (CH .)3सीओओएच)
- साइट्रिक एसिड (सी6H8O7)
- फॉर्मिक एसिड (HCOOH)
- ग्लूकोनिक एसिड HOCH2-(सीएचओएच)4-कूह
- लैक्टिक अम्ल (CH .)3-चोह-कूह)
- ऑक्सालिक एसिड (HOOC-COOH)
- टार्टरिक अम्ल (HOOC-CHOH-CHOH-COOH)
हैलोजेनेटेड कार्बोक्जिलिक एसिड
अल्फा और बीटा कार्बन पर हैलोजनीकरण से अम्ल शक्ति बढ़ती है, जिससे निम्नलिखित अम्ल एसिटिक अम्ल से अधिक प्रबल होते हैं।
- फ्लोरोएसेटिक एसिड
- ट्री फ्लुओरो असेटिक अमल
- क्लोरोएसेटिक एसिड
- [[ डाइक्लोरोएसेटिक अम्ल ]]*
- ट्राइक्लोरोएसिटिक एसिड
विनाइल रिकॉर्ड कार्बोक्जिलिक एसिड
सामान्य कार्बोक्जिलिक एसिड एक कार्बोनिल समूह और एक हाइड्रॉक्सिल समूह का सीधा मिलन होता है। विनाइलॉगस कार्बोक्जिलिक एसिड में, कार्बन-कार्बन डबल बॉन्ड कार्बोनिल और हाइड्रॉक्सिल समूहों को अलग करता है।
- एस्कॉर्बिक अम्ल
न्यूक्लिक अम्ल
- डीएनए (डीएनए)
- आरएनए (आरएनए)
संदर्भ
- ↑ 1.0 1.1 1.2 IUPAC गोल्ड बुक - एसिड
- ↑ Petrucci, R. H.; Harwood, R. S.; Herring, F. G. (2002). सामान्य रसायन विज्ञान: सिद्धांत और आधुनिक अनुप्रयोग (8th ed.). Prentice Hall. p. 146. ISBN 0-13-014329-4.
- ↑ Merriam-Webster's Online Dictionary: acid
- ↑ 4.0 4.1 4.2 4.3 Otoxby, D. W.; Gillis, H. P.; Butler, L. J. (2015). आधुनिक रसायन विज्ञान के सिद्धांत (8th ed.). Brooks Cole. p. 617. ISBN 978-1305079113.
- ↑ 5.0 5.1 5.2 5.3 Ebbing, Darrell; Gammon, Steven D. (1 January 2016). सामान्य रसायन शास्त्र (in English) (11th ed.). Cengage Learning. ISBN 9781305887299.
- ↑ Stahl PH, Nakamo M (2008). "Pharmaceutical Aspects of the Salt Form". In Stahl PH, Warmth CG (eds.). फार्मास्युटिकल साल्ट की हैंडबुक: गुण, चयन और उपयोग. Weinheim: Wiley-VCH. pp. 92–94. ISBN 978-3-906390-58-1.
- ↑ Vogel G. C.; Drago, R. S. (1996). "ईसीडब्ल्यू मॉडल". Journal of Chemical Education. 73 (8): 701–707. Bibcode:1996JChEd..73..701V. doi:10.1021/ed073p701.
- ↑ Laurence, C. and Gal, J-F. Lewis Basicity and Affinity Scales, Data and Measurement, (Wiley 2010) pp 50-51 ISBN 978-0-470-74957-9
- ↑ Cramer, R. E.; Bopp, T. T. (1977). "लुईस एसिड और बेस के लिए एडक्ट फॉर्मेशन की एन्थैल्पी का ग्राफिकल डिस्प्ले". Journal of Chemical Education. 54: 612–613. doi:10.1021/ed054p612. The plots shown in this paper used older parameters. Improved E&C parameters are listed in ECW model.
- ↑ Wyman, Jeffries; Tileston Edsall, John. "Chapter 9: Polybasic Acids, Bases, and Ampholytes, Including Proteins". बायोफिजिकल केमिस्ट्री - वॉल्यूम 1. p. 477.
- ↑ de Levie, Robert (1999). जलीय अम्ल-क्षार संतुलन और अनुमापन. New York: Oxford University Press.
- ↑ Jameson, Reginald F. (1978). "3-(3,4-डायहाइड्रोक्सीफेनिल) ऐलेनिन (एल-डोपा) के लिए प्रोटॉन-एसोसिएशन स्थिरांक का असाइनमेंट". Journal of the Chemical Society, Dalton Transactions (in English) (1): 43–45. doi:10.1039/DT9780000043.
- ↑ Helfferich, Friedrich G. (1 January 1962). आयन विनिमय (in English). Courier Corporation. ISBN 9780486687841.
- ↑ "डिप्रोटिक एसिड का अनुमापन". dwb.unl.edu. Archived from the original on 7 February 2016. Retrieved 24 January 2016.
- ↑ 15.0 15.1 Kotz, John C.; Treichel, Paul M.; Townsend, John; Treichel, David (24 January 2014). रसायन विज्ञान और रासायनिक प्रतिक्रियाशीलता (in English). Cengage Learning. ISBN 9781305176461.
- ↑ Lehninger, Albert L.; Nelson, David L.; Cox, Michael M. (1 January 2005). जैव रसायन के लेहनिंगर सिद्धांत (in English). Macmillan. ISBN 9780716743392.
- ↑ "शीर्ष 10 औद्योगिक रसायन - डमी के लिए". dummies.com. Retrieved 5 February 2016.
- ↑ "सल्फ्यूरिक एसिड". essentialchemicalindustry.org. Retrieved 6 February 2016.
- ↑ McMillin, John R.; Tracy, Gene A.; Harvill, William A.; Credle, William S. Jr. (8 December 1981), Method of and apparatus for making and dispensing a carbonated beverage utilizing propellant carbon dioxide gas for carbonating, retrieved 6 February 2016
- ↑ Barrett, G. C.; Elmore, D. T. (June 2012). 8 - अमीनो एसिड और पेप्टाइड्स की जैविक भूमिकाएँ - विश्वविद्यालय प्रकाशन ऑनलाइन. doi:10.1017/CBO9781139163828. ISBN 9780521462921.
- ↑ Graham, Timur (2006). "एसिड बफरिंग". Acid Base Online Tutorial. University of Connecticut. Archived from the original on 13 February 2016. Retrieved 6 February 2016.
- ↑ Voet, Judith G.; Voet, Donald (2004). जीव रसायन. New York: J. Wiley & Sons. pp. 496–500. ISBN 978-0-471-19350-0.
- Listing of strengths of common acids and bases
- Zumdahl, Steven S. (1997). Chemistry (4th ed.). Boston: Houghton Mifflin. ISBN 9780669417944.
- Pavia, D. L.; Lampman, G. M.; Kriz, G. S. (2004). Organic Chemistry Volume I. Mason, OH: Cengage Learning. ISBN 0759347271.