थियोसल्फेट: Difference between revisions
No edit summary |
No edit summary |
||
| Line 73: | Line 73: | ||
== नामकरण == | == नामकरण == | ||
थियोसल्फेट एक स्वीकार्य सामान्य नाम है (किन्तुलगभग | थियोसल्फेट एक स्वीकार्य सामान्य नाम है (किन्तुलगभग सदैव उपयोग किया जाता है); कार्यात्मक प्रतिस्थापन [[IUPAC नामकरण]] का नाम सल्फ्यूरोथियोएट है; व्यवस्थित योज्य IUPAC नाम है ट्राईऑक्सीडोसल्फ़िडोसल्फ़ेट (2−) या ट्राइऑक्सिडो-1''κ''<sup>3</sup>O-डिसल्फेट(S—S)(2−)'।<ref name="RedBook"/>बाहरी सल्फर परमाणु में 2 की [[वैलेंस (रसायन विज्ञान)]] होती है जबकि केंद्रीय सल्फर परमाणु की वैलेंस 6 होती है। ऑक्सीजन परमाणुओं की वैलेंस 2 होती है। | ||
[[File:16oxstate.svg|thumb|center|550px|सल्फर के लिए [[लैटिमर आरेख]], जिनमें से एक थायोसल्फेट (+2) है]] | [[File:16oxstate.svg|thumb|center|550px|सल्फर के लिए [[लैटिमर आरेख]], जिनमें से एक थायोसल्फेट (+2) है]] | ||
{{Clear}} | {{Clear}} | ||
Revision as of 23:07, 24 March 2023
| |

| |
| Names | |
|---|---|
IUPAC names
| |
| Identifiers | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
PubChem CID
|
|
| UNII | |
| |
| |
| Properties | |
| S2O2−3 | |
| Molar mass | 112.12 g·mol−1 |
| Conjugate acid | Thiosulfuric acid |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |
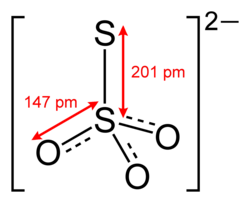
थायोसल्फेट (पसंदीदा IUPAC नाम|IUPAC-अनुशंसित वर्तनी; ब्रिटिश अंग्रेजी में कभी-कभी थायोसल्फेट) रासायनिक सूत्र वाला एक सल्फर ऑक्सासिड है S2O2−3. थियोसल्फेट भी इस आयन युक्त यौगिकों को संदर्भित करता है, जो थियोसल्फ्यूरिक एसिड के लवण हैं, उदा। सोडियम थायोसल्फ़ेट Na2S2O3. थियोसल्फेट भी थियोसल्फ्यूरिक एसिड के एस्टर को संदर्भित करता है, उदा। ओ, एस-डाइमिथाइल थायोसल्फेट | ओ, एस-डाइमिथाइल थायोसल्फेट CH3−O−S(=O)2−S−CH3. उपसर्ग थियो- इंगित करता है कि थियोसल्फेट एक सल्फेट है जिसमें गंधक द्वारा प्रतिस्थापित एक ऑक्सीजन होता है। थियोसल्फेट केंद्रीय एस परमाणु में चतुष्फलकीय है। थियोसल्फेट लवण स्वाभाविक रूप से होते हैं। थियोसल्फेट आयन में C होता है3v समरूपता, और कुछ जैव रासायनिक प्रक्रियाओं द्वारा निर्मित होती है। यह तेजी से पानी को डीक्लोरिनेट करता है और कागज बनाने वाले उद्योग में विरंजन को रोकने के लिए इसके उपयोग के लिए उल्लेखनीय है। थायोसल्फेट लवण मुख्य रूप से वस्त्रों में मरने और प्राकृतिक पदार्थों के विरंजन में उपयोग किया जाता है।[2]
सोडियम थायोसल्फेट, जिसे सामान्यतः हाइपो (हाइपोसल्फाइट से) कहा जाता है, फोटोग्राफी में फोटोग्राफिक फिक्सर ब्लैक एंड व्हाइट निगेटिव और प्रिंट के विकास के चरण के बाद व्यापक रूप से उपयोग किया जाता था; आधुनिक 'रैपिड' फिक्सर अमोनियम थायोसल्फेट को फिक्सिंग नमक के रूप में उपयोग करते हैं क्योंकि यह तीन से चार गुना तेजी से कार्य करता है।[3] कुछ बैक्टीरिया थायोसल्फेट को मेटाबोलाइज कर सकते हैं।[4]
गठन
थियोसल्फेट आयन मौलिक सल्फर के साथ सल्फाइट आयन की प्रतिक्रिया और सल्फाइड के अधूरे ऑक्सीकरण (जैसे पाइराइट ऑक्सीकरण) द्वारा निर्मित होता है। सोडियम थायोसल्फेट सोडियम हाइड्रॉक्साइड (फास्फोरस के समान) में घुलने वाले सल्फर के असमानुपातन द्वारा बनाया जा सकता है।
प्रतिक्रियाएं

थियोसल्फेट आयन केवल तटस्थ या क्षारीय समाधानों में स्थिर होते हैं, किन्तुअम्लीय समाधानों में नहीं, सल्फाइट आयनों और सल्फर के अनुपात में कमी के कारण, सल्फाइट आयनों को सल्फर डाइऑक्साइड से निर्जलित किया जाता है:
- S2O2−3 + 2 H+ → SO2 + S + H2O
इस प्रतिक्रिया का उपयोग सल्फर के एक जलीय निलंबन (रसायन विज्ञान) को उत्पन्न करने के लिए किया जा सकता है और भौतिकी में प्रकाश के रेले के प्रकीर्णन को प्रदर्शित करता है। यदि नीचे से सफेद प्रकाश डाला जाता है, तो दृश्यमान स्पेक्ट्रम #स्पेक्ट्रल रंग बगल से और दृश्यमान स्पेक्ट्रम #स्पेक्ट्रल रंग ऊपर से दिखाई देते हैं, उसी तंत्र के कारण जो दोपहर और शाम को आकाश को रंगते हैं।[citation needed]
थियोसल्फेट आयन आयोडीन के साथ अभिक्रिया करके टेट्राथिओनेट आयन देते हैं:
- 2 S2O2−3 + I2 → S4O2−6 + 2 I−
यह प्रतिक्रिया आयोडोमेट्री के लिए महत्वपूर्ण है। ब्रोमिन (एक्स = ब्र) और क्लोरीन (एक्स = सीएल) के साथ, थियोसल्फेट आयनों को सल्फेट आयनों में ऑक्सीकरण किया जाता है:
- S2O2−3 + 4 X2 + 5 H2O → 2 SO2−4 + 8 X− + 10 H+
धातुओं और धातु आयनों के साथ प्रतिक्रिया
थियोसल्फेट आयन बड़े पैमाने पर संक्रमण धातुओं के साथ विविध परिसरों का निर्माण करता है। चांदी आधारित फोटोग्राफी के युग में, फिक्सर अभिकर्मक के रूप में थायोसल्फेट आयन का बड़े पैमाने पर सेवन किया जाता था। यह एप्लिकेशन थायोसल्फेट आयन की चाँदी हलाइड्स को घोलने की क्षमता का लाभउठाता है। थायोसल्फेट आयन (सोडियम थायोसल्फेट के रूप में) का उपयोग साइनाइड आयन के कम जहरीले विकल्प के रूप में उनके अयस्कों से सोने और चांदी हलाइड निकालने या निकालने के लिए भी किया जाता है।[2] इसके अतिरिक्त धातुओं के लिए अपनी आत्मीयता को दर्शाता है, थायोसल्फेट आयन अम्लीय परिस्थितियों में धातुओं का तेजी से क्षरण करता है। इस्पात और स्टेनलेस स्टील विशेष रूप से थायोसल्फेट आयनों द्वारा प्रेरित पिटिंग जंग के प्रति संवेदनशील होते हैं। मोलिब्डेनम पिटिंग (AISI 316L hMo) की ओर स्टेनलेस स्टील के प्रतिरोध में सुधार करता है। क्षारीय जलीय स्थितियों और मध्यम तापमान (60 °C) में, कार्बन स्टील और स्टेनलेस स्टील (AISI 304L, 316L) पर हमला नहीं किया जाता है, यहां तक कि बेस (रसायन विज्ञान) (30%w पोटेशियम हाइड्रोक्साइड), थायोसल्फेट आयन (10%) की उच्च सांद्रता पर भी w) और फ्लोराइड आयन (5%w पोटेशियम फ्लोराइड) की उपस्थिति में।[citation needed]
घटना
अत्यंत दुर्लभ खनिज sydpietersite , Pb4(S2O3)O2(OH)2,[5] जैसा कि खनिज प्यार करने वाले में इस आयन की उपस्थिति हाल ही में विवादित थी।[6]
नामकरण
थियोसल्फेट एक स्वीकार्य सामान्य नाम है (किन्तुलगभग सदैव उपयोग किया जाता है); कार्यात्मक प्रतिस्थापन IUPAC नामकरण का नाम सल्फ्यूरोथियोएट है; व्यवस्थित योज्य IUPAC नाम है ट्राईऑक्सीडोसल्फ़िडोसल्फ़ेट (2−) या ट्राइऑक्सिडो-1κ3O-डिसल्फेट(S—S)(2−)'।[1]बाहरी सल्फर परमाणु में 2 की वैलेंस (रसायन विज्ञान) होती है जबकि केंद्रीय सल्फर परमाणु की वैलेंस 6 होती है। ऑक्सीजन परमाणुओं की वैलेंस 2 होती है।

जैव रसायन
एंजाइम रोडेनेज (थियोसल्फेट सल्फरट्रांसफेरेज़) थायोसल्फेट आयन द्वारा साइनाइड आयन के विषहरण को thiocyanate आयन और सल्फाइट आयन में बदलकर उत्प्रेरित करता है:
- CN− + S2O2−3 → SCN− + SO2−3
सोडियम थायोसल्फेट को हाइड्रॉक्सोकोबालामिन के साथ साइनाइड विषाक्तता के लिए एक अनुभवजन्य उपचार माना गया है। यह पूर्व-अस्पताल सेटिंग में सबसे प्रभावी है, क्योंकि साइटोक्रोम सी ऑक्सीडेज में सेलुलर श्वसन के अवरोध के कारण आपातकालीन कर्मियों द्वारा तत्काल प्रशासन आवश्यक है।[7][8][9][10] यह माइटोकॉन्ड्रिया में थायोसल्फेट सल्फरट्रांसफेरेज़ (टीएसटी (जीन)) को सक्रिय करता है। TST मोटापे और टाइप 2 मधुमेह | टाइप II (इंसुलिन प्रतिरोधी) मधुमेह से सुरक्षा से जुड़ा है।[11][12]
संदर्भ
- ↑ 1.0 1.1 International Union of Pure and Applied Chemistry (2005). Nomenclature of Inorganic Chemistry (IUPAC Recommendations 2005). Cambridge (UK): RSC–IUPAC. ISBN 0-85404-438-8. pp. 139,329. Electronic version.
- ↑ 2.0 2.1 Barbera, J. J.; Metzger, A.; Wolf, M. "Sulfites, Thiosulfates, and Dithionites". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a25_477.
{{cite encyclopedia}}: CS1 maint: uses authors parameter (link) - ↑ Sowerby, A. L. M., ed. (1961). Dictionary of Photography: A Reference Book for Amateur and Professional Photographers (19th ed.). London: Illife Books Ltd.[page needed]
- ↑ C.Michael Hogan. 2011. Sulfur. Encyclopedia of Earth, eds. A.Jorgensen and C.J.Cleveland, National Council for Science and the environment, Washington DC
- ↑ handbookofmineralogy.org, Mineral Handbook[full citation needed]
- ↑ Bindi, Luca; Bonazzi, Paola; Dei, Luigi; Zoppi, Angela (2005). "Does the bazhenovite structure really contain a thiosulfate group? A structural and spectroscopic study of a sample from the type locality". American Mineralogist. 90 (10): 1556–1562. Bibcode:2005AmMin..90.1556B. doi:10.2138/am.2005.1781. S2CID 59941277.
- ↑ Hall, Alan H.; Dart, Richard; Bogdan, Gregory (2007). "Sodium Thiosulfate or Hydroxocobalamin for the Empiric Treatment of Cyanide Poisoning?". Annals of Emergency Medicine. 49 (6): 806–13. doi:10.1016/j.annemergmed.2006.09.021. PMID 17098327.
- ↑ Hamel, J. (2011). "एक उपचार अद्यतन के साथ तीव्र साइनाइड विषाक्तता की समीक्षा" (PDF). Critical Care Nurse. 31 (1): 72–81, quiz 82. doi:10.4037/ccn2011799. PMID 21285466. Archived from the original (PDF) on 2013-06-12. Retrieved 2014-08-18.
- ↑ Shepherd, G.; Vélez, L. I (2008). "तीव्र साइनाइड विषाक्तता में हाइड्रोक्सोकोबालामिन की भूमिका". Annals of Pharmacotherapy. 42 (5): 661–9. doi:10.1345/aph.1K559. PMID 18397973. S2CID 24097516.
- ↑ Miles, Bryant (February 24, 2003). "अवरोधक और अयुग्मक" (PDF). Texas A&M University. Archived from the original (PDF) on 4 March 2016. Retrieved 25 November 2015.
- ↑ Stylianou, I. M.; et al. (2005). "Microarray gene expression analysis of the Fob3b obesity QTL identifies positional candidate gene Sqle and perturbed cholesterol and glycolysis pathways". Physiological Genomics. 20 (3): 224–232. CiteSeerX 10.1.1.520.5898. doi:10.1152/physiolgenomics.00183.2004. PMID 15598878.
- ↑ Morton, N. M.; Beltram, J.; Carter, R. N.; et al. (2016). "दुबलेपन के लिए चुने गए चूहों में एक एडिपोसाइट-व्यक्त एंटीडायबिटिक लक्ष्य के रूप में थायोसल्फेट सल्फरट्रांसफेरेज़ की आनुवंशिक पहचान". Nature Medicine. 22 (7): 771–779. doi:10.1038/nm.4115. PMC 5524189. PMID 27270587.