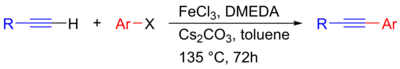सोनोगाशिरा अभिक्रिया
| Sonogashira coupling | |
|---|---|
| Named after | Kenkichi Sonogashira |
| Reaction type | Coupling reaction |
| Identifiers | |
| Organic Chemistry Portal | sonogashira-coupling |
| RSC ontology ID | RXNO:0000137 |
| Examples and Related Reactions | |
| Similar reactions | Copper-free Sonogashira coupling |
सोनोगाशिरा अभिक्रिया कार्बन-कार्बन बंध बनाने के लिए कार्बनिक संश्लेषण में उपयोग की जाने वाली एक क्रॉस-युग्मन अभिक्रिया है। यह एक पैलेडियम उत्प्रेरक के साथ-साथ तांबा सह-उत्प्रेरक को एक सीमावर्ती एल्काइन और एक एरिल या विनाइल हैलाइड के बीच कार्बन-कार्बन बंध बनाने के लिए नियोजित करता है।[1] .
| The Sonogashira reaction |
|---|
- R1 : एरिल या विनाइल
- R2 : स्वेच्छित
- X: I, Br, Cl या OTf
कार्बन-कार्बन बंध के निर्माण में इसकी उपयोगिता के कारण, सोनोगाशिरा क्रॉस-युग्मन अभिक्रिया विभिन्न प्रकार के क्षेत्रों में महत्वपूर्ण भूमिका निभाती है। अभिक्रिया हल्की परिस्थितियों में की जा सकती है, जैसे कमरे के तापमान पर, जलीय माध्यम में, और दुर्बल क्षार की उपस्थिति में, जिसनेसंकुल अणुओं के संश्लेषण में सोनोगाशिरा क्रॉस-युग्मन अभिक्रिया के उपयोग की अनुमति दी है। इसके अनुप्रयोगों में फार्मास्यूटिकल्स(दवाइयों), प्राकृतिक उत्पाद, जैविक सामग्री और नैनोमैटेरियल्स सम्मिलित हैं।[1] कुछ विशिष्ट उदाहरणों में टाज़रोटीन के संश्लेषण में भी इसका उपयोग सम्मिलित है,[2] जो सोरायसिस और मुंहासा का इलाज है, और इसका उपयोग SIB-1508Y को बनाने में भी किया जाता है, जिसे अल्टिनिकलाइन के नाम से भी जाना जाता है,[3] यह एक निकोटिनिक रिसेप्टर एगोनिस्ट है
इतिहास
1975 में कसार, डाइक और रिचर्ड एफ हेक[4] साथ ही केनकिची सोनोगाशिरा, तोहदा और हगिहारा[5] ने अपने स्वक्रियाविधि योगदानों से एरोमैटिक एसिटिलीन का उपयोग करते हुए एरिल हैलाइड् की एल्काइनाइलेशन अभिक्रिया के बारे में बताया था,[6] सभी अभिक्रियाएं समान अभिक्रिया उत्पादों को वहन करने के लिए पैलेडियम उत्प्रेरक का उपयोग करती हैं। हालांकि, कैसर और हेक के प्रोटोकॉल में पूरी तरह से पैलेडियम का उपयोग किया जाता है और इसके लिए कठोर अभिक्रिया की स्थिति (यानी उच्च तापमान) की आवश्यकता होती है। सोनोगाशिरा की प्रक्रिया में पैलेडियम संकुल ों के अलावा कॉपर-कोकेटलिस्ट के उपयोग ने अभिक्रिया ओं को उत्कृष्ट पैदावार में हल्की अभिक्रिया स्थितियों के तहत करने में सक्षम बनाया। Pd/Cu सिस्टम के तेजी से विकास ने असंख्य सिंथेटिक अनुप्रयोगों का अनुसरण किया और सक्षम किया, जबकि Cassar-Heck की स्थिति को छोड़ दिया गया था, शायद अन्यायपूर्ण, लेकिन सब भूल गए।[7] अभिक्रिया की उल्लेखनीय उपयोगिता को इसकी सिंथेटिक क्षमताओं को समझने और अनुकूलित करने के साथ-साथ सिंथेटिक, औषधीय या सामग्री/औद्योगिक महत्व के विभिन्न यौगिकों को तैयार करने के लिए प्रक्रियाओं को नियोजित करने पर अभी भी किए जा रहे शोध की मात्रा से प्रमाणित किया जा सकता है।[7]क्रॉस-युग्मनअभिक्रिया ओं में यह सुजुकी और हेक अभिक्रिया के ठीक बाद प्रकाशनों की संख्या में है[8] और सिफिंडर में सोनोगाशिरा शब्द की खोज 2007 और 2010 के बीच जर्नल प्रकाशनों के लिए 1500 से अधिक संदर्भ प्रदान करती है।[7]
सोनोगाशिरा अभिक्रिया इतनी अच्छी तरह से ज्ञात हो गई है कि अक्सर सभी अभिक्रिया एं जो आधुनिक ऑर्गोमेटेलिक उत्प्रेरक का उपयोग युगल एल्काइन रूपांकनों के लिए करती हैं, उन्हें कुछ सोनोगाशिरा युग्मन कहा जाता है .[7]
History[edit]
The alkynylation reaction of aryl halides using aromatic acetylenes was reported in 1975 in three independent contributions by Cassar, Dieck and Heck as well as Sonogashira, Tohda and Hagihara. All of the reactions employ palladium catalysts to afford the same reaction products. However, the protocols of Cassar and Heck are performed solely by the use of palladium and require harsh reaction conditions (i.e. high reaction temperatures). The use of copper-cocatalyst in addition to palladium complexes in Sonogashira's procedure enabled the reactions to be carried under mild reaction conditions in excellent yields. A rapid development of the Pd/Cu systems followed and enabled myriad synthetic applications, while Cassar-Heck conditions were left, maybe unjustly, all but forgotten. The reaction's remarkable utility can be evidenced by the amount of research still being done on understanding and optimizing its synthetic capabilities as well as employing the procedures to prepare various compounds of synthetic, medicinal or material/industrial importance. Among the cross-coupling reactions it follows in the number of publications right after Suzuki and Heck reaction and a search for the term "Sonogashira" in Scifinder provides over 1500 references for journal publications between 2007 and 2010.
क्रियाविधि
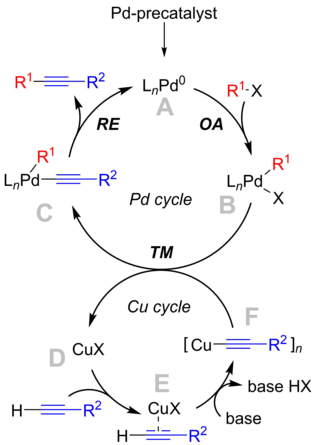
सोनागाशिरा अभिक्रिया के लिए उत्प्रेरक चक्र
अभिक्रिया की क्रियाविधि को स्पष्ट रूप से समझा नहीं गया है, लेकिन पाठ्यपुस्तक में लिखित क्रियाविधि एक पैलेडियम चक्र के इर्द-गिर्द घूमता है जो "क्लासिकल" क्रॉस-युग्मन क्रियाविधि और एक कॉपर चक्र के अनुरूप है, जिसके बारे में अधिक जानकारी नहीं है।[9]
पैलेडियम चक्र
- पैलेडियम पूर्व उत्प्रेरक यौगिक एक अभिक्रिया शील Pd0 यौगिक A (जो चित्र में यौगिक A के द्वारा दर्शाया गया है) बनाने के लिए अभिक्रिया शर्तों के तहत सक्रिय होते हैं, उत्प्रेरकों की सटीक पहचान अभिक्रिया की परिस्थिति पर निर्भर करती है। साधारण फॉस्फीन के साथ, जैसे PPh3 (n=2), और भारी फॉस्फीन (यानी, P(o-Tol)
3) के मामले में यह प्रदर्शित किया गया कि मोनोलिगेटेड प्रजातियां (n= 1) बनती हैं।[10] इसके अलावा, कुछ परिणाम ऋणायन पैलेडियम यौगिकों के निर्माण की ओर इशारा करते हैं, [L2Pd0Cl]− , जो ऋणायनों और हैलाइडों की उपस्थिति में वास्तविक उत्प्रेरक हो सकते हैं।[11] - PdII प्रजाति B का उत्पादन करने के लिए सक्रिय Pd0 उत्प्रेरक एराइल या विनाइल हैलाइड सब्सट्रेट के साथ ऑक्सीकारक योग चरण में सम्मिलित है। उपरोक्त चर्चा के समान, इसकी संरचना कार्यरत लिगेंड्स पर निर्भर करती है। इस चरण को अभिक्रिया का दर-निर्धारण चरण माना जाता है।
- संकुल B कॉपर एसिटाइलाइड, संकुल F के साथ ट्रांसमेटलेशन चरण में अभिक्रिया करता है, और संकुल C प्राप्त होता है और कॉपर उत्प्रेरक पुन: उत्पन्न हो जाता है।
- संकुल C की संरचना लिगेंड्स के गुणों पर निर्भर करती है। सुगम अपचयन विलोपन होने के लिए, सब्सट्रेट को पास के क्षेत्र यानी सिस-अभिविन्यास में होना चाहिए, इसलिए इसमें ट्रांस-सिस समावयवता सम्मिलित हो सकती है। अपचयन विलोपन में उत्पाद तोलने को संकुल से निष्कासित कर दिया जाता है और सक्रिय Pd उत्प्रेरक को पुनर्जीवित किया जाता है।
कॉपर चक्र
- कॉपर चक्र का पूरी तरह से वर्णन नहीं किया गया है। यह सुझाव दिया जाता है कि एक क्षार की उपस्थिति के परिणामस्वरूप π-एल्काइन संकुल E का निर्माण होता है। इससे सीमावर्ती प्रोटॉन की अम्लीयता बढ़ जाती है और फिर डिप्रोटोनेशन करने पर संकुल F, कॉपर एसिटाइलाइड, का निर्माण होता है।
- एसिटाइलाइड एफ तब पैलेडियम इंटरमीडिएट बी के साथ ट्रांसमेटेलेशन में सम्मिलित होता है।
कॉपर मुक्त सोनोगाशिरा संस्करण की क्रियाविधि
हालांकि अभिक्रिया की प्रभावशीलता के लिए लाभदायक, क्लासिकल सोनोगाशिरा अभिक्रिया में कॉपर लवण का उपयोग कई कमियों के साथ होता है, जैसे कि पर्यावरण के अनुकूल अभिकर्मकों का अनुप्रयोग, अवांछनीय एल्काइन होमकपलिंग (ग्लेसर साइड उत्पाद) का निर्माण और अभिक्रिया मिश्रण में सख्त ऑक्सीजन अपवर्जन की आवश्यकता । इस प्रकार, अभिक्रिया से कॉपर को बाहर करने के उद्देश्य से, Cu-मुक्त सोनोगाशिरा अभिक्रिया के विकास के लिए बहुत प्रयास किए गए थे। नई अभिक्रिया स्थितियों के विकास के साथ, कई प्रयोगात्मक और कम्प्यूटेशनल अध्ययनों ने अभिक्रिया क्रियाविधि की व्याख्या पर ध्यान केंद्रित किया।[12] कुछ समय पहले तक, कॉपर-मुक्त अभिक्रिया की यथार्थ क्रियाविधि पर विचार-विमर्श हो रहा था, जिसमें बहुत से अनुत्तरित महत्वपूर्ण यंत्रवत प्रश्न थे।[7] यह 2018 में कोस्म्रलज एट अल द्वारा सिद्ध किया गया था कि अभिक्रिया दो परस्पर जुड़े Pd0/PdII उत्प्रेरक चक्र के साथ आगे बढ़ती है।[13][14]
| Mechanism for the Cu-free Sonogashira reaction.[13][14] |
|---|
- संकुल B बनाने और अभिक्रिया के लिए एरिल हैलाइड सब्सट्रेट को सक्रिय करने के लिए मूल क्रियाविधि के समान, Pd0 चक्र की शुरुआत Pd0 उत्प्रेरक में एरिल हैलाइड या ट्राइफ्लेट के ऑक्सीकारक योग से होती है,
- PdII मध्यस्थता चक्र में एसिटिलीन कुछ सेकंड में सक्रिय होता है।यह सिद्ध हुआ था कि फेनिलासेटिलीन हल्के अभिक्रिया स्थितियों के तहत Pd मोनोएसिटाइलाइड संकुल D के साथ-साथ Pd बिसएसिटाइलाइड संकुल F बनाता है।
- दोनों सक्रिय संकुल, अर्थात् संकुल B और F, ट्रांसमेटेलेशन चरण में सम्मिलित हैं, जो संकुल C बनाते हैं और D को पुन: उत्पन्न करते हैं।
- अपचायक विलोपन के परिणामी उत्पाद, द्विप्रतिस्थापित एल्काइन उत्पाद के साथ-साथ पुनर्जीवित Pd0 उत्प्रेरक प्रजातियाँ, Pd0 उत्प्रेरक चक्र को पूरा करती है।
यह प्रदर्शित किया गया था कि एमाइन फॉस्फीन के लिए प्रतिस्पर्धी हैं और वर्णित अभिक्रिया प्रजातियों में लिगेंड L के रूप में भी भाग ले सकता है। एमाइन और फॉस्फीन के बीच प्रतिस्पर्धा की दर के आधार पर, विभिन्न समन्वय आधारों का उपयोग करते समय एक गतिशील और संकुल परस्पर क्रिया की उम्मीद की जाती है।[15][16][13][14]
अभिक्रिया की स्थिति
सोनोगाशिरा आमतौर पर हल्की परिस्थितियों में होती है।[17] क्रॉस-युग्मन कमरे के तापमान पर क्षार के साथ किया जाता है, आमतौर पर एक एमाइन, जैसे डाईथाईलामीन,[5]जोविलायक के रूप में भी कार्य करता है। इस युग्मन अभिक्रिया के उपोत्पाद के रूप में उत्पादित हाइड्रोजन हैलाइडको प्रभावहीन करने के लिए अभिक्रिया का माध्यम क्षारीय होना चाहिए, इसलिए ट्राइथाइलामाइन और डायथाइलैमाइन जैसे अमाइन यौगिकों को कभी-कभी विलायक के रूप में उपयोग किया जाता है, लेकिन डीएमएफ(DMF) या ईथर को विलायक के रूप में भी इस्तेमाल किया जा सकता है। अन्य क्षार जैसे पोटेशियम कार्बोनेट या सीज़ियम कार्बोनेट का कभी-कभी उपयोग किया जाता है। इसके अलावा, सोनोगाशिरा युग्मन अभिक्रियाओं के लिए औपचारिक रूप से निष्क्रिय परिस्थितियों की आवश्यकता होती है क्योंकि पैलेडियम (0) संकुल हवा में अस्थिर होते हैं, और ऑक्सीजन समरूप एसिटिलीन के निर्माण को बढ़ावा देता है। हाल ही में, वायु-स्थिर ऑर्गोपैलेडियम उत्प्रेरक के विकास की अभिक्रिया परिवेशी वातावरण में आयोजित की गयी थी।को परिवेश के वातावरण में आयोजित करने में सक्षम बनाता है। इसके अलावा, आर एम अल-ज़ौबी और उनके सहकर्मी परिवेश स्थितियों के तहत 1,2,3-ट्राइहेलोएरेनेस व्युत्पन्न के अधिक उत्पादन के लिए अत्यधिक रेजियोसेलेक्टिविटी के साथ सफलतापूर्वक विधि विकसित की है।[18]
उत्प्रेरक
आमतौर पर, इस अभिक्रिया के लिए दो उत्प्रेरकों की आवश्यकता होती है: एक शून्य संयोजक पैलेडियम संकुल और एक कॉपर (I) हैलाइड लवण। पैलेडियम उत्प्रेरक के सामान्य उदाहरणों में [Pd(PPh3)4] टेट्राकिस(ट्राइफेनिलफॉस्फीन) पैलेडियम (0), एक अन्य आमतौर पर इस्तेमाल किया जाने वाला पैलेडियम स्रोत [Pd(PPh3)2Cl2] बिस(ट्राइफेनिलफॉस्फीन) पैलेडियम क्लोराइड है| लेकिन द्विदंतुक फॉस्फीन लिगेंड युक्त संकुल, जैसे कि [Pd(dppe)Cl2], [Pd(dppp)Cl2], और [Pd(dppf)Cl2] का भी प्रयोग किया गया है।[9] ऐसे उत्प्रेरकों की कमी पैलेडियम (5 मोल% तक) के उच्च भार के साथ-साथ कॉपर के सह-उत्प्रेरक की एक बड़ी मात्रा की आवश्यकता है।[9] PdII संकुल वास्तव में पूर्व-उत्प्रेरक हैं क्योंकि उत्प्रेरण शुरू होने से पहले उन्हें Pd(0) तक अपचयित किया जाना चाहिए। PdII संकुल आमतौर पर Pd0 संकुल की तुलना में अधिक स्थिरता प्रदर्शित करते हैं और इन्हे महीनों के लिए सामान्य प्रयोगशाला स्थितियों के तहत संग्रहीत किया जा सकता है।[19] एक एमाइन, एक फॉस्फीन लिगेंड, या मिश्रण में किसी अन्य अभिकारक द्वारा अभिक्रिया मिश्रण में PdII उत्प्रेरक अपचयित होकर Pd0 हो जाते हैं और अभिक्रिया को आगे बढ़ने की अनुमति देता है।[20] उदाहरण के लिए स्वस्थानी में जब [Pd(PPh3)2Cl2] प्रयोग किया जाता है तो ट्राइफेनिलफॉस्फीन के ट्राइफेनिलफॉस्फीन ऑक्साइड के ऑक्सीकरण से Pd0 का निर्माण हो सकता है।
कॉपर(I) लवण, जैसे कॉपर(I) आयोडाइड (CuI), सीमावर्ती एल्काइन के साथ अभिक्रिया करता है और एक कॉपर(I) एसिटाइलाइड का उत्पादन करता है, जो युग्मन अभिक्रियाओं के लिए एक सक्रिय प्रजाति के रूप में कार्य करता है। Cu(I) अभिक्रिया में सह-उत्प्रेरक है, और इसका उपयोग अभिक्रिया की दर को बढ़ाने के लिए किया जाता है।[7]
एरिल हैलाइड्स और स्यूडोहैलाइड्स
एरिल हैलाइड या स्यूडोहैलाइड सब्सट्रेट का चुनाव (sp2-कार्बन) सोनोगाशिरा उत्प्रेरक प्रणाली की अभिक्रिया शीलता को प्रभावित करने वाले कारकों में से एक है। हैलाइडों की अभिक्रियाशीलता आयोडीन के प्रति अधिक होती है, और विनाइल हैलाइड समान ऐरिल हैलाइडों की तुलना में अधिक क्रियाशील होते हैं।

एरिल हैलाइड्स के स्थान पर एरिल ट्राइफ्लेट्स का भी प्रयोग किया जा सकता है।
एरेनेडियाज़ोनियम अग्रदूत
सोनोगाशिरा युग्मन अभिक्रिया के लिए एरेनेडियाज़ोनियम लवण को एरिल हैलाइड् के विकल्प के रूप में सूचित किया गया है। गोल्ड(I) क्लोराइड का उपयोग सह-उत्प्रेरक के रूप में पैलेडियम(II) क्लोराइड के साथ सीमावर्ती एल्काइन और एरेनेडियाज़ोनियम लवण के युग्मन में किया गया है, यह प्रक्रिया बिस-2,6-डाइआइसोप्रोपिलफेनिल डाइ हाइड्रोइमिडाजोलियम क्लोराइड (IPr NHC) (5 mol%) एक NHC-पैलेडियम संकुल की उपस्थिति में की जाती है,और 2,6 डाइ-टर्शियरी-ब्यूटाइल-4-मिथाइल पिरिडीन (डीबीएमएस) को एसीटोनाइट्राइल में क्षार के रूप में कमरे के तापमान पर विलायक के रूप में उत्पन्न करता है।[21] इस युग्मन को ऐनिलीन से प्रारंभ करके डाइऐज़ोनियम लवण का निर्माण किया जा सकता है सोनोगाशिरा युग्मन, जहां ऐनिलीन को डाइऐज़ोनियम लवण में बदल दिया जाता है और आगे फेनिलएसिटिलीन के साथ युग्मन द्वारा एल्काइन में परिवर्तित किया जाता है।
एल्काइन
विभिन्न ऐरोमैटिक एल्काइन का उपयोग वांछित द्विप्रतिस्थापित उत्पादों को संतोषजनक उत्पाद प्राप्त करने के लिए किया जा सकता है। एलिफैटिक एल्काइन सामान्यतः कम क्रियाशील होते हैं।
आधार
क्षार की महत्वपूर्ण भूमिका के कारण अभिक्रिया को आगे बढ़ाने के लिए विशिष्ट ऐमीनों को अधिक मात्रा में या विलायक के रूप में जोड़ा जाना चाहिए। यह पता चला है कि द्वितीयक अमाइन जैसे कि पाइपरिडीन, मॉर्फोलिन, या डायसोप्रोपाइलामाइन विशेष रूप से ट्रांस -RPdX(PPh3)2 के साथ एक PPh3 लिगेंड को प्रतिस्थापित करके कुशलतापूर्वक और उत्क्रमणीय रूप से अभिक्रिया कर सकते हैं इस अभिक्रिया का साम्य स्थिरांक R, X, क्षारकता के एक कारक और एमाइन की स्टेरिक अवरोध पर निर्भर करता है।[22] जिसके परिणामस्वरूप इस लिगेंड परिवर्तन के लिए एमाइन और एल्काइन समूह के बीच प्रतिस्पर्धा है, यही कारण है कि अधिमान्य प्रतिस्थापन को बढ़ावा देने के लिए आम तौर पर एमाइन को अधिक मात्रा में जोड़ा जाता है
अभिक्रिया विविधताएं
कॉपर मुक्त सोनोगाशिरा युग्मन
जब एक कॉपर सह-उत्प्रेरक को अभिक्रिया शीलता बढ़ाने के लिए अभिक्रिया में जोड़ा जाता है, कॉपर की उपस्थिति के परिणामस्वरूप एल्काइन डाइमर का निर्माण हो सकता है। यह ग्लेसर युग्मन अभिक्रिया के रूप में जाना जाता है, जो ऑक्सीकरण पर एसिटिलीन व्युत्पन्न के समयुग्मन उत्पादों का एक अवांछित निर्माण है। परिणामस्वरूप, कॉपर सह-उत्प्रेरक के साथ सोनोगाशिरा अभिक्रिया होने के लिए, अवांछित डाइमरीकरण से बचने के लिए एक निष्क्रिय गैस वातावरण में अभिक्रिया का होना आवश्यक है। समयुग्मन उत्पादों के निर्माण से बचने के लिए सोनोगाशिरा अभिक्रिया में कॉपर मुक्त विविधताएं विकसित की गयी है।[19][23] ऐसे अन्य मामले हैं जब कॉपर के उपयोग से बचा जाना चाहिए, जैसे कि सब्सट्रेट्स को सम्मिलित करने वाली युग्मन अभिक्रियाएं, जो संभावित कॉपर लिगेंड्स, उदाहरण के लिए मुक्त-क्षारीय पोरफिरिन।[9]
उलटा सोनोगाशिरा युग्मन
एक व्युत्क्रम सोनोगाशिरा युग्मन में अभिकारक एक एरिल या विनाइल यौगिक और एक एल्केनाइल हैलाइड होते हैं।[24]
उत्प्रेरक विविधताएं
सिल्वर सह-उत्प्रेरण
कुछ मामलों में कॉपर-मुक्त सोनोगाशिरा युग्मन के लिए CuI के स्थान परसिल्वर ऑक्साइड की स्टोइकोमेट्रिक मात्रा का उपयोग किया जा सकता है।[9]
निकल उत्प्रेरक
हाल ही में, एक निकल-उत्प्रेरित सोनोगाशिरा युग्मन विकसित किया गया है जो पैलेडियम के उपयोग के बिना एसिटिलीन के लिए गैर-सक्रिय एल्काइल हैलाइड्स के युग्मन की अनुमति देता है, हालांकि कॉपर सह-उत्प्रेरक की अभी भी आवश्यकता है।[25] यह भी बताया गया है कि सोने को एक विषमांगी उत्प्रेरक के रूप में इस्तेमाल किया जा सकता है, जिसे Au/CeO2 उत्प्रेरक[26][27] के साथ फेनिलासेटिलीन और आयोडोबेंजीन के युग्मन में प्रदर्शित किया गया था। इस मामले में, उत्प्रेरण Au(0) के साथ सक्रिय साइट के रूप में।[28] Au नैनोकणों पर विषमांगी रूप से कार्य करता है,[27][29] वांछनीय क्रॉस युग्मन उत्पाद की चयनात्मकता भी CeO2 और La2O3 जैसे समर्थनों द्वारा बढ़ी हुई पाई गई थी [28] इसके अतिरिक्त, लौह-उत्प्रेरित सोनोगाशिरा युग्मन की जांच पैलेडियम से अपेक्षाकृत सस्ते और गैर-विषैले विकल्प के रूप में की गई है। यहाँ, FeCl3 संक्रमण-धातु उत्प्रेरक और Cs2CO3 क्षार के रूप में कार्य करने के लिए प्रस्तावित है, इस प्रकार यह सैद्धांतिक रूप से एक पैलेडियम-मुक्त और कॉपर-मुक्त क्रियाविधि के माध्यम से आगे बढ़ रहा है।[30]
| Palladium-free Sonogashira reaction catalysed by iron[30] |
|---|
जबकि कॉपर मुक्त क्रियाविधि को सक्षम दिखाया गया है, ऊपर वर्णित विभिन्न संक्रमण धातुओं को पैलेडियम उत्प्रेरक के कम खर्चीले विकल्प के रूप में सम्मिलित करने के प्रयासों ने पैलेडियम की ट्रेस मात्रा के साथ अभिकर्मकों के संदूषण के कारण सफलता का खराब ट्रैक रिकॉर्ड दिखाया है, यह सुझाव देते हुए कि इन सैद्धांतिक मार्गों को प्राप्त करना बहुत ही असंभव है।[31] अध्ययनों से पता चला है कि कार्बनिक और अकार्बनिक प्रारंभिक सामग्री में युग्मन के लिए पर्याप्त (भाग-प्रति अंकन स्तर) पैलेडियम भी हो सकता है।[32]
सोना और पैलेडियम सह-उत्प्रेरण
इलेक्ट्रॉनिक और संरचनात्मक रूप से विभिन्न एरिल और हेटरोएरिल हैलाइड् की एक विस्तृत श्रृंखला के सोनोगाशिरा युग्मन के लिए एक अत्यधिक कुशल सोना और पैलेडियम संयुक्त पद्धति की सूचना दी गई है।[33] दो धातुओं की ओर्थोगोनल अभिक्रियाशीलता सोनोगाशिरा युग्मन में उच्च चयनात्मकता और अत्यधिक कार्यात्मक समूह सहिष्णुता को दर्शाती है। एक संक्षिप्त यांत्रिकी अध्ययन से पता चलता है कि सोना-एसिटाइलाइड मध्यवर्ती ट्रांसमेटलेशन चरण में पैलेडियम उत्प्रेरक चक्र में प्रवेश करता है।
डेंड्रिमेरिक पैलेडियम संकुल
उत्पाद निर्माण के बाद अक्सर महंगे उत्प्रेरक की वसूली से संबंधित मुद्दे सजातीय उत्प्रेरण के बड़े पैमाने पर अनुप्रयोगों के लिए एक गंभीर खामी है।[9]मेटलोडेंड्रिमर के रूप में जानी जाने वाली संरचनाएं सजातीय और विषम उत्प्रेरक के लाभों को जोड़ती हैं, क्योंकि वे घुलनशील और आणविक स्तर पर अच्छी तरह से परिभाषित होते हैं, और फिर भी उन्हें वर्षा, अल्ट्राफिल्ट्रेशन या अल्ट्रासेंट्रीफ्यूजेशन द्वारा पुनर्प्राप्त किया जा सकता है।[34] कॉपर से मुक्त सोनोगाशिरा अभिक्रिया के लिए वृक्ष के समान पैलेडियमसंकुल उत्प्रेरक के उपयोग के बारे में कुछ हालिया उदाहरण मिल सकते हैं। इस प्रकार, बाइडेंटेट फॉस्फीन पैलेडियम (II) पॉलीएमिनो डेंड्राइटिक उत्प्रेरक की कई पीढ़ियों का उपयोग ट्राइथाइलैमाइन में 25-120 डिग्री सेल्सियस पर एरिल आयोडाइड्स और ब्रोमाइड्स और एरिल क्लोराइड्स के युग्मन के लिए किया गया है, लेकिन बहुत कम पैदावार में।[35] डेंड्रिमेरिक उत्प्रेरक को आमतौर पर साधारण वर्षा और निस्पंदन द्वारा पुनर्प्राप्त किया जा सकता है और पांच गुना तक पुन: उपयोग किया जा सकता है, डेंड्रिमर अपघटन द्वारा उत्पादित कम गतिविधि के साथ और पैलेडियम लीचिंग द्वारा नहीं देखा जा रहा है। इन डेंड्रिमेरिक उत्प्रेरकों ने एक नकारात्मक वृक्ष के समान प्रभाव दिखाया; अर्थात्, डेंड्रिमर पीढ़ी बढ़ने पर उत्प्रेरक दक्षता कम हो जाती है। नीचे दिखाया गया पुनरावर्तनीय पॉलीमेरिक फॉस्फीन लिगेंड एक नॉरबोर्निन व्युत्पन्न के रिंग-ओपनिंग मेटाथेसिस पोलीमराइजेशन से प्राप्त किया गया है, और इसका उपयोग मिथाइल पायोडोबेंजोएट और फेनिलएसेटिलीन के कॉपर सह-उत्प्रेरित सोनोगाशिरा अभिक्रिया में किया गया है। Pd(dba)2·CHCl3 पैलेडियम स्रोत के रूप में।[36] निस्पंदन द्वारा पुनर्प्राप्ति के बावजूद, प्रत्येक रीसायकल प्रयोग में बहुलक उत्प्रेरक गतिविधि में लगभग 4-8% की कमी आई है।
नाइट्रोजन लिगेंड्स
पिरिडीन और पिरिमिडीन्स पैलेडियम के साथ मिलकर एक अच्छा संकुल बनाते हैं और सोनोगाशिरा युग्मन के लिए उपयुक्त उत्प्रेरक का निर्माण करते हैं। नीचे दिया गया डिपाइरीमिडिल-पैलेडियम संकुल 65 डिग्री सेल्सियस पर THF विलायक में आधार के रूप में N-butylamine का उपयोग करके फेनिलएसिटिलीन के साथ आयोडो-, ब्रोमो- और क्लोरोबेंजीन के कॉपर-फ्री युग्मन में नियोजित किया गया है। इसके अलावा, इस संकुल की सभी संरचनात्मक विशेषताओं को व्यापक एक्स-रे विश्लेषण द्वारा देखा गया है, जो देखी गई अभिक्रिया शीलता की पुष्टि करता है।[37] हाल ही में, डिपाइरिडिलपैलेडियम संकुल प्राप्त किया गया है और कमरे के तापमान पर आधार के रूप में टेट्रा-एन-ब्यूटाइलमोनियम एसीटेट (टीबीएए) का उपयोग करके एन-मिथाइलपाइरोलिडिनोन (एनएमपी) में एरिल आयोडाइड्स और ब्रोमाइड्स की कॉपर-मुक्त सोनोगाशिरा युग्मन अभिक्रिया में उपयोग किया गया है। इस संकुल का उपयोग रिफ्लक्सिंग पानी में विलायक के रूप में और हवा की उपस्थिति में एरिल आयोडाइड और ब्रोमाइड के युग्मन के लिए भी किया गया है, पाइरोलिडाइन को आधार के रूप में और टीबीएबी को योज्य के रूप में उपयोग किया जाता है,[38] हालांकि इसकी दक्षता विलायक के रूप में एन-मेथिलपाइरोलिडिनोन (एनएमपी) में अधिक थी। Pyridines and pyrimidines have shown good complexation properties for palladium and have been employed in the formation of catalysts suitable for Sonogashira couplings. The dipyrimidyl-palladium complex shown below has been employed in the copper-free coupling of iodo-, bromo-, and chlorobenzene with phenylacetylene using N-butylamine as base in THF solvent at 65 °C. Furthermore, all structural features of this complex have been characterized by extensive X-ray analysis, verifying the observed reactivity.

एन-हेटरोसायक्लिक कार्बाइन (एनएचसी) पैलेडियम संकुल
एन-हेटरोसाइक्लिक कार्बाइन | एन-हेटरोसाइक्लिक कार्बेन (एनएचसी) संक्रमण-धातु उत्प्रेरण में सबसे महत्वपूर्ण लिगेंड में से एक बन गए हैं। सामान्य एनएचसी की सफलता का श्रेय फॉस्फीन की तुलना में उनकी बेहतर -दान करने की क्षमताओं को दिया जाता है, जो असामान्य एनएचसी समकक्षों में और भी अधिक है। पैलेडियम संकुल ों में लिगेंड के रूप में कार्यरत, एनएचसी ने पूर्व उत्प्रेरकों के स्थिरीकरण और सक्रियण में बहुत योगदान दिया और इसलिए सोनोगाशिरा युग्मनसहित ऑर्गेनोमेटेलिक सजातीय उत्प्रेरण के कई क्षेत्रों में आवेदन पाया है।[9][40][41]
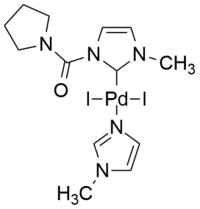
| An example of palladium(II) derived complex with normal NHC ligand.[42] | Efficient iPEPPSI catalyst for Cu-free Sonogashira reaction in water.[40] |
असामान्य एनएचसी के दिलचस्प उदाहरण mesoionic 1,2,3-triazol-5-ylidene संरचना पर आधारित हैं। PEPPSI प्रकार का एक कुशल, धनायनित पैलेडियम उत्प्रेरक, यानी, iPEPPSI ('i'आंतरिक' p'yridine-'e'nhanced 'p'recatalyst 'p'reparation 's'tabilization और 'i'nitiation) को कुशलतापूर्वक उत्प्रेरित करने के लिए प्रदर्शित किया गया था कॉपर, अमाइन, फॉस्फीन और अन्य योजक की अनुपस्थिति में, एरोबिक स्थितियों के तहत पानी में एकमात्र विलायक के रूप में तांबा मुक्त सोनोगाशिरा अभिक्रिया ।[40]
संश्लेषण में अनुप्रयोग
सोनोगाशिरा युग्मनसिंथेटिक अभिक्रिया ओं की एक विस्तृत श्रृंखला में कार्यरत हैं, मुख्य रूप से निम्नलिखित चुनौतीपूर्ण परिवर्तनों को सुविधाजनक बनाने में उनकी सफलता के कारण:
अल्काइनाइलेशन अभिक्रिया एं
कॉपर-प्रमोटेड या कॉपर-फ्री सोनोगाशिरा अभिक्रिया के अनुप्रयोगों के बारे में बात करते समय एक सीमावर्ती एल्काइन और एक एरोमैटिक रिंग का युग्मन महत्वपूर्ण अभिक्रिया है। ऐसे मामलों की सूची जहां एरिल हैलाइड्स का उपयोग करने वाली विशिष्ट सोनोगाशिरा अभिक्रिया को नियोजित किया गया है, और उदाहरण के उदाहरणों को चुनना मुश्किल है। इस पद्धति का एक हालिया उपयोग आयोडीन युक्त फेनिलएलनिन के युग्मन के लिए नीचे दिखाया गया है जिसमें डी-बायोटिन से प्राप्त एक सीमावर्ती एल्काइन के साथ उत्प्रेरक के रूप में सीटू उत्पन्न Pd(0) प्रजातियों का उपयोग किया जाता है, जिसने बायोएनालिटिकल अनुप्रयोगों के लिए अल्कीनेलिंक्ड फेनिलएलनिन व्युत्पन्न की तैयारी की अनुमति दी।[43] युग्मन भागीदारों के उदाहरण भी हैं, दोनों को एलिल रेजिन से जोड़ा जा रहा है, जिसमें Pd(0) उत्प्रेरक सब्सट्रेट के दरार को प्रभावित करता है और बाद में सोनोगाशिरा समाधान में युग्मन।[44]

प्राकृतिक उत्पाद
प्रकृति में पाए जाने वाले कई मेटाबोलाइट्स में एल्काइन या एनाइन मोएट होते हैं, और इसलिए, सोनोगाशिरा अभिक्रिया ने उनके संश्लेषण में लगातार उपयोगिता पाई है।[45] प्राकृतिक उत्पादों के कुल संश्लेषण की दिशा में इस युग्मन पद्धति के सबसे हालिया और आशाजनक अनुप्रयोगों में से कई ने विशेष रूप से विशिष्ट कॉपर-कोकेटलाइज्ड अभिक्रिया को नियोजित किया है।
एक आर्यल आयोडाइड के एक एरिल एसिटिलीन के युग्मन का एक उदाहरण आयोडीन युक्त अल्कोहल और ट्रिस (आइसोप्रोपाइल) सिलीएसिटिलीन की अभिक्रिया में देखा जा सकता है, जिसने एल्काइन दिया, जो बेंज़िंडेनोजेपाइन अल्कलॉइड बुल्गारामाइन के कुल संश्लेषण में एक मध्यवर्ती है।
विशिष्ट सोनोगाशिरा स्थितियों के तहत मध्यवर्ती की तैयारी के लिए एरिल आयोडाइड्स के उपयोग के अन्य हालिया उदाहरण हैं, जो चक्रीकरण के बाद, बेंज़िलिसोक्विनोलिन जैसे प्राकृतिक उत्पादों का उत्पादन करते हैं। [46]या इंडोल एल्कलॉइड[47] एक उदाहरण बेंज़िलिसोक्विनोलिन एल्कलॉइड (+)-(S)-लौडानोसिन और (-)-(S)-ज़ाइलोपिनिन का संश्लेषण है। इन प्राकृतिक उत्पादों के संश्लेषण में प्रत्येक अणु की कार्बन बैकबोन बनाने के लिए सोनोगाशिरा क्रॉस-युग्मनका उपयोग सम्मिलित था।[46] फ़ाइल: प्राकृतिक उत्पाद (+)-(एस)-लॉडानोसिन और (-)-(S)-xylopinine.svg|thumb|center|800px|प्राकृतिक उत्पाद (+)-(S)-लॉडानोसिन और (-)-(S)-ज़ाइलोपिनिन को सोनोगाशिरा क्रॉस-युग्मनअभिक्रिया का उपयोग करके संश्लेषित किया जाता है।[46]
एनाइन अर्ध भाग और एनेडीयन्स
जैविक रूप से सक्रिय और प्राकृतिक यौगिकों के लिए 1,3-एनाइन अर्ध भाग की मात्रा एक महत्वपूर्ण संरचनात्मक इकाई है।[citation needed] यह विन्यास-प्रतिधारण त्रिविम स्टीरियोस्पेसिफिक प्रक्रिया का उपयोग करके विनाइलिक प्रणाली और सीमावर्ती एसिटिलीन से प्राप्त किया जा सकता है जैसे सोनोगाशिरा अभिक्रिया। Pd(0) ऑक्सीकरण संख्या के लिए सबसे अधिक अभिक्रियाशील विनाइल हैलाइड विनाइल आयोडाइड् है, और इसलिए उनका उपयोग सोनोगाशिरा क्रॉस-युग्मन अभिक्रियाओं के लिए सबसे अधिक बार होता है, जो आमतौर पर नियोजित स्थितियों के कारण होता है। इसके कुछ उदाहरण हैं:
- एसिटिलीन की एक विस्तृत श्रृंखला के साथ 2-आयोडो-प्रोप-2-इनॉल का युग्मन।[48]
- डाई आयोडाइड और फेनिलएसिटिलीन के क्रॉस-युग्मन से एल्क-2-एनाइल ब्यूटा-1,3-डाइईन प्राप्त होता है, जैसा कि नीचे दिखाया गया है।[49]

फार्मास्यूटिकल्स
सोनोगाशिरा अभिक्रिया विभिन्न प्रकार के यौगिकों के संश्लेषण में व्यापक रूप से उपयोग की जाने वाली अभिक्रिया है। ऐसा ही एक दवा का अनुप्रयोग SIB-1508Y के संश्लेषण में है, जिसे आमतौर पर अल्टिनिकलाइन के रूप में जाना जाता है। अल्टिनिकलाइन एक निकोटिनिक एसिटाइलकोलाइन रिसेप्टर एगोनिस्ट है जिसने पार्किंसंस रोग, अल्जाइमर रोग, टॉरेट सिंड्रोम, सिज़ोफ्रेनिया और अटेंशन डेफिसिट हाइपरएक्टिविटी डिसऑर्डर (ADHD) के उपचार में सशक्त पाया गया है।[3][50] 2008 तक, अल्टिनिकलाइन द्वितीय चरण के क्लिनिकल परीक्षण से गुजरे हैं।।[51][52]

सोनोगाशिरा क्रॉस युग्मन अभिक्रिया का उपयोग इमिडाज़ोपिरिडीन व्युत्पन्न के संश्लेषण में किया जा सकता है।[53]

संबंधित अभिक्रियाएं
- युग्मन अभिक्रिया|क्रॉस-युग्मन अभिक्रिया
- ट्रांसमेटलेशन
इस पृष्ठ में अनुपलब्ध आंतरिक कड़ियों की सूची
- ताँबा
- Tazarotene
- दर को सीमित करने वाला कदम
- ग्लेसर युग्मन
- फॉस्फीन लिगेंड
- पूर्व उत्प्रेरक
- साइट पर
- अक्रिय गैस
- पॉरफाइरिन
- फेनिलएसिटिलीन
- युग्मन अभिक्रिया
- शांत अभिक्रिया
संदर्भ
- ↑ 1.0 1.1 Sonogashira, K. (2002), "Development of Pd-Cu catalyzed cross-coupling of terminal acetylenes with sp2-carbon halides", J. Organomet. Chem., 653 (1–2): 46–49, doi:10.1016/s0022-328x(02)01158-0
- ↑ King, A.O.; Yasuda, N. (2005), "A Practical and Efficient Process for the Preparation of Tazarotene", Org. Process Res. Dev., 9 (5): 646–650, doi:10.1021/op050080x
- ↑ 3.0 3.1 3.2 King, A. O.; Yasuda, N. (2004), Palladium-Catalyzed Cross-Coupling Reactions in the Synthesis of Pharmaceuticals Organometallics in Process Chemistry, Top. Organomet. Chem., vol. 6, pp. 205–245, doi:10.1007/b94551, ISBN 978-3-540-01603-8
- ↑ Dieck, H.A.; Heck, R.F. (1975), "Palladium catalyzed synthesis of aryl, heterocyclic and vinylic acetylene derivatives", J. Organomet. Chem., 93 (2): 259–263, doi:10.1016/S0022-328X(00)94049-X
- ↑ 5.0 5.1 Sonogashira, K.; Tohda, Y.; Hagihara, N. (1975), "A convenient synthesis of acetylenes: catalytic substitutions of acetylenic hydrogen with bromoalkenes, iodoarenes and bromopyridines", Tetrahedron Lett., 16 (50): 4467–4470, doi:10.1016/s0040-4039(00)91094-3
- ↑ Cassar, L. (1975), "Synthesis of aryl- and vinyl-substituted acetylene derivatives by the use of nickel and palladium complexes", J. Organomet. Chem., 93 (2): 253–257, doi:10.1016/S0022-328X(00)94048-8
- ↑ 7.0 7.1 7.2 7.3 7.4 7.5 7.6 Chinchilla, R.; Nájera, C. (2011), "Recent advances in Sonogashira reactions", Chem. Soc. Rev., 40 (10): 5084–5121, doi:10.1039/c1cs15071e, PMID 21655588
- ↑ Seechurn, C. C. C.; Kitching, M. O.; Colacot, T. J.; Snieckus, V. (2012), "Palladium-Catalyzed Cross-Coupling: A Historical Contextual Perspective to the 2010 Nobel Prize", Angew. Chem. Int. Ed., 51 (21): 5062–5085, doi:10.1002/anie.201107017, PMID 22573393
- ↑ 9.0 9.1 9.2 9.3 9.4 9.5 9.6 9.7 Chinchilla, R.; Nájera, C. (2007), "The Sonogashira Reaction: A Booming Methodology in Synthetic Organic Chemistry", Chem. Rev., 107 (3): 874–922, doi:10.1021/cr050992x, PMID 17305399
- ↑ Stambuli, J. P.; Buhl, M.; Hartwig, J. F. (2002), "Synthesis, Characterization, and Reactivity of Monomeric, Arylpalladium Halide Complexes with a Hindered Phosphine as the Only Dative Ligand", J. Am. Chem. Soc., 124 (32): 9346–9347, doi:10.1021/ja0264394, PMID 12167009
- ↑ Amatore, C.; Jutand, A. (2000), "Anionic Pd(0) and Pd(II) Intermediates in Palladium-Catalyzed Heck and Cross-Coupling Reactions", Acc. Chem. Res., 33 (5): 314–321, CiteSeerX 10.1.1.612.7347, doi:10.1021/ar980063a, PMID 10813876
- ↑ Soheili, A.; Albaneze-Walker, J.; Murry, J. A.; Dormer, P. G.; Hughes, D. L. (2003), "Efficient and General Protocol for the Copper-Free Sonogashira Coupling of Aryl Bromides at Room Temp", Org. Lett., 5 (22): 4191–4194, doi:10.1021/ol035632f, PMID 14572282
- ↑ 13.0 13.1 13.2 13.3 Gazvoda, M.; Virant, M.; Pinter, B.; Košmrlj, J. (2018). "तांबा मुक्त सोनोगाशिरा प्रतिक्रिया का तंत्र पैलेडियम-पैलेडियम ट्रांसमेटेलेशन के माध्यम से संचालित होता है". Nat. Commun. 9 (1): 4814. Bibcode:2018NatCo...9.4814G. doi:10.1038/s41467-018-07081-5. PMC 6240041. PMID 30446654.
- ↑ 14.0 14.1 14.2 14.3 Virant, Miha (2019). टर्मिनल एसिटिलीन के चयनित परिवर्तनों के लिए सजातीय पैलेडियम उत्प्रेरक प्रणालियों का विकास (PhD). University of Ljubljana.
- ↑ Tougerti, A.; Negri, S.; Jutand, A. (2007), "Mechanism of the Copper-Free Palladium-Catalyzed Sonogashira Reactions: Multiple Role of Amines", Chem. Eur. J., 13 (2): 666–676, doi:10.1002/chem.200600574, PMID 16991183
- ↑ Plenio, H. (2008), "Catalysts for the Sonogashira Coupling—The Crownless Again Shall Be King", Angew. Chem. Int. Ed., 47 (37): 6954–6956, doi:10.1002/anie.200802270, PMID 18683173
- ↑ Kohnen, A. L; Danheiser, R. L.; Denmark S. E.; Liu X. (2007), "Synthesis of Terminal 1,3-Diynes Via Sonogashira Coupling of Vinylidene Chloride Followed by Elimination. Preparation of 1,3-Decadiyne", Org. Synth., 84: 77–87, doi:10.15227/orgsyn.084.0077, PMC 2901882, PMID 20628544
- ↑ Al-Zoubi, Raed (16 April 2020). "पैलेडियम-उत्प्रेरित अत्यधिक रीजियोसेलेक्टिव मोनो और डबल सोनोगाशिरा क्रॉस-कपलिंग प्रतिक्रियाएं 5-प्रतिस्थापित-1,2,3-ट्राईआयोडोबेंजीन परिवेश स्थितियों के तहत†". RSC Adv. 10 (28): 16376. Bibcode:2020RSCAd..1016366A. doi:10.1039/d0ra01569e.
- ↑ 19.0 19.1 Bohm, V. P. W.; Herrmann, W. A. (2000), "A Copper-Free Procedure for the Palladium-Catalyzed Sonogashira Reaction of Aryl Bromides with Terminal Alkynes at Room Temperature", Eur. J. Org. Chem., 200 (22): 3679–3681, doi:10.1002/1099-0690(200011)2000:22<3679::aid-ejoc3679>3.0.co;2-x
- ↑ Yin, L.; Liebscher, J. (2006), "Carbon-Carbon Coupling Reactions Catalyzed by Heterogeneous Palladium Catalysts", Chem. Rev., 107 (1): 133–173, doi:10.1021/cr0505674, PMID 17212474
- ↑ Panda B., Sarkar T. K. (2010). "सोना और पैलेडियम एरेनेडियाज़ोनियम लवण के सोनोगाशिरा-प्रकार के क्रॉस-युग्मन के लिए संयुक्त". Chem. Commun. 46 (18): 3131–3133. doi:10.1039/c001277g. PMID 20361097.
- ↑ Jutand, A.; Négri, S.; Principaud; A. (2005), "Formation of ArPdXL(amine) Complexes by Substitution of One Phosphane Ligand by an Amine in trans-ArPdX(PPh3)2 Complexes", Eur. J. Inorg. Chem., 2005 (4): 631–635, doi:10.1002/ejic.200400413
- ↑ Mery, D.; Heuze, K.; Astruc, D. (2003), "A very efficient, copper-free palladium catalyst for the Sonogashira reaction with aryl halides", Chem. Commun., 15 (15): 1934–1935, doi:10.1039/B305391C, PMID 12932040
- ↑ Dudnik, A.; Gevorgyan, V. (2010). "औपचारिक व्युत्क्रम सोनोगाशिरा प्रतिक्रिया: एल्काइनल हैलाइड्स के साथ एरेन्स और हेटेरोसायकल का प्रत्यक्ष अल्काइनाइलेशन". Angew. Chem. Int. Ed. 49 (12): 2096–2098. doi:10.1002/anie.200906755. PMC 3132814. PMID 20191647.
- ↑ Vechorkin, O.; Barmaz, D.; Proust, V.; Hu, X. (2009), "Ni-Catalyzed Sonogashira Coupling of Nonactivated Alkyl Halides: Orthogonal Functionalization of Alkyl Iodides, Bromides, and Chlorides", J. Am. Chem. Soc., 131 (34): 12078–12079, doi:10.1021/ja906040t, PMID 19670863
- ↑ Gonzalez-Arallano, C.; Abad, A.; Corma, A.; Garcia, H.; Iglesias, M.; Sanchez, F. (2007), "Catalysis by Gold(I) and Gold(III): A Parallelism between Homo- and Heterogeneous Catalysts for Copper-Free Sonogashira Cross-Coupling Reactions", Angew. Chem. Int. Ed., 46 (9): 1536–1538, doi:10.1002/anie.200604746, PMID 17226890
- ↑ 27.0 27.1 Corma, A.; Juarez, R.; Boronat, M.; Sanchez, F.; Iglesias, M.; Garcia, H. (2011), "Gold catalyzes the Sonogashira coupling reaction without the requirement of palladium impurities", Chem. Commun., 47 (5): 1446–1448, doi:10.1039/C0CC04564K, PMID 21183985
- ↑ 28.0 28.1 Beaumont, S. K.; Kyriakou, G.; Lambert, R. M. (2010), "Identity of the active site in gold nanoparticle-catalyzed Sonogashira coupling of phenylacetylene and iodobenzene." (PDF), J. Am. Chem. Soc., 132 (35): 12246–12248, doi:10.1021/ja1063179, PMID 20715838
- ↑ Kyriakou, G.; Beaumont, S. K.; Humphrey, S. M.; Antonetti, C.; Lambert, R. M. (2010), "Sonogashira Coupling Catalyzed by Gold Nanoparticles: Does Homogeneous or Heterogeneous Catalysis Dominate?", ChemCatChem, 2 (11): 1444–1449, doi:10.1002/cctc.201000154, S2CID 96700925
- ↑ 30.0 30.1 M. Carril; A. Correa; C. Bolm (2008), "Iron-Catalyzed Sonogashira Reaction", Angew. Chem., 120 (26): 4940–4943, Bibcode:2008AngCh.120.4940C, doi:10.1002/ange.200801539
- ↑ Thorsten Lauterbach; Madeleine Livendahl; Antonio Rosellon; Pablo Espinet; Antonio M. Echavarren (2010), "Unlikeliness of Pd-Free Gold(I)-Catalyzed Sonogashira Coupling Reactions", Org. Lett., 12 (13): 3006–3009, doi:10.1021/ol101012n, PMID 20515017
- ↑ Tolnai, L. G.; Gonda, ZS.; Novák, Z. (2010). ""कॉपर-उत्प्रेरित" सोनोगाशिरा युग्मन पर पैलेडियम के पीपीबी स्तरों का नाटकीय प्रभाव". Chem. Eur. J. 16 (39): 11822–11826. doi:10.1002/chem.201001880. PMID 20821769.
- ↑ Panda, B.; Sarkar, T. K. (2013), "Gold and Palladium Combined for the Sonogashira Coupling of Aryl and Heteroaryl Halides", Synthesis, 45 (6): 817–829, doi:10.1055/s-0032-1318119
- ↑ Astruc, Didier; Heuzé, Karine; Gatard, Sylvain; Méry, Denise; Nlate, Sylvain; Plault, Lauriane (February 2005). "रेडॉक्स और कार्बन-कार्बन बॉन्ड फॉर्मेशन रिएक्शन के लिए मेटलोडेंड्रिटिक कटैलिसीस: ग्रीन केमिस्ट्री की ओर एक कदम।". Adv. Synth. Catal. 347 (2–3): 329–338. doi:10.1002/adsc.200404247.
- ↑ Heuzé, Karine; Méry, Denise; Gauss, Dominik; Astruc, Didier (2003). "सोनोगाशिरा प्रतिक्रिया के लिए कॉपर-फ्री, रिकवर करने योग्य डेंड्रिटिक पीडी उत्प्रेरक". Chem. Commun. (18): 2274–2275. doi:10.1039/B307116M. PMID 14518871.
- ↑ Yang, Yun-Chin; Luh, Tien-Yau (December 2003). "नॉरबोर्निन डेरिवेटिव के रिंग-ओपनिंग मेटाथिसिस पॉलीमराइजेशन से पॉलिमरिक फॉस्फीन लिगैंड। हेक, सोनोगाशिरा और नेगीशी प्रतिक्रियाओं में आवेदन" (PDF). J. Org. Chem. 68 (25): 9870–9873. doi:10.1021/jo035318z. PMID 14656129.
- ↑ Buchmeiser, Michael R.; Schareina, Thomas; Kempe, Rhett; Wurst, Klaus (2001). "बीआईएस (पाइरीमिडीन) आधारित पैलेडियम उत्प्रेरक: संश्लेषण, एक्स-रे संरचना और हेक-, सुजुकी-, सोनोगाशिरा-हगिहारा युग्मन और संशोधन प्रतिक्रियाओं में अनुप्रयोग". J. Organomet. Chem. 634: 39–46. doi:10.1016/S0022-328X(01)01083-X.
- ↑ Gil-Moltó, J.; Karström, S.; Nájera, C. (2005), "Di(2-pyridyl)methylamine–palladium dichloride complex covalently anchored to a styrene-maleic anhydride co-polymer as recoverable catalyst for C–C cross-coupling reactions in water", Tetrahedron, 61 (51): 12168–12176, doi:10.1016/j.tet.2005.08.122
- ↑ Gil-Moltó, J.; Nájera, C. (2005), "Palladium(II) Chloride and a (Dipyridin-2-ylmethyl)amine-DerivedPalladium(II) Chloride Complex as Highly Efficient Catalysts for the Synthesisof Alkynes in Water or in NMP and of Diynes in the Absence of Reoxidant", Eur. J. Org. Chem., 2005 (19): 4073–4081, doi:10.1002/ejoc.200500319
- ↑ 40.0 40.1 40.2 Gazvoda, M.; Virant, M; Pevec, A.; Urankar, D.; Bolje, A.; Kočevar, M.; Košmrlj, J. (2016), "A mesoionic bis(Py-tzNHC) palladium(II) complex catalyses green Sonogashira reaction through an unprecedented mechanism", Chem. Commun., 52 (8): 1571–1574, doi:10.1039/c5cc08717a, PMID 26575368
- ↑ Crudden, Cathleen M.; Allen, Daryl P. (December 2004). "एन-हेटरोसायक्लिक कार्बाइन परिसरों की स्थिरता और प्रतिक्रियाशीलता". Coord. Chem. Rev. 248 (21–24): 2247–2273. doi:10.1016/j.ccr.2004.05.013.
- ↑ Batey, R. A.; Shen, M.; Lough, A. J. (2002), "Carbamoyl-Substituted N-Heterocyclic Carbene Complexes of Palladium(II): Application to Sonogashira Cross-Coupling Reactions", Org. Lett., 4 (9): 1411–1414, doi:10.1021/ol017245g, PMID 11975591
- ↑ 43.0 43.1 Corona C.; Bryant B.K.; Arterburn J.B. (2006). "पीडी-उत्प्रेरित युग्मन प्रतिक्रियाओं के लिए बायोटिन-व्युत्पन्न एल्केनी का संश्लेषण". Org. Lett. 8 (9): 1883–1886. doi:10.1021/ol060458r. PMC 2523258. PMID 16623575.
- ↑ Tulla-Puche J.; Barany G (2005). "सोनोगाशिरा रसायन का उपयोग करते हुए राल-से-राल स्थानांतरण प्रतिक्रियाओं (आरआरटीआर) का विकास". Tetrahedron. 61 (8): 2195. doi:10.1016/j.tet.2004.12.029.
- ↑ Hong, B.-C.; Nimje, R. Y. (2006). "प्राकृतिक उत्पादों के संश्लेषण में उत्प्रेरक सी-सी बॉन्ड का गठन: वर्ष 2000-2005 से मुख्य विशेषताएं". Curr. Org. Chem. 10 (17): 2191-2225. doi:10.2174/138527206778742605.
- ↑ 46.0 46.1 46.2 Mujahidin, Didin; Doye, Sven (1 July 2005). "(+)-(S)-Laudanosine और (-)-(S)-Xylopinine का Enantioselective संश्लेषण". Eur. J. Org. Chem. 2005 (13): 2689–2693. doi:10.1002/ejoc.200500095.
- ↑ Pedersen, J. M.; Bowman, W. R.; Elsegood, M. R. J.; Fletcher, A. J.; Lovell, P. J (2005). "एलिप्टिसिन का संश्लेषण: एरिल- और हेटेरोरिल-एन्युलेटेड [बी] कार्बाज़ोल्स के लिए एक रेडिकल कैस्केड प्रोटोकॉल". J. Org. Chem. 70 (25): 10615–10618. doi:10.1021/jo0519920. PMID 16323886.
- ↑ Thongsornkleeb, C.; Danheiser, R.L. (2005). "2-आयोडो-प्रोप-2-एनोल का युग्मन एसिटिलीन की एक विस्तृत श्रृंखला जैसे टीएमएसए के साथ एनिनिल अल्कोहल देने के लिए, जिसे संबंधित आर-एल्किनिलेटेड एक्रोलिन्स में ऑक्सीकृत किया जा सकता है". J. Org. Chem. 70 (6): 2364–2367. doi:10.1021/jo047869a. PMC 2897060. PMID 15760233.
- ↑ 49.0 49.1 Shao, L.-X.; Shi, M. (2005), "Facile Synthesis of 2-Alkynyl Buta-1,3-dienes via Sonogashira Cross-Coupling Methodology", J. Org. Chem., 70 (21): 8635–8637, doi:10.1021/jo051434l, PMID 16209628
- ↑ Bleicher, L.S.; Cosford, N.D.P.; Herbaut, A.; McCallum, J. S.; McDonald, I. A. (1998), "A Practical and Efficient Synthesis of the Selective Neuronal Acetylcholine-Gated Ion Channel Agonist (S)-(−)-5-Ethynyl-3-(1-methyl-2-pyrrolidinyl)pyridine Maleate (SIB-1508Y)", J. Org. Chem., 63 (4): 1109–1118, doi:10.1021/jo971572d
- ↑ Wang, David X.; Booth, Heather; Lerner-Marmarosh, Nicole; Osdene, Thomas S.; Abood, Leo G. (1 September 1998). "[3H] निकोटीन बाइंडिंग और साइकोट्रोपिक पोटेंसी के लिए प्रतिस्पर्धा की तुलना करने वाले निकोटीन एनालॉग्स के लिए संरचना-गतिविधि संबंध". Drug Dev. Res. 45 (1): 10–16. doi:10.1002/(SICI)1098-2299(199809)45:1<10::AID-DDR2>3.0.CO;2-G.
- ↑ Parkinson Study, Group (14 February 2006). "पार्किंसंस रोग में निकोटिनिक एगोनिस्ट SIB-1508Y का यादृच्छिक प्लेसबो-नियंत्रित अध्ययन". Neurology. 66 (3): 408–410. doi:10.1212/01.wnl.0000196466.99381.5c. PMID 16476941. S2CID 31720763.
- ↑ 53.0 53.1 Bakherad, M.; Nasr-Isfahani, H.; Keivanloo, A.; Doostmohammadi, N. (2008), "Pd–Cu catalyzed heterocyclization during Sonogashira coupling: synthesis of 2-benzylimidazo[1,2-a]pyridine", J. Organomet. Chem., 49 (23): 3819–3822, doi:10.1016/j.tetlet.2008.03.141
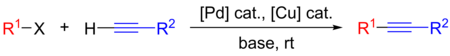
![Mechanism for the Cu-free Sonogashira reaction.[13][14]](https://upload.wikimedia.org/wikipedia/commons/thumb/9/90/Cu-free-mechanism.png/642px-Cu-free-mechanism.png)