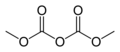
कार्बोनेट एस्टर
कार्बनिक रसायन विज्ञान में, एक कार्बोनेट एस्टर (कार्बनिक कार्बोनेट या ऑर्गोकार्बोनेट) कार्बोनिक अम्ल का एक एस्टर है। इस प्रकार्यात्मक समूह में एक कार्बोनिल समूह होता है , जो दो एल्कोक्सी समूहों से घिरा होता है। इन कार्बोनेट की सामान्य संरचना R−O−C(=O)−O−R' है और वे एस्टर (R−O−C(=O)−R'), ईथर (R−O−R') से संबंधित हैं। ) और [अकार्बनिक कार्बोनेट] के लिए भी।
पॉली कार्बोनेट के एकलक (जैसे मकरोलन या लेक्सन) कार्बोनेट समूहों द्वारा जुड़े हुए हैं। इन पॉली कार्बोनेट का उपयोग चश्मे के लेंस, कॉम्पैक्ट डिस्क और बुलेटप्रूफ ग्लास में किया जाता है। डाइमिथाइल कार्बोनेट, एथिलीन कार्बोनेट, प्रोपिलीन कार्बोनेट जैसे छोटे कार्बोनेट एस्टर का उपयोग सॉल्वैंट्स के रूप में किया जाता है, डाइमिथाइल कार्बोनेट भी एक हल्का मिथाइलेटिंग एजेंट है।
संरचनाएं

कार्बोनेट एस्टर में प्लानर OC(OC)2 कोर होते है, जो कठोरता प्रदान करते है। अनोखा O=C बंध छोटा है (चित्रित उदाहरण में 1.173 Å), जबकि C-O बंध अधिक ईथर की तरह हैं (चित्रित उदाहरण के लिए 1.326 Å की बंध दूरी)।[1]
कार्बोनेट एस्टर को तीन संरचनात्मक वर्गों में विभाजित किया जा सकता है: चक्रीय, चक्रीय और बहुलक। पहला और सामान्य मामला विश्वकोश कार्बोनेट समूह है। कार्बनिक पदार्थ समान हो सकते हैं या नहीं। दोनों स्निग्ध या सुगंधित पदार्थ ज्ञात हैं, उन्हें क्रमशः डायलकिल या डायरिल कार्बोनेट कहा जाता है। इन वर्गों के सबसे सरल सदस्य डाइमिथाइल कार्बोनेट और डाइफेनिल कार्बोनेट हैं।
वैकल्पिक रूप से, कार्बोनेट समूहों को 2- या 3- कार्बन ब्रिज से जोड़ा जा सकता है, जिससे एथिलीन कार्बोनेट और ट्राइमेथिलीन कार्बोनेट जैसे चक्रीय यौगिक बनते हैं। ब्रिजिंग कंपाउंड में पदार्थ भी हो सकते हैं, उदा। चौधरी3 प्रोपिलीन कार्बोनेट के लिए CH3। टर्मिनल एल्काइल या एरील समूहों के बजाय, दो कार्बोनेट समूहों को एक स्निग्ध या सुगंधित द्विसंयोजक समूह द्वारा जोड़ा जा सकता है।
कार्बोनेट का एक तीसरा परिवार बहुलक है, जैसे पॉली (पाली (प्रोपिलीन कार्बोनेट)) और पॉली (पाली (बिस्फेनॉल ए कार्बोनेट)) (जैसे मकरोलन या लेक्सन)।
तैयारी
अकार्बनिक कार्बोनेट लवणों से कार्बनिक कार्बोनेट तैयार नहीं किए जाते हैं। कार्बोनेट एस्टर के लिए दो मुख्य मार्गों का अभ्यास किया जाता है: एक विषैली गैस (फॉस्जेनेशन) के साथ एल्कोहल (या फिनोल) की प्रतिक्रिया, और कार्बन मोनोआक्साइड और एक ऑक्सीकारक (ऑक्सीकरण कार्बोनाइलीकरण) के साथ एल्कोहल की प्रतिक्रिया। अन्य कार्बोनेट एस्टर बाद में ट्रान्सएस्टरीफिकेशन द्वारा तैयार किए जा सकते हैं।[2][3] सिद्धांत रूप में कार्बोनेट एस्टर मेथनॉल और कार्बन डाईऑक्साइड के सीधे संघनन द्वारा तैयार किए जा सकते हैं। प्रतिक्रिया यद्यपि थर्मोडायनामिक रूप से प्रतिकूल है।[4] प्रतिक्रिया मिश्रण से पानी को अलग करने और उपज बढ़ाने के लिए एक चयनात्मक झिल्ली का उपयोग किया जा सकता है।[5][6][7][8]
Dimethyl dicarbonate, a preservative
Ethylene carbonate, a cyclic carbonate ester
Trimethylene carbonate, another cyclic carbonate ester
Poly(bisphenol A carbonate), a commercially important plastic (Lexan)
फॉसजेनेशन
एल्कोहल निम्नलिखित प्रतिक्रिया के अनुसार कार्बोनेट एस्टर उत्पन्न करने के लिए फॉस्जीन के साथ प्रतिक्रिया करता है:
- 2 ROH + COCl2 → ROC(O)OR + 2 HCL
फेनॉल्स इसी तरह प्रतिक्रिया करते हैं। बिस्फेनोल ए से प्राप्त पॉलीकार्बोनेट इस तरीके से तैयार किया जाता है। यह प्रक्रिया उच्च उपज देने वाली है। यद्यपि, जहरीले फॉस्जीन का उपयोग किया जाता है, और हाइड्रोजन क्लोराइड को बेअसर करने के लिए आधार (जैसे पाइरीडीन) की स्टोइकोमेट्रिक मात्रा की आवश्यकता होती है ,जो सह-निर्मित होती है।[2][3]इस प्रक्रिया में क्लोरोफॉर्मेट एस्टर मध्यवर्ती होते हैं। अतिरिक्त एल्कोहल के साथ प्रतिक्रिया करने के बजाय, वे वांछित कार्बोनेट डायस्टर्स और फॉस्जीन के एक समकक्ष देने के लिए अनुपातहीन हो सकते हैं: [3]
- PhOH + COCl2 → PhOC(O)Cl + HCl
- 2 PhOC(O)Cl → PhOC(O)OPh + COCl2
समग्र प्रतिक्रिया है:
- 2 PhOH + COCl2 → PhOC(O)OPh + 2 HCl
ऑक्सीकरण कार्बोनाइलीकरण
ऑक्सीकरण कार्बोनाइलीकरण फॉस्जेनेशन का एक विकल्प है। जिसका लाभ फॉस्जीन से बचाव है। कॉपर उत्प्रेरक का उपयोग करके डाइमिथाइलकार्बोनेट को इस प्रकार तैयार किया जाता है:[3][9]
- 2 MeOH + CO + 1/2 O2 →MeOC(O)OMe + H2O
डाइफेनिल कार्बोनेट भी इसी प्रकार तैयार किया जाता है, परंतु पैलेडियम उत्प्रेरक का उपयोग करते हुए। Pd-उत्प्रेरित प्रक्रिया को Pd(0) को Pd(II) में पुन: परिवर्तित करने के लिए एक उत्प्रेरक की आवश्यकता होती है। मैंगनीज (III) एसिटाइलएसीटोनेट का व्यावसायिक रूप से उपयोग किया गया है।[10]
एपॉक्साइड्स के साथ कार्बन डाइऑक्साइड की प्रतिक्रिया
एपॉक्साइड के साथ कार्बन डाइऑक्साइड की प्रतिक्रिया चक्रीय 5-सदस्यीय कार्बोनेट की तैयारी के लिए एक सामान्य मार्ग है। 2010 में चक्रीय कार्बोनेट का वार्षिक उत्पादन 100,000 टन प्रति वर्ष अनुमानित था।[11] औद्योगिक रूप से, एथिलीन और प्रोपिलीन ऑक्साइड एथिलीन और प्रोपिलीन कार्बोनेट (एक उपयुक्त उत्प्रेरक के साथ) देने के लिए कार्बन डाइऑक्साइड के साथ आसानी से प्रतिक्रिया करते हैं।[2][3]उदाहरण के लिए:
- C2H4O + CO2 → C2H4O2CO
कार्बोनेट ट्रांसएस्टरीफिकेशन
कार्बोनेट एस्टर को ट्रांसएस्टरीफिकेशन द्वारा अन्य कार्बोनेट में परिवर्तित किया जा सकता है। अधिक न्यूक्लियोफिलिक एल्कोहल कम न्यूक्लियोफिलिक एल्कोहल को विस्थापित करेगा। दूसरे शब्दों में, स्निग्ध ऐल्कोहॉल एरील कार्बोनेट से फ़ीनॉल को विस्थापित कर देगा। यदि प्रवाहित शराब अधिक अस्थिर है, तो उस बंद को आसवित करके संतुलन को संचालित किया जा सकता है।[2][3]
यूरिया से अल्कोहल के साथ
यूरिया के साथ मेथनॉल की प्रतिक्रिया से डाइमिथाइल कार्बोनेट बनाया जा सकता है। उत्पादित अमोनिया को पुनर्नवीनीकरण किया जा सकता है। प्रभावी रूप से अमोनिया डाइमिथाइल कार्बोनेट के संश्लेषण के लिए उत्प्रेरक के रूप में कार्य करता है। उपोत्पाद मिथाइल- और एन-मिथाइलकार्बामेट हैं (बाद में डाइमिथाइल कार्बोनेट और मिथाइल कार्बामेट के बीच प्रतिक्रिया से)। यह प्रक्रिया किफायती नहीं है।[12]
प्रतिक्रियाएं
कार्बोनेट एस्टर पारंपरिक कार्बोक्जिलिक एसिड एस्टर की कई प्रतिक्रियाओं से गुजरते हैं। ग्रिग्नार्ड अभिकर्मकों के साथ कार्बोनेट एस्टर तृतीयक अल्कोहल देने के लिए प्रतिक्रिया करते हैं। कुछ चक्रीय कार्बोनेट पोलीमराइजेशन के लिए अतिसंवेदनशील होते हैं।
उपयोग करता है
लिथियम बैटरी में विलायक के रूप में कार्बनिक कार्बोनेट का उपयोग किया जाता है। उनकी उच्च ध्रुवीयता के कारण, वे लिथियम लवण को भंग कर देते हैं। डाइमिथाइल कार्बोनेट, डायथाइल कार्बोनेट और डाइमेथॉक्सीथेन के उदाहरण के लिए मिश्रण का उपयोग करके उच्च चिपचिपाहट की समस्या को दूर किया जाता है।
उनका उपयोग कार्बनिक संश्लेषण में सॉल्वैंट्स के रूप में भी किया जाता है।[13] रासायनिक ध्रुवीयता के रूप में वर्गीकृत, उनके पास एक विस्तृत तरल तापमान सीमा होती है। एक उदाहरण प्रोपलीन कार्बोनेट है जिसका गलनांक -55 डिग्री सेल्सियस और क्वथनांक 240 डिग्री सेल्सियस होता है। अन्य लाभ कम पारिस्थितिक विषाक्तता और अच्छी biodegradability हैं। कार्बोनेट के लिए कई औद्योगिक उत्पादन मार्ग हरे नहीं हैं क्योंकि वे फॉस्जीन या प्रोपलीन ऑक्साइड पर निर्भर हैं।[14] डाइमिथाइल डाइकार्बोनेट का उपयोग आमतौर पर पेय परिरक्षक, प्रसंस्करण सहायता, या नसबंदी (सूक्ष्म जीव विज्ञान) # रासायनिक नसबंदी के रूप में किया जाता है।[15]
संदर्भ
- ↑ 1.0 1.1 Perez, Serge; Scaringe, Raymond P. (1987). "Crystalline features of 4,4'-isopropylidenediphenylbis(phenyl carbonate) and conformational analysis of the polycarbonate of 2,2-bis(4-hydroxyphenyl)propane". Macromolecules. 20 (1): 68–77. Bibcode:1987MaMol..20...68P. doi:10.1021/ma00167a014.
- ↑ 2.0 2.1 2.2 2.3 Shaikh, Abbas-Alli G.; Swaminathan Sivaram (1996). "Organic Carbonates". Chemical Reviews. 96 (3): 951–976. doi:10.1021/cr950067i. PMID 11848777.
- ↑ 3.0 3.1 3.2 3.3 3.4 3.5 Buysch, Hans-Josef (2012). "Carbonic Esters". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a05_197.
- ↑ Zhang, Zhi-Fang (2011). "Synthesis of Dimethyl Carbonate from Carbon Dioxide and Methanol over CexZr1-xO2and [EMIM]Br/Ce0.5Zr0.5O2". Industrial & Engineering Chemistry Research. 50 (4): 1981–1988. doi:10.1021/ie102017j.
- ↑ Li, Chuan-Feng (2003). "Study on application of membrane reactor in direct synthesis DMC from CO2 and CH3OH over Cu–KF/MgSiO catalyst". Catalysis Today. 82 (1–4): 83–90. doi:10.1016/S0920-5861(03)00205-0.
- ↑ Vermerris, René. Membrane enhanced conversion of methanol and carbon dioxide into dimethyl carbonate (PDF) (Report). Archived (PDF) from the original on 2013-10-05.
- ↑ Aouissi, Ahmed; Al-Othman, Zeid Abdullah; Al-Amro, Amro (2010). "Gas-Phase Synthesis of Dimethyl Carbonate from Methanol and Carbon Dioxide over Co1.5PW12O40 Keggin-Type Heteropolyanion". International Journal of Molecular Sciences. 11 (4): 1343–1351. doi:10.3390/ijms11041343. PMC 2871119. PMID 20480023.
- ↑ Bian, Jun (2009). "Highly effective synthesis of dimethyl carbonate from methanol and carbon dioxide using a novel copper–nickel/graphite bimetallic nanocomposite catalyst". Chemical Engineering Journal. 147 (2–3): 287–296. doi:10.1016/j.cej.2008.11.006.
- ↑ Shaikh, Abbas-Alli G.; Sivaram, Swaminathan (1996-01-01). "Organic Carbonates". Chemical Reviews. 96 (3): 951–976. doi:10.1021/cr950067i. ISSN 0009-2665. PMID 11848777.
- ↑ Grigorii L. Soloveichik1 (2016). "Oxidative Carbonylation: Diphenyl Carbonate". In Shannon S. Stahl; Paul L. Alsters (eds.). Liquid Phase Aerobic Oxidation Catalysis: Industrial Applications and Academic Perspectives. Title Liquid Phase Aerobic Oxidation Catalysis: Industrial Applications and Academic Perspectives: Industrial Applications and Academic Perspectives. Wiley-VCH. pp. 189–208. doi:10.1002/9783527690121.ch12. ISBN 9783527337811.
- ↑ North, Michael; Pasquale, Riccardo; Young, Carl (2010). "Synthesis of cyclic carbonates from epoxides and CO2". Green Chem. 12 (9): 1514. doi:10.1039/c0gc00065e.
- ↑ "Archived copy" (PDF). Archived from the original (PDF) on 2013-10-05. Retrieved 2013-10-04.
{{cite web}}: CS1 maint: archived copy as title (link) - ↑ Schäffner, B.; Schäffner, F.; Verevkin, S. P.; Börner, A. (2010). "Organic Carbonates as Solvents in Synthesis and Catalysis". Chemical Reviews. 110 (8): 4554–4581. doi:10.1021/cr900393d. PMID 20345182.
- ↑ Sibiya, Mike Sbonelo (19 May 2008). Catalytic transformation of propylene carbonate into dimethyl carbonate and propylene glycol (Master of Science in Chemistry thesis). University of Johannesburg. Archived from the original on 2020-08-18. Retrieved 2022-04-12.
- ↑ Uhr, Hermann; Mielke, Burkhard; Exner, Otto; Payne, Ken R.; Hill, Edward (2013). "Biocides". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. pp. 1–26. doi:10.1002/14356007.a16_563.pub2.