विलेयता साम्य
घुलनशीलता संतुलन ऐसा गतिशील संतुलन है जो तब उपस्थित होता है जब ठोस अवस्था में रासायनिक यौगिक उस यौगिक के समाधान के साथ रासायनिक संतुलन में होता है। पृथक्करण के साथ, या समाधान के किसी अन्य घटक जैसे अम्ल या क्षार की रासायनिक प्रतिक्रिया के साथ ठोस अपरिवर्तित हो सकता है। प्रत्येक घुलनशीलता संतुलन को तापमान-निर्भर घुलनशीलता उत्पाद द्वारा चित्रित किया जाता है जो संतुलन स्थिरांक की तरह कार्य करता है। घुलनशीलता संतुलन दवा, पर्यावरण और अन्य परिदृश्यों में महत्वपूर्ण हैं।
परिभाषाएँ
घुलनशीलता संतुलन तब उपस्थित होता है जब ठोस अवस्था में रासायनिक यौगिक, यौगिक युक्त समाधान के साथ रासायनिक संतुलन में होता है। इस प्रकार का संतुलन गतिशील संतुलन का उदाहरण है जिसमें कुछ भिन्न -भिन्न अणु ठोस और समाधान चरणों के मध्य माइग्रेट करते हैं जैसे कि विघटन (रसायन विज्ञान) और वर्षा की दर एक दूसरे के समान होती है। जब संतुलन स्थापित हो जाता है और ठोस प्रत्येक प्रकार से भंग नहीं होता है, तो समाधान को संतृप्त कहा जाता है। संतृप्त विलयन में विलेय की सांद्रता को विलेयता के रूप में जाना जाता है। विलेयता की इकाइयां मोलर (mol dm-3) हो सकती हैं या द्रव्यमान प्रति इकाई आयतन के रूप में व्यक्त किया जाता है, जैसे μg mL-1, घुलनशीलता तापमान पर निर्भर है। घुलनशीलता की तुलना में विलेय की उच्च सांद्रता वाले विलयन को अतिसंतृप्ति कहा जाता है। अतिसंतृप्ति घोल को बीज के अतिरिक्त संतुलन में आने के लिए प्रेरित किया जा सकता है जो विलेय का छोटा क्रिस्टल या छोटा ठोस कण हो सकता है, जो वर्षा प्रारंभ करता है।
घुलनशीलता संतुलन के तीन मुख्य प्रकार हैं।
- सरल विघटन।
- पृथक्करण प्रतिक्रिया के साथ विघटन। यह लवण की विशेषता है। इस स्थिति में संतुलन स्थिरांक को घुलनशीलता उत्पाद के रूप में जाना जाता है।
- आयनीकरण प्रतिक्रिया के साथ विघटन। यह भिन्न -भिन्न पीएच के जलीय मीडिया में तनु अम्ल या तनु आधारों के विघटन की विशेषता है।
प्रत्येक स्थिति में संतुलन स्थिरांक को गतिविधियों के भागफल के रूप में निर्दिष्ट किया जा सकता है। यह संतुलन स्थिरांक विमाहीन है क्योंकि गतिविधि विमाहीन मात्रा है। चूँकि, गतिविधियों का उपयोग अधिक असुविधाजनक है, इसलिए संतुलन स्थिरांक को सामान्यतः गतिविधि गुणांक के भागफल से विभाजित किया जाता है, जिससे कि सांद्रता का भागफल बन सके। विवरण के लिए इक्विलिब्रियम केमिस्ट्री इक्विलिब्रियम स्थिरांक देखें। इसके अतिरिक्त, ठोस की गतिविधि, परिभाषा के अनुसार, 1 के समान होती है, इसलिए इसे परिभाषित अभिव्यक्ति से विस्थापित कर दिया जाता है।
रासायनिक संतुलन के लिए
परिस्थितियों का प्रभाव
तापमान प्रभाव
घुलनशीलता तापमान में परिवर्तन के प्रति संवेदनशील है। उदाहरण के लिए, चीनी ठंडे पानी की तुलना में गर्म पानी में अधिक घुलनशील होती है। ऐसा इसलिए होता है क्योंकि घुलनशीलता उत्पाद, जैसे अन्य प्रकार के संतुलन स्थिरांक, तापमान के कार्य होते हैं। ले चेटेलियर के सिद्धांत के अनुसार, जब विघटन प्रक्रिया एंडोथर्मिक प्रतिक्रिया (गर्मी अवशोषित होती है) होती है, तो बढ़ते तापमान के साथ घुलनशीलता बढ़ जाती है। यह प्रभाव पुनर्संरचना की प्रक्रिया का आधार है, जिसका उपयोग रासायनिक यौगिक को शुद्ध करने के लिए किया जा सकता है। जब विघटनएक्ज़ोथिर्मिक होता है (गर्मी निरंतर होती है) बढ़ते तापमान के साथ घुलनशीलता अल्प हो जाती है।[1] सोडियम सल्फेट लगभग 32.4 °C से नीचे के तापमान के साथ बढ़ती घुलनशीलता, किन्तु उच्च तापमान पर घटती घुलनशीलता दिखाता है।[2] ऐसा इसलिए है क्योंकि ठोस चरण डिकाहाइड्रेट है (Na
2SO
4·10H
2O) संक्रमण तापमान के नीचे, किन्तु उस तापमान के ऊपर भिन्न हाइड्रेट होते हैं।
आदर्श समाधान (अल्प घुलनशीलता वाले पदार्थों के लिए प्राप्त) के लिए घुलनशीलता के तापमान पर निर्भरता निम्नलिखित अभिव्यक्ति द्वारा दी जाती है जिसमें पिघलने की तापीय धारिता ΔmH, और मोल अंश संतृप्ति पर विलेय का होता है:
अन्य-इलेक्ट्रोलाइट के लिए यह अंतर अभिव्यक्ति तापमान अंतराल पर देने के लिए एकीकृत किया जा सकता है:[4]
सामान्य-आयन प्रभाव
सामान्य-आयन प्रभाव नमक की घटी हुई घुलनशीलता का प्रभाव है, जब अन्य नमक जिसमें आयन होता है, वह भी उपस्थित होता है। उदाहरण के लिए, सिल्वर क्लोराइड, AgCl की घुलनशीलता अल्प हो जाती है, जब सोडियम क्लोराइड, सामान्य आयन क्लोराइड का स्रोत, पानी में AgCl के निलंबन में जोड़ा जाता है।[5]
अब मान लीजिए कि 0.01 mol dm−3 = 0.01 M की सांद्रता पर सोडियम क्लोराइड भी उपस्थित है। सोडियम आयनों के किसी भी संभावित प्रभाव को उपेक्षित करके विलेयता की अब गणना की जाती है:
कण आकार प्रभाव
थर्मोडायनामिक घुलनशीलता स्थिरांक को बड़े मोनोक्रिस्टल के लिए परिभाषित किया गया है। अतिरिक्त सतह ऊर्जा के कारण विलेय कण (या छोटी बूंद) के घटते आकार के साथ विलेयता बढ़ेगी। यह प्रभाव सामान्यतः छोटा होता है जब तक कण अधिक छोटे नहीं हो जाते, सामान्यतः 1 माइक्रोन से छोटे होते हैं। विलेयता स्थिरांक पर कण आकार के प्रभाव को निम्नानुसार परिमाणित किया जा सकता है:
नमक प्रभाव
नमक प्रभाव[7] (में नमकीन बनाना एंड भिन्न कर रहा है) इस तथ्य को संदर्भित करता है कि नमक की उपस्थिति जिसका विलेय के साथ सामान्य आयन प्रभाव होता है, का समाधान की आयनिक शक्ति पर प्रभाव पड़ता है और इसलिए गतिविधि गुणांक पर, जिससे किसंतुलन स्थिरांक व्यक्त किया जा सके एकाग्रता भागफल के रूप में, बदलता है।
चरण प्रभाव
संतुलन को विशिष्ट क्रिस्टल चरण (पदार्थ) के लिए परिभाषित किया गया है। इसलिए, ठोस के चरण के आधार पर घुलनशीलता उत्पाद भिन्न होने की उम्मीद है। उदाहरण के लिए, एंरेगोनाइट और केल्साइट के भिन्न -भिन्न घुलनशीलता उत्पाद होंगे, भले ही उनके पास ही रासायनिक पहचान (कैल्शियम कार्बोनेट) हो। किसी भी परिस्थिति में चरण दूसरे की तुलना में थर्मोडायनामिक रूप से अधिक स्थिर होगा; इसलिए, यह चरण तब बनेगा जब थर्मोडायनामिक संतुलन स्थापित हो जाएगा। चूँकि , काइनेटिक कारक प्रतिकूल अवक्षेपण (जैसे अर्गोनाइट) के गठन का पक्ष ले सकते हैं, जिसे तब मेटास्टेबल अवस्था में कहा जाता है।
फार्माकोलॉजी में, मेटास्टेबल राज्य को कभी-कभी अनाकार राज्य कहा जाता है। क्रिस्टल जाली में निहित लंबी दूरी की बातचीत की अनुपस्थिति के कारण अनाकार दवाओं में उनके क्रिस्टलीय समकक्षों की तुलना में उच्च घुलनशीलता होती है। इस प्रकार, अनाकार चरण में अणुओं को घोलने में अल्प ऊर्जा लगती है। विलेयता पर अनाकार चरण के विवो सुपरसेटेशन में व्यापक रूप से दवाओं को अधिक घुलनशील बनाने के लिए उपयोग किया जाता है।[8][9]
दबाव प्रभाव
संघनित चरणों (ठोस और तरल पदार्थ) के लिए, घुलनशीलता की दबाव निर्भरता सामान्यतः तनुता होती है और सामान्यतः व्यवहार में उपेक्षित होती है। आदर्श समाधान मानते हुए, निर्भरता को इस प्रकार निर्धारित किया जा सकता है:
घुलनशीलता की दबाव निर्भरता का कभी-कभी व्यावहारिक महत्व होता है। उदाहरण के लिए, कैल्शियम सल्फेट (जो दबाव में अल्पता के साथ इसकी घुलनशीलता को अल्प करता है) द्वारा तेल क्षेत्रों और कुओं के दूषित होने से समय के साथ उत्पादकता में अल्पता आ सकती है।
मात्रात्मक पहलू
सरल विघटन
कार्बनिक ठोस के विघटन को उसके ठोस और घुलित रूपों में पदार्थ के मध्य संतुलन के रूप में वर्णित किया जा सकता है। उदाहरण के लिए, जब सुक्रोज (टेबल शुगर) संतृप्त घोल बनाता है
पृथक्करण के साथ विघटन
आयनिक यौगिक सामान्यतः पानी में घुलने पर उनके घटक आयनों में विघटन (रसायन) होता है। उदाहरण के लिए, सिल्वर क्लोराइड के लिए:
जब नमक की विलेयता बहुत अल्प होती है तो विलयन में आयनों के सक्रियता गुणांक लगभग के समान होते हैं। उन्हें वास्तव में के समान सेट करके यह अभिव्यक्ति घुलनशीलता उत्पाद अभिव्यक्ति को अल्प कर देती है:
- (विद्युत आवेशों को सामान्य भावों में छोड़ दिया जाता है, अंकन की सरलता के लिए)
सीए (ओएच) जैसे असममित नमक के साथ2 विलेयता व्यंजक द्वारा दिया जाता है
Salt p q Solubility, S AgCl
Ca(SO4)
Fe(PO4)1 1 √Ksp Na2(SO4)
Ca(OH)22
11
2Na3(PO4)
FeCl33
11
3Al2(SO4)3
Ca3(PO4)22
33
2Mp(An)q p q
घुलनशीलता उत्पादों को अक्सर लघुगणकीय रूप में व्यक्त किया जाता है। इस प्रकार, कैल्शियम सल्फेट के साथ Ksp = 4.93×10−5 mol2 dm−6, log Ksp = −4.32. K का मान जितना छोटा होगाsp, या लॉग मान जितना अधिक ऋणात्मक होगा, विलेयता उतनी ही अल्प होगी।
कुछ लवण विलयन में पूर्णतः वियोजित नहीं होते हैं। उदाहरणों में सम्मिलित हैं मैग्नीशियम सल्फेट|MgSO4, प्रसिद्ध रूप से मैनफ्रेड ईजेन द्वारा समुद्री जल में आंतरिक क्षेत्र परिसर और आयन संघ दोनों के रूप में उपस्थित होने के लिए खोजा गया।[12] ऐसे लवणों की विलेयता की गणना अभिक्रिया के साथ #विघटन में उल्लिखित विधि द्वारा की जाती है।
हाइड्रॉक्साइड्स
धातु आयन, एम के हाइड्रॉक्साइड के लिए घुलनशीलता उत्पादn+, सामान्यतः निम्नानुसार परिभाषित किया जाता है:
हाइड्रॉक्साइड्स के लिए, घुलनशीलता उत्पादों को अक्सर संशोधित रूप में दिया जाता है, K*spहाइड्रॉक्साइड आयन सांद्रता के स्थान पर हाइड्रोजन आयन सांद्रता का उपयोग करना। दो मूल्य पानी के स्व-आयनीकरण से संबंधित हैं। पानी के लिए स्व-आयनीकरण स्थिरांक, केw.[13]
प्रतिक्रिया के साथ विघटन
विघटन के साथ विशिष्ट प्रतिक्रिया में तनुता आधार, बी, अम्लीय जलीय घोल में घुलना सम्मिलित है।
अनावेशित अणु में सामान्यतः आयनिक रूप की तुलना में अल्प घुलनशीलता होती है, इसलिए विलेयता pH और विलेय के अम्ल पृथक्करण स्थिरांक पर निर्भर करती है। अम्ल या क्षार की अनुपस्थिति में अआयनित रूप की घुलनशीलता का वर्णन करने के लिए आंतरिक विलेयता शब्द का उपयोग किया जाता है।
अम्ल वर्षा द्वारा चट्टानों और मिट्टी से एल्यूमीनियम लवणों का निक्षालन प्रतिक्रिया के साथ विघटन का और उदाहरण है: alumino-सिलिकेट ऐसे आधार हैं जो अम्ल के साथ प्रतिक्रिया करके घुलनशील प्रजातियों का निर्माण करते हैं, जैसे अल3+(एक्यू).
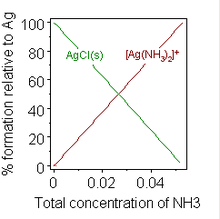
एक रासायनिक परिसर (रसायन विज्ञान) का निर्माण भी विलेयता को बदल सकता है। प्रसिद्ध उदाहरण सिल्वर क्लोराइड के निलंबन के लिए अमोनिया के केंद्रित समाधान को जोड़ना है, जिसमें अमाइन कॉम्प्लेक्स के गठन से विघटन का पक्ष लिया जाता है।
प्रायोगिक निर्धारण
घुलनशीलता का निर्धारण कठिनाइयों से भरा होता है।[6]सबसे प्रथम और महत्वपूर्ण यह स्थापित करने में कठिनाई है कि प्रणाली चयन किए हुए तापमान पर संतुलन में है। ऐसा इसलिए है क्योंकि वर्षा और विघटन प्रतिक्रिया दोनों ही अनंत धीमी हो सकती हैं। यदि प्रक्रिया अधिक धीमी है तो विलायक वाष्पीकरण उद्देश्य हो सकता है। अतिसंतृप्ति हो सकती है। अधिक अघुलनशील पदार्थों के साथ, समाधान में सांद्रता अधिक अल्प होती है और इसे निर्धारित करना कठिन होता है। उपयोग की जाने वाली विधियाँ सामान्यतः दो श्रेणियों स्थिर और गतिशील में आती हैं।
स्थैतिक विधि
स्थैतिक विधियों में मिश्रण को संतुलन में लाया जाता है और रासायनिक विश्लेषण द्वारा समाधान चरण में प्रजाति की एकाग्रता निर्धारित की जाती है। इसके लिए सामान्यतः ठोस और समाधान चरणों को भिन्न करने की आवश्यकता होती है। ऐसा करने के लिए थर्मोस्टेट वाले कक्ष में संतुलन और पृथक्करण किया जाना चाहिए।[15] ठोस चरण में रेडियोधर्मी अनुरेखक सम्मिलित होने पर अधिक अल्प सांद्रता को मापा जा सकता है।
जलीय बफर समाधान मिश्रण में डाइमिथाइल सल्फ़ोक्साइड जैसे अन्य -जलीय विलायक में पदार्थ के घोल को जोड़ने के लिए स्थैतिक विधि का रूपांतर है।[16] तुरंत वर्षा हो सकती है जिससे मेघाच्छादित मिश्रण बन सकता है। इस प्रकार के मिश्रण के लिए मापी गई घुलनशीलता को गतिज घुलनशीलता के रूप में जाना जाता है। मेघाच्छादन इस तथ्य के कारण होता है कि अवक्षेप कण बहुत छोटे होते हैं जिसके परिणामस्वरूप टिंडल का प्रकीर्णन होता है। वास्तव में कण इतने छोटे होते हैं कि कण आकार प्रभाव खेल में आता है और गतिज घुलनशीलता प्रायः संतुलन घुलनशीलता से अधिक होती है। समय के साथ-साथ स्फटिकों के आकार में वृद्धि के साथ बादल विलुप्त हो जाएगा, और अंतत: संतुलन उम्र बढ़ने के रूप में जाने वाली प्रक्रिया में संतुलन तक पहुंच जाएगा।[17]
गतिशील विधि
कार्बनिक अम्लों, क्षारों, और फार्मास्युटिकल रुचि के एम्फ़ोलिट्स के विलेयता मान प्रक्रिया द्वारा प्राप्त किए जा सकते हैं जिसे चेज़िंग इक्विलिब्रियम घुलनशीलता नामक प्रक्रिया द्वारा प्राप्त किया जा सकता है।[18] इस प्रक्रिया में, पदार्थ की मात्रा को पहले पीएच में घोला जाता है जहां यह मुख्य रूप से अपने आयनित रूप में उपस्थित होता है और फिर पीएच को परिवर्तित करके तटस्थ (अन-आयनित) प्रजातियों का अवक्षेप बनता है। इसके पश्चात, वर्षा या विघटन के कारण पीएच के परिवर्तन की दर पर नजर रखी जाती है और दो दरों के समान होने पर संतुलन की स्थिति का पता लगाने के लिए पीएच को समायोजित करने के लिए मजबूत अम्ल और क्षार टाइट्रेंट को जोड़ा जाता है। इस विधि का लाभ यह है कि यह अपेक्षाकृत तीव्र है क्योंकि बनने वाले अवक्षेप की मात्रा अधिक अल्प होती है। चूँकि, विधि का प्रदर्शन अतिसंतृप्ति समाधानों के निर्माण से प्रभावित हो सकता है।
यह भी देखें
- घुलनशीलता तालिका: 0 और 100 डिग्री सेल्सियस के मध्य के तापमान पर अधिकतर अकार्बनिक लवणों की घुलनशीलता की तालिका।
- सॉल्वेंट मॉडल
संदर्भ
- ↑ Pauling, Linus (1970). सामान्य रसायन शास्त्र. Dover Publishing. p. 450.
- ↑ Linke, W.F.; Seidell, A. (1965). अकार्बनिक और धातु कार्बनिक यौगिकों की घुलनशीलता (4th ed.). Van Nostrand. ISBN 0-8412-0097-1.
- ↑ Kenneth Denbigh, The Principles of Chemical Equilibrium, 1957, p. 257
- ↑ Peter Atkins, Physical Chemistry, p. 153 (8th edition)
- ↑ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3rd ed.). Prentice Hall. ISBN 978-0-13-175553-6. Section 6.10.
- ↑ 6.0 6.1 Hefter, G. T.; Tomkins, R. P. T., eds. (2003). घुलनशीलता का प्रायोगिक निर्धारण. Wiley-Blackwell. ISBN 0-471-49708-8.
- ↑ Mendham, J.; Denney, R. C.; Barnes, J. D.; Thomas, M. J. K. (2000), Vogel's Quantitative Chemical Analysis (6th ed.), New York: Prentice Hall, ISBN 0-582-22628-7 Section 2.14
- ↑ Hsieh, Yi-Ling; Ilevbare, Grace A.; Van Eerdenbrugh, Bernard; Box, Karl J.; Sanchez-Felix, Manuel Vincente; Taylor, Lynne S. (2012-05-12). "pH-Induced Precipitation Behavior of Weakly Basic Compounds: Determination of Extent and Duration of Supersaturation Using Potentiometric Titration and Correlation to Solid State Properties". Pharmaceutical Research (in English). 29 (10): 2738–2753. doi:10.1007/s11095-012-0759-8. ISSN 0724-8741. PMID 22580905. S2CID 15502736.
- ↑ Dengale, Swapnil Jayant; Grohganz, Holger; Rades, Thomas; Löbmann, Korbinian (May 2016). "सह-अनाकार दवा योगों में हालिया प्रगति". Advanced Drug Delivery Reviews. 100: 116–125. doi:10.1016/j.addr.2015.12.009. ISSN 0169-409X. PMID 26805787.
- ↑ Gutman, E. M. (1994). ठोस सतहों की मेकेनोकेमिस्ट्री. World Scientific Publishing.
- ↑ Skoog, Douglas A; West, Donald M; Holler, F James (2004). "9B-5". विश्लेषणात्मक रसायन विज्ञान के मूल तत्व (8th ed.). Brooks/Cole. pp. 238–242. ISBN 0030355230.
- ↑ Eigen, Manfred (1967). "नोबेल व्याख्यान" (PDF). Nobel Prize.
- ↑ Baes, C. F.; Mesmer, R. E. (1976). उद्धरणों का हाइड्रोलिसिस. New York: Wiley.
- ↑ Payghan, Santosh (2008). "ड्रग डिस्कवरी और विकास में विलेयता की क्षमता". Pharminfo.net. Archived from the original on March 30, 2010. Retrieved 5 July 2010.
- ↑ Rossotti, F. J. C.; Rossotti, H. (1961). "Chapter 9: Solubility". स्थिरता स्थिरांक का निर्धारण. McGraw-Hill.
- ↑ Aqueous solubility measurement – kinetic vs. thermodynamic methods Archived July 11, 2009, at the Wayback Machine
- ↑ Mendham, J.; Denney, R. C.; Barnes, J. D.; Thomas, M. J. K. (2000), Vogel's Quantitative Chemical Analysis (6th ed.), New York: Prentice Hall, ISBN 0-582-22628-7 Chapter 11: Gravimetric analysis
- ↑ Stuart, M.; Box, K. (2005). "Chasing Equilibrium: Measuring the Intrinsic Solubility of Weak Acids and Bases". Analytical Chemistry. 77 (4): 983–990. doi:10.1021/ac048767n. PMID 15858976.
बाहरी संबंध
- Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3rd ed.). Prentice Hall. ISBN 978-0-13-175553-6. Section 6.9: Solubilities of ionic salts. Includes a discussion of the thermodynamics of dissolution.
- IUPAC–NIST solubility database
- Solubility products of simple inorganic compounds
- Solvent activity along a saturation line and solubility
- Solubility challenge: Predict solubilities from a data base of 100 molecules. The database, of mostly compounds of pharmaceutical interest, is available at One hundred molecules with solubilities (Text file, tab separated).
A number of computer programs are available to do the calculations. They include:
- CHEMEQL: A comprehensive computer program for the calculation of thermodynamic equilibrium concentrations of species in homogeneous and heterogeneous systems. Many geochemical applications.
- JESS: All types of chemical equilibria can be modelled including protonation, complex formation, redox, solubility and adsorption interactions. Includes an extensive database.
- MINEQL+: A chemical equilibrium modeling system for aqueous systems. Handles a wide range of pH, redox, solubility and sorption scenarios.
- PHREEQC: USGS software designed to perform a wide variety of low-temperature aqueous geochemical calculations, including reactive transport in one dimension.
- MINTEQ: A chemical equilibrium model for the calculation of metal speciation, solubility equilibria etc. for natural waters.
- WinSGW: A Windows version of the SOLGASWATER computer program.