रूटाइल: Difference between revisions
No edit summary |
No edit summary |
||
| Line 73: | Line 73: | ||
}}</ref> नतीजतन, मेटास्टेबल TiO<sub>2</sub> पॉलीमॉर्फ्स का रूटाइल में परिवर्तन अपरिवर्तनीय है। चूंकि इसमें तीन मुख्य बहुरूपियों की सबसे कम [[वैन डेर वाल्स सतह|आणविक मात्रा]] है, यह आम तौर पर प्राथमिक टाइटेनियम-असर वाला चरण है, जो कि ज्यादातर उच्च दबाव मेटामॉर्फिक चट्टानों में होता है, मुख्य रूप से पारिस्थितिकी। | }}</ref> नतीजतन, मेटास्टेबल TiO<sub>2</sub> पॉलीमॉर्फ्स का रूटाइल में परिवर्तन अपरिवर्तनीय है। चूंकि इसमें तीन मुख्य बहुरूपियों की सबसे कम [[वैन डेर वाल्स सतह|आणविक मात्रा]] है, यह आम तौर पर प्राथमिक टाइटेनियम-असर वाला चरण है, जो कि ज्यादातर उच्च दबाव मेटामॉर्फिक चट्टानों में होता है, मुख्य रूप से पारिस्थितिकी। | ||
[[File:Quartz-159832.jpg|thumb|left|[[रूटिलेटेड क्वार्ट्ज]]]]आग्नेय वातावरण के भीतर, | [[File:Quartz-159832.jpg|thumb|left|[[रूटिलेटेड क्वार्ट्ज]]]]आग्नेय वातावरण के भीतर, प्लूटोनिक आग्नेय चट्टानों में रूटाइल एक सामान्य सहायक खनिज है, हालांकि यह कभी-कभी बहिर्भेदी [[घुसपैठ करने वाली चट्टान|आग्नेय चट्टानों]] में भी पाया जाता है, विशेष रूप से [[किंबरलाईट|किम्बरलाइट्स]] और [[तुम चमको|लैम्प्रोइट्स]] जैसे कि गहरे मेंटल स्रोत होते हैं। एनाटेज और ब्रुकाइट आग्नेय वातावरण में पाए जाते हैं, विशेष रूप से प्लूटोनिक चट्टानों के ठंडा होने के दौरान [[ऑटोजेनिक परिवर्तन]] के उत्पादों के रूप में; एनाटेज प्राथमिक रूटाइल से प्राप्त [[प्लेसर जमा]] में भी पाया जाता है। | ||
बड़े नमूना [[क्रिस्टल]] की घटना [[पेगमाटाइट]] | बड़े नमूना [[क्रिस्टल]] की घटना [[पेगमाटाइट|पेगमाटाइट्स]], स्कार्न्स और [[ग्रेनाइट]] ग्रीसेंस में सबसे आम है। रूटाइल कुछ परिवर्तित आग्नेय चट्टानों में और कुछ गनीस और विद्वानों में एक सहायक खनिज के रूप में पाया जाता है। एसिक्यूलर क्रिस्टल के समूहों में यह अक्सर [[स्विट्ज़रलैंड]] के ग्रौबुन्डेन से फ्लेचेस डी एमोर के रूप में घुमावदार [[क्वार्ट्ज]] देखा जाता है। 2005 में [[पश्चिम अफ्रीका]] में [[सेरा लिओन]] गणराज्य की उत्पादन क्षमता दुनिया की वार्षिक रूटाइल आपूर्ति का 23% थी, जो 2008 में बढ़कर लगभग 30% हो गई। | ||
== क्रिस्टल संरचना == | == क्रिस्टल की संरचना == | ||
[[Image:Rutile-unit-cell-3D-balls.png|thumb|left|क्रिस्टल संरचना # रूटाइल की यूनिट सेल। ती परमाणु धूसर होते हैं; ओ परमाणु लाल हैं।]] | [[Image:Rutile-unit-cell-3D-balls.png|thumb|left|क्रिस्टल संरचना # रूटाइल की यूनिट सेल। ती परमाणु धूसर होते हैं; ओ परमाणु लाल हैं।]] | ||
[[File:Rutile crystal structure.png|alt=A ballरूटाइल क्रिस्टल का -और-स्टिक रासायनिक मॉडल|बायां|अंगूठा|रूटाइल की विस्तारित क्रिस्टल संरचना]]रूटाइल में एक [[टेट्रागोनल क्रिस्टल सिस्टम]] क्रिस्टल स्ट्रक्चर # यूनिट सेल है, जिसमें यूनिट सेल पैरामीटर a = b = 4.584 Å, और c = 2.953 Å है।<ref>{{cite journal |url=http://www.surface.tulane.edu/pdf/SurfSciRep.pdf |first=Ulrike |last=Diebold |title=The surface science of titanium dioxide |journal=[[Surface Science Reports]] |volume=48 |issue=5–8 |year=2003 |pages=53–229 |doi=10.1016/S0167-5729(02)00100-0 |bibcode=2003SurSR..48...53D |url-status=dead |archive-url=https://web.archive.org/web/20100612153219/http://www.surface.tulane.edu/pdf/SurfSciRep.pdf |archive-date=2010-06-12 }}</ref> टाइटेनियम के धनायनों की समन्वय संख्या 6 है, जिसका अर्थ है कि वे 6 ऑक्सीजन परमाणुओं के एक अष्टफलक से घिरे हैं। ऑक्सीजन आयनों की समन्वय संख्या 3 होती है, जिसके परिणामस्वरूप त्रिकोणीय तलीय समन्वय होता है। रूटाइल एक स्क्रू अक्ष भी दिखाता है जब इसके ऑक्टाहेड्रा को क्रमिक रूप से देखा जाता है।<ref>[http://www.uwgb.edu/dutchs/Petrology/Rutile%20Structure.HTM "Rutile Structure"], Steven Dutch, Natural and Applied Sciences, University of Wisconsin – Green Bay.</ref> जब कम करने की स्थिति में गठित किया जाता है, तो ऑक्सीजन रिक्तियां हो सकती हैं, जो टीआई से मिलती हैं<sup>3+</sup> केंद्र।<ref name="palfey2021">{{cite journal | last1 = Palfey | first1 = W.R. | last2 = Rossman | first2 = G.R. | last3 = Goddard | first3 = W.A. III | title = Structure, Energetics, and Spectra for the Oxygen Vacancy in Rutile: Prominence of the Ti–H<sub>O</sub>–Ti Bond | date = 2021 | journal = The Journal of Physical Chemistry | volume = 12 | issue = 41 | pages = 10175–10181 | doi = 10.1021/acs.jpclett.1c02850| pmid = 34644100 | s2cid = 238860345 }}</ref> हाइड्रोजन इन अंतरालों में प्रवेश कर सकता है, जो एक व्यक्तिगत रिक्त स्थान (हाइड्रोजन आयन के रूप में युग्मन) के रूप में विद्यमान है या आसन्न ऑक्सीजन के साथ एक [[हीड्राकसीड]] समूह बना रहा है।<ref name="palfey2021" /> | [[File:Rutile crystal structure.png|alt=A ballरूटाइल क्रिस्टल का -और-स्टिक रासायनिक मॉडल|बायां|अंगूठा|रूटाइल की विस्तारित क्रिस्टल संरचना]]रूटाइल में एक [[टेट्रागोनल क्रिस्टल सिस्टम]] क्रिस्टल स्ट्रक्चर # यूनिट सेल है, जिसमें यूनिट सेल पैरामीटर a = b = 4.584 Å, और c = 2.953 Å है।<ref name=":0">{{cite journal |url=http://www.surface.tulane.edu/pdf/SurfSciRep.pdf |first=Ulrike |last=Diebold |title=The surface science of titanium dioxide |journal=[[Surface Science Reports]] |volume=48 |issue=5–8 |year=2003 |pages=53–229 |doi=10.1016/S0167-5729(02)00100-0 |bibcode=2003SurSR..48...53D |url-status=dead |archive-url=https://web.archive.org/web/20100612153219/http://www.surface.tulane.edu/pdf/SurfSciRep.pdf |archive-date=2010-06-12 }}</ref> टाइटेनियम के धनायनों की समन्वय संख्या 6 है, जिसका अर्थ है कि वे 6 ऑक्सीजन परमाणुओं के एक अष्टफलक से घिरे हैं। ऑक्सीजन आयनों की समन्वय संख्या 3 होती है, जिसके परिणामस्वरूप त्रिकोणीय तलीय समन्वय होता है। रूटाइल एक स्क्रू अक्ष भी दिखाता है जब इसके ऑक्टाहेड्रा को क्रमिक रूप से देखा जाता है।<ref name=":1">[http://www.uwgb.edu/dutchs/Petrology/Rutile%20Structure.HTM "Rutile Structure"], Steven Dutch, Natural and Applied Sciences, University of Wisconsin – Green Bay.</ref> जब कम करने की स्थिति में गठित किया जाता है, तो ऑक्सीजन रिक्तियां हो सकती हैं, जो टीआई से मिलती हैं<sup>3+</sup> केंद्र।<ref name="palfey2021">{{cite journal | last1 = Palfey | first1 = W.R. | last2 = Rossman | first2 = G.R. | last3 = Goddard | first3 = W.A. III | title = Structure, Energetics, and Spectra for the Oxygen Vacancy in Rutile: Prominence of the Ti–H<sub>O</sub>–Ti Bond | date = 2021 | journal = The Journal of Physical Chemistry | volume = 12 | issue = 41 | pages = 10175–10181 | doi = 10.1021/acs.jpclett.1c02850| pmid = 34644100 | s2cid = 238860345 }}</ref> हाइड्रोजन इन अंतरालों में प्रवेश कर सकता है, जो एक व्यक्तिगत रिक्त स्थान (हाइड्रोजन आयन के रूप में युग्मन) के रूप में विद्यमान है या आसन्न ऑक्सीजन के साथ एक [[हीड्राकसीड|हाइड्रॉक्साइड]] समूह बना रहा है।<ref name="palfey2021" /> | ||
रूटाइल क्रिस्टल आमतौर पर अपने सी अक्ष, [001] [[मिलर सूचकांक]] के साथ तरजीही अभिविन्यास के साथ एक प्रिज्मेटिक या | रूटाइल में एक टेट्रागोनल यूनिट सेल है, जिसमें यूनिट सेल पैरामीटर a = b = 4.584 Å, और c = 2.953 Å है।<ref name=":0" /> टाइटेनियम के धनायनों की समन्वय संख्या 6 है, जिसका अर्थ है कि वे 6 ऑक्सीजन परमाणुओं के एक अष्टफलक से घिरे हैं। ऑक्सीजन आयनों की समन्वय संख्या 3 होती है, जिसके परिणामस्वरूप त्रिकोणीय तलीय समन्वय होता है। रूटाइल एक स्क्रू अक्ष भी दिखाता है जब इसके ऑक्टाहेड्रा को क्रमिक रूप से देखा जाता है।<ref name=":1" /> घटती परिस्थितियों में बनने पर, Ti<sup>3+</sup> केंद्रों के साथ मिलकर ऑक्सीजन की रिक्तियां हो सकती हैं।<ref name="palfey2021" /> हाइड्रोजन इन अंतरालों में प्रवेश कर सकता है, जो एक व्यक्तिगत रिक्त स्थान (हाइड्रोजन आयन के रूप में युग्मन) के रूप में मौजूद है या आसन्न ऑक्सीजन के साथ एक [[हीड्राकसीड|हाइड्रॉक्साइड]] समूह बना रहा है।<ref name="palfey2021" /> | ||
रूटाइल क्रिस्टल आमतौर पर अपने सी अक्ष, [001] [[मिलर सूचकांक|दिशा]] के साथ तरजीही अभिविन्यास के साथ एक प्रिज्मेटिक या एकिकुलर [[क्रिस्टल की आदत|विकास आदत]] प्रदर्शित करने के लिए देखे जाते हैं। विकास की इस आदत को पसंद किया जाता है क्योंकि रूटाइल के {110} पहलू निम्नतम सतह मुक्त ऊर्जा प्रदर्शित करते हैं और इसलिए थर्मोडायनामिक रूप से सबसे स्थिर हैं।<ref>{{cite journal | journal=Journal of Crystal Growth| volume=359|pages= 83–91|year=2012|title=Abnormal grain growth of rutile TiO<sub>2</sub> induced by ZrSiO<sub>4</sub>|doi=10.1016/j.jcrysgro.2012.08.015|arxiv=1303.2761|bibcode=2012JCrGr.359...83H| last1=Hanaor| first1=Dorian A.H.| last2=Xu| first2=Wanqiang| last3=Ferry| first3=Michael| last4=Sorrell| first4=Charles C.| last5=Sorrell| first5=Charles C.| s2cid=94096447}}</ref> इस चरण के [[नैनोरोड्स]], [[nanowires|नैनोवायर्स]] और असामान्य अनाज विकास घटनाओं में रूटाइल की सी-अक्ष उन्मुख वृद्धि स्पष्ट रूप से दिखाई देती है। | |||
== आवेदन == | == आवेदन == | ||
[[File:Rutile needles.jpg|thumb|क्वार्ट्ज़ क्रिस्टल से निकलने वाले रूटाइल के ऐक्युलर क्रिस्टल]]समुद्र तट की रेत में बड़ी मात्रा में रूटाइल [[भारी खनिज]]ों और अयस्क जमा का एक महत्वपूर्ण घटक है। खनिक मूल्यवान खनिजों को निकालते और अलग करते हैं – जैसे, रूटाइल, [[जिक्रोन]] और [[इल्मेनाइट]]। रटाइल के लिए मुख्य उपयोग रंजक के रूप में और [[टाइटेनियम धातु विज्ञान]] के उत्पादन के लिए दुर्दम्य का निर्माण है। | [[File:Rutile needles.jpg|thumb|क्वार्ट्ज़ क्रिस्टल से निकलने वाले रूटाइल के ऐक्युलर क्रिस्टल]]समुद्र तट की रेत में बड़ी मात्रा में रूटाइल [[भारी खनिज]]ों और अयस्क जमा का एक महत्वपूर्ण घटक है। खनिक मूल्यवान खनिजों को निकालते और अलग करते हैं – जैसे, रूटाइल, [[जिक्रोन]] और [[इल्मेनाइट]]। रटाइल के लिए मुख्य उपयोग रंजक के रूप में और [[टाइटेनियम धातु विज्ञान]] के उत्पादन के लिए दुर्दम्य का निर्माण है। समुद्र तट की रेत में बड़ी मात्रा में रूटाइल भारी खनिजों और अयस्क जमा का एक महत्वपूर्ण घटक है। खनिक मूल्यवान खनिजों को निकालते और अलग करते हैं - जैसे, रूटाइल, जिरकोन और इल्मेनाइट। रूटाइल के लिए मुख्य उपयोग आग रोक सिरेमिक का निर्माण, वर्णक के रूप में और टाइटेनियम धातु के उत्पादन के लिए है। | ||
बारीक पीसा हुआ रूटाइल एक शानदार सफेद [[रंग]]द्रव्य है और इसका उपयोग [[रँगना]], [[प्लास्टिक]], कागज, खाद्य पदार्थ और अन्य अनुप्रयोगों में किया जाता है जो चमकीले सफेद रंग के लिए कहते हैं। टाइटेनियम डाइऑक्साइड वर्णक दुनिया भर में टाइटेनियम का सबसे बड़ा उपयोग है। रूटाइल के नैनोकण दृश्यमान स्पेक्ट्रम के लिए पारदर्शी होते हैं लेकिन [[पराबैंगनी]] विकिरण ([[सनस्क्रीन]]) के [[अवशोषण (विद्युत चुम्बकीय विकिरण)]] में अत्यधिक प्रभावी होते हैं। नैनो-आकार के रूटाइल कणों का यूवी अवशोषण बल्क रूटाइल की तुलना में ब्लू-शिफ्ट होता है ताकि नैनोकणों द्वारा उच्च-ऊर्जा यूवी प्रकाश को अवशोषित किया जा सके। इसलिए, यूवी-प्रेरित त्वचा क्षति से बचाने के लिए उनका उपयोग सनस्क्रीन में किया जाता है। | बारीक पीसा हुआ रूटाइल एक शानदार सफेद [[रंग]]द्रव्य है और इसका उपयोग [[रँगना]], [[प्लास्टिक]], कागज, खाद्य पदार्थ और अन्य अनुप्रयोगों में किया जाता है जो चमकीले सफेद रंग के लिए कहते हैं। टाइटेनियम डाइऑक्साइड वर्णक दुनिया भर में टाइटेनियम का सबसे बड़ा उपयोग है। रूटाइल के नैनोकण दृश्यमान स्पेक्ट्रम के लिए पारदर्शी होते हैं लेकिन [[पराबैंगनी]] विकिरण ([[सनस्क्रीन]]) के [[अवशोषण (विद्युत चुम्बकीय विकिरण)]] में अत्यधिक प्रभावी होते हैं। नैनो-आकार के रूटाइल कणों का यूवी अवशोषण बल्क रूटाइल की तुलना में ब्लू-शिफ्ट होता है ताकि नैनोकणों द्वारा उच्च-ऊर्जा यूवी प्रकाश को अवशोषित किया जा सके। इसलिए, यूवी-प्रेरित त्वचा क्षति से बचाने के लिए उनका उपयोग सनस्क्रीन में किया जाता है। | ||
Revision as of 12:57, 10 February 2023
| Rutile | |
|---|---|
 | |
| सामान्य | |
| श्रेणी | Oxide minerals |
| Formula (repeating unit) | TiO2 |
| आईएमए प्रतीक | Rt[1] |
| स्ट्रुन्ज़ वर्गीकरण | 4.DB.05 |
| क्रिस्टल सिस्टम | Tetragonal |
| क्रिस्टल क्लास | Ditetragonal dipyramidal (4/mmm) H-M symbol: (4/m 2/m 2/m) |
| अंतरिक्ष समूह | P42/mnm |
| यूनिट सेल | a = 4.5937 Å, c = 2.9587 Å; Z = 2 |
| Identification | |
| Color | Brown, reddish brown, blood red, red, brownish yellow, pale yellow, yellow, pale blue, violet, rarely grass-green, grayish black; black if high in Nb–Ta |
| क्रिस्टल की आदत | Acicular to Prismatic crystals, elongated and striated parallel to [001] |
| ट्विनिंग | Common on {011}, or {031}; as contact twins with two, six, or eight individuals, cyclic, polysynthetic |
| क्लीवेज | {110} good, {100} moderate, parting on {092} and {011} |
| फ्रैक्चर | Uneven to sub-conchoidal |
| Mohs scale hardness | 6.0–6.5 |
| Luster | Adamantine to metallic |
| स्ट्रीक | Bright red to dark red |
| डायफेनिटी | Opaque, transparent in thin fragments |
| विशिष्ट गुरुत्व | 4.23 increasing with Nb–Ta content |
| ऑप्टिकल गुण | Uniaxial (+) |
| अपवर्तक सूचकांक | nω = 2.613, nε = 2.909 (589 nm) |
| बिरफ्रेंसेंस | 0.296 (589 nm) |
| प्लोक्रोइज्म | Weak to distinct brownish red-green-yellow |
| डिस्पर्सन | Strong |
| भव्यता | Fusible in alkali carbonates |
| घुलनशीलता | Insoluble in acids |
| सामान्य अशुद्धियाँ | Fe, Nb, Ta |
| अन्य विशेषताएँ | Strongly anisotropic |
| संदर्भ | [2][3][4][5] |
रूटाइल रंजातु डाइऑक्साइड (TiO2) से बना एक ऑक्साइड खनिज है, जो TiO2 का सबसे सामान्य प्राकृतिक रूप है। TiO2 के दुर्लभ बहुरूप ज्ञात हैं, जिनमें एनाटेज, अकाओगाइट और ब्रुकाइट शामिल हैं।
रूटाइल में किसी भी ज्ञात क्रिस्टल के दृश्य तरंग दैर्ध्य पर उच्चतम अपवर्तक सूचकांकों में से एक है और यह विशेष रूप से बड़े द्विअर्थी और उच्च फैलाव को भी प्रदर्शित करता है। इन गुणों के कारण, यह कुछ ऑप्टिकल तत्वों, विशेष रूप से ध्रुवीकरण प्रकाशिकी के निर्माण के लिए उपयोगी है, लगभग 4.5 माइक्रोमीटर तक लंबे समय तक दृश्यमान और अवरक्त तरंगदैर्ध्य के लिए। प्राकृतिक रूटाइल में 10% तक लोहा और नाइओबियम और टैंटलम की महत्वपूर्ण मात्रा हो सकती है।
रूटाइल का नाम लैटिन rutilus ('लाल') से लिया गया है, जो प्रसारित प्रकाश द्वारा देखे जाने पर कुछ नमूनों में देखे गए गहरे लाल रंग के संदर्भ में है। रूटाइल को पहली बार 1803 में अब्राहम गोटलॉब वर्नर द्वारा होरकाजुएलो डे ला सिएरा, मैड्रिड (स्पेन) में प्राप्त नमूनों का उपयोग करके वर्णित किया गया था,[6] जो फलस्वरूप प्रकार का इलाका है।
घटना
रूटाइल उच्च तापमान और उच्च दबाव मेटामॉर्फिक चट्टानों और आग्नेय चट्टानों में एक सामान्य सहायक खनिज है।
ऊष्मप्रवैगिक रूप से, रूटाइल सभी तापमानों पर TiO2 का सबसे स्थिर बहुरूप है, एनाटेज या ब्रुकाइट के मेटास्टेबल चरणों की तुलना में कम कुल मुक्त ऊर्जा प्रदर्शित करता है।[7] नतीजतन, मेटास्टेबल TiO2 पॉलीमॉर्फ्स का रूटाइल में परिवर्तन अपरिवर्तनीय है। चूंकि इसमें तीन मुख्य बहुरूपियों की सबसे कम आणविक मात्रा है, यह आम तौर पर प्राथमिक टाइटेनियम-असर वाला चरण है, जो कि ज्यादातर उच्च दबाव मेटामॉर्फिक चट्टानों में होता है, मुख्य रूप से पारिस्थितिकी।
आग्नेय वातावरण के भीतर, प्लूटोनिक आग्नेय चट्टानों में रूटाइल एक सामान्य सहायक खनिज है, हालांकि यह कभी-कभी बहिर्भेदी आग्नेय चट्टानों में भी पाया जाता है, विशेष रूप से किम्बरलाइट्स और लैम्प्रोइट्स जैसे कि गहरे मेंटल स्रोत होते हैं। एनाटेज और ब्रुकाइट आग्नेय वातावरण में पाए जाते हैं, विशेष रूप से प्लूटोनिक चट्टानों के ठंडा होने के दौरान ऑटोजेनिक परिवर्तन के उत्पादों के रूप में; एनाटेज प्राथमिक रूटाइल से प्राप्त प्लेसर जमा में भी पाया जाता है।
बड़े नमूना क्रिस्टल की घटना पेगमाटाइट्स, स्कार्न्स और ग्रेनाइट ग्रीसेंस में सबसे आम है। रूटाइल कुछ परिवर्तित आग्नेय चट्टानों में और कुछ गनीस और विद्वानों में एक सहायक खनिज के रूप में पाया जाता है। एसिक्यूलर क्रिस्टल के समूहों में यह अक्सर स्विट्ज़रलैंड के ग्रौबुन्डेन से फ्लेचेस डी एमोर के रूप में घुमावदार क्वार्ट्ज देखा जाता है। 2005 में पश्चिम अफ्रीका में सेरा लिओन गणराज्य की उत्पादन क्षमता दुनिया की वार्षिक रूटाइल आपूर्ति का 23% थी, जो 2008 में बढ़कर लगभग 30% हो गई।
क्रिस्टल की संरचना
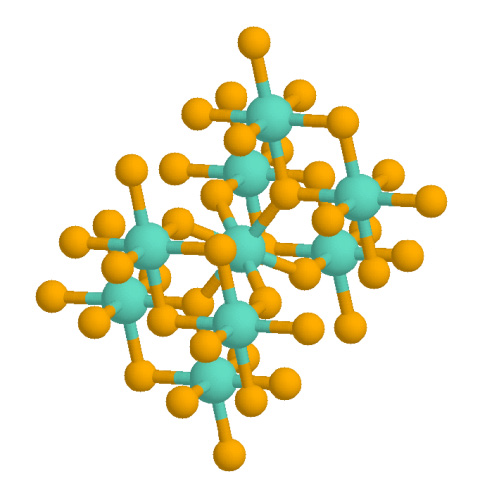 रूटाइल में एक टेट्रागोनल क्रिस्टल सिस्टम क्रिस्टल स्ट्रक्चर # यूनिट सेल है, जिसमें यूनिट सेल पैरामीटर a = b = 4.584 Å, और c = 2.953 Å है।[8] टाइटेनियम के धनायनों की समन्वय संख्या 6 है, जिसका अर्थ है कि वे 6 ऑक्सीजन परमाणुओं के एक अष्टफलक से घिरे हैं। ऑक्सीजन आयनों की समन्वय संख्या 3 होती है, जिसके परिणामस्वरूप त्रिकोणीय तलीय समन्वय होता है। रूटाइल एक स्क्रू अक्ष भी दिखाता है जब इसके ऑक्टाहेड्रा को क्रमिक रूप से देखा जाता है।[9] जब कम करने की स्थिति में गठित किया जाता है, तो ऑक्सीजन रिक्तियां हो सकती हैं, जो टीआई से मिलती हैं3+ केंद्र।[10] हाइड्रोजन इन अंतरालों में प्रवेश कर सकता है, जो एक व्यक्तिगत रिक्त स्थान (हाइड्रोजन आयन के रूप में युग्मन) के रूप में विद्यमान है या आसन्न ऑक्सीजन के साथ एक हाइड्रॉक्साइड समूह बना रहा है।[10]
रूटाइल में एक टेट्रागोनल क्रिस्टल सिस्टम क्रिस्टल स्ट्रक्चर # यूनिट सेल है, जिसमें यूनिट सेल पैरामीटर a = b = 4.584 Å, और c = 2.953 Å है।[8] टाइटेनियम के धनायनों की समन्वय संख्या 6 है, जिसका अर्थ है कि वे 6 ऑक्सीजन परमाणुओं के एक अष्टफलक से घिरे हैं। ऑक्सीजन आयनों की समन्वय संख्या 3 होती है, जिसके परिणामस्वरूप त्रिकोणीय तलीय समन्वय होता है। रूटाइल एक स्क्रू अक्ष भी दिखाता है जब इसके ऑक्टाहेड्रा को क्रमिक रूप से देखा जाता है।[9] जब कम करने की स्थिति में गठित किया जाता है, तो ऑक्सीजन रिक्तियां हो सकती हैं, जो टीआई से मिलती हैं3+ केंद्र।[10] हाइड्रोजन इन अंतरालों में प्रवेश कर सकता है, जो एक व्यक्तिगत रिक्त स्थान (हाइड्रोजन आयन के रूप में युग्मन) के रूप में विद्यमान है या आसन्न ऑक्सीजन के साथ एक हाइड्रॉक्साइड समूह बना रहा है।[10]
रूटाइल में एक टेट्रागोनल यूनिट सेल है, जिसमें यूनिट सेल पैरामीटर a = b = 4.584 Å, और c = 2.953 Å है।[8] टाइटेनियम के धनायनों की समन्वय संख्या 6 है, जिसका अर्थ है कि वे 6 ऑक्सीजन परमाणुओं के एक अष्टफलक से घिरे हैं। ऑक्सीजन आयनों की समन्वय संख्या 3 होती है, जिसके परिणामस्वरूप त्रिकोणीय तलीय समन्वय होता है। रूटाइल एक स्क्रू अक्ष भी दिखाता है जब इसके ऑक्टाहेड्रा को क्रमिक रूप से देखा जाता है।[9] घटती परिस्थितियों में बनने पर, Ti3+ केंद्रों के साथ मिलकर ऑक्सीजन की रिक्तियां हो सकती हैं।[10] हाइड्रोजन इन अंतरालों में प्रवेश कर सकता है, जो एक व्यक्तिगत रिक्त स्थान (हाइड्रोजन आयन के रूप में युग्मन) के रूप में मौजूद है या आसन्न ऑक्सीजन के साथ एक हाइड्रॉक्साइड समूह बना रहा है।[10]
रूटाइल क्रिस्टल आमतौर पर अपने सी अक्ष, [001] दिशा के साथ तरजीही अभिविन्यास के साथ एक प्रिज्मेटिक या एकिकुलर विकास आदत प्रदर्शित करने के लिए देखे जाते हैं। विकास की इस आदत को पसंद किया जाता है क्योंकि रूटाइल के {110} पहलू निम्नतम सतह मुक्त ऊर्जा प्रदर्शित करते हैं और इसलिए थर्मोडायनामिक रूप से सबसे स्थिर हैं।[11] इस चरण के नैनोरोड्स, नैनोवायर्स और असामान्य अनाज विकास घटनाओं में रूटाइल की सी-अक्ष उन्मुख वृद्धि स्पष्ट रूप से दिखाई देती है।
आवेदन
समुद्र तट की रेत में बड़ी मात्रा में रूटाइल भारी खनिजों और अयस्क जमा का एक महत्वपूर्ण घटक है। खनिक मूल्यवान खनिजों को निकालते और अलग करते हैं – जैसे, रूटाइल, जिक्रोन और इल्मेनाइट। रटाइल के लिए मुख्य उपयोग रंजक के रूप में और टाइटेनियम धातु विज्ञान के उत्पादन के लिए दुर्दम्य का निर्माण है। समुद्र तट की रेत में बड़ी मात्रा में रूटाइल भारी खनिजों और अयस्क जमा का एक महत्वपूर्ण घटक है। खनिक मूल्यवान खनिजों को निकालते और अलग करते हैं - जैसे, रूटाइल, जिरकोन और इल्मेनाइट। रूटाइल के लिए मुख्य उपयोग आग रोक सिरेमिक का निर्माण, वर्णक के रूप में और टाइटेनियम धातु के उत्पादन के लिए है।
बारीक पीसा हुआ रूटाइल एक शानदार सफेद रंगद्रव्य है और इसका उपयोग रँगना, प्लास्टिक, कागज, खाद्य पदार्थ और अन्य अनुप्रयोगों में किया जाता है जो चमकीले सफेद रंग के लिए कहते हैं। टाइटेनियम डाइऑक्साइड वर्णक दुनिया भर में टाइटेनियम का सबसे बड़ा उपयोग है। रूटाइल के नैनोकण दृश्यमान स्पेक्ट्रम के लिए पारदर्शी होते हैं लेकिन पराबैंगनी विकिरण (सनस्क्रीन) के अवशोषण (विद्युत चुम्बकीय विकिरण) में अत्यधिक प्रभावी होते हैं। नैनो-आकार के रूटाइल कणों का यूवी अवशोषण बल्क रूटाइल की तुलना में ब्लू-शिफ्ट होता है ताकि नैनोकणों द्वारा उच्च-ऊर्जा यूवी प्रकाश को अवशोषित किया जा सके। इसलिए, यूवी-प्रेरित त्वचा क्षति से बचाने के लिए उनका उपयोग सनस्क्रीन में किया जाता है।
रत्न में मौजूद छोटी रूटाइल सुइयाँ एक ऑप्टिकल घटना के लिए जिम्मेदार होती हैं जिसे तारांकन (जेमोलॉजी) के रूप में जाना जाता है। तारकीय रत्नों को तारा रत्न कहा जाता है। स्टार नीलम, स्टार माणिक और अन्य स्टार रत्नों की अत्यधिक मांग की जाती है और आमतौर पर उनके सामान्य समकक्षों की तुलना में अधिक मूल्यवान होते हैं।
रूटाइल का व्यापक रूप से आवरित धातु की आर्क वेल्डिंग के रूप में उपयोग किया जाता है। इसका उपयोग ZTR सूचकांक के एक भाग के रूप में भी किया जाता है, जो अत्यधिक अपक्षयित अवसादों को वर्गीकृत करता है।
अर्धचालक
रूटाइल, एक बड़े बैंड-गैप सेमीकंडक्टर के रूप में, हाल के दशकों में फोटोकैटलिसिस और चुंबकीय सेमीकंडक्टर में अनुप्रयोगों के लिए एक कार्यात्मक ऑक्साइड के रूप में अनुप्रयोगों के लिए महत्वपूर्ण शोध का विषय रहा है।[12] अनुसंधान के प्रयास आमतौर पर खनिज-जमा व्युत्पन्न सामग्री के बजाय छोटी मात्रा में सिंथेटिक रूटाइल का उपयोग करते हैं।
सिंथेटिक रूटाइल
सिंथेटिक रूटाइल पहली बार 1948 में निर्मित किया गया था और इसे विभिन्न नामों से बेचा जाता है। इसे बेचर प्रक्रिया के माध्यम से टाइटेनियम अयस्क इल्मेनाइट से उत्पादित किया जा सकता है। बहुत शुद्ध सिंथेटिक रूटाइल पारदर्शिता (प्रकाशिकी)ऑप्टिक्स) और लगभग रंगहीन, थोड़ा पीला, बड़े टुकड़ों में होता है। डोपिंग द्वारा विभिन्न प्रकार के रंगों में सिंथेटिक रूटाइल बनाया जा सकता है। उच्च अपवर्तक सूचकांक एक चमक (खनिज विज्ञान) देता है #एडमैंटिन चमक चमक (खनिज विज्ञान) और मजबूत अपवर्तन जो हीरे की तरह दिखने की ओर जाता है। निकट-रंगहीन हीरा सिमुलेंट को टाइटेनिया के रूप में बेचा जाता है, जो इस ऑक्साइड के लिए पुराने जमाने का रासायनिक नाम है। हालांकि, गहनों में रूटाइल का उपयोग शायद ही कभी किया जाता है क्योंकि यह बहुत कठोरता (खरोंच प्रतिरोधी) नहीं है, मोह कठोरता पैमाने पर केवल 6 के बारे में मापता है।
एनाटेज और रूटाइल दोनों चरणों (साथ ही दो चरणों के द्विध्रुवीय मिश्रण) में टाइटेनियम डाइऑक्साइड की फोटोकैटलिसिस गतिविधि में बढ़ती शोध रुचि के परिणामस्वरूप, रूटाइल टीआईओ2 पाउडर और पतली फिल्म के रूप में अकार्बनिक अग्रदूतों (आमतौर पर टाइटेनियम टेट्राक्लोराइड | TiCl) का उपयोग करके समाधान आधारित मार्गों के माध्यम से प्रयोगशाला स्थितियों में अक्सर निर्मित किया जाता है।4) या ऑर्गोनोमेटेलिक प्रीकर्सर (आमतौर पर अल्कोक्साइड्स जैसे टाइटेनियम आइसोप्रोपॉक्साइड, जिसे TTIP भी कहा जाता है)। संश्लेषण की स्थिति के आधार पर, क्रिस्टलीकरण करने वाला पहला चरण मेटास्टेबल एनाटेज चरण हो सकता है, जिसे थर्मल उपचार के माध्यम से संतुलन रूटाइल चरण में परिवर्तित किया जा सकता है। रटाइल के भौतिक गुणों को अक्सर डोपेंट का उपयोग करके संशोधित किया जाता है ताकि बेहतर फोटो-जनित चार्ज वाहक पृथक्करण, परिवर्तित इलेक्ट्रॉनिक बैंड संरचनाओं और बेहतर सतह प्रतिक्रियाशीलता के माध्यम से बेहतर फोटोकैटलिटिक गतिविधि प्रदान की जा सके।
यह भी देखें
संदर्भ
- ↑ Warr, L.N. (2021). "IMA–CNMNC approved mineral symbols". Mineralogical Magazine. 85 (3): 291–320. Bibcode:2021MinM...85..291W. doi:10.1180/mgm.2021.43. S2CID 235729616.
- ↑ Handbook of Mineralogy.
- ↑ Webmineral data.
- ↑ Mindat.org.
- ↑ Klein, Cornelis and Cornelius S. Hurlbut, 1985, Manual of Mineralogy, 20th ed., John Wiley and Sons, New York, pp. 304–05, ISBN 0-471-80580-7.
- ↑ Calvo, Miguel (2009). Minerales y Minas de España. Vol. IV. Óxidos e hidróxidos (in español). Madrid, Spain: Escuela Técnica Superior de Ingenieros de Minas de Madrid. Fundación Gómez Pardo. p. 237.
- ↑ Hanaor, D. A. H.; Assadi, M. H. N.; Li, S.; Yu, A.; Sorrell, C. C. (2012). "Ab initio study of phase stability in doped TiO2". Computational Mechanics. 50 (2): 185–94. arXiv:1210.7555. Bibcode:2012CompM..50..185H. doi:10.1007/s00466-012-0728-4. S2CID 95958719.
- ↑ 8.0 8.1 Diebold, Ulrike (2003). "The surface science of titanium dioxide" (PDF). Surface Science Reports. 48 (5–8): 53–229. Bibcode:2003SurSR..48...53D. doi:10.1016/S0167-5729(02)00100-0. Archived from the original (PDF) on 2010-06-12.
- ↑ 9.0 9.1 "Rutile Structure", Steven Dutch, Natural and Applied Sciences, University of Wisconsin – Green Bay.
- ↑ 10.0 10.1 10.2 10.3 Palfey, W.R.; Rossman, G.R.; Goddard, W.A. III (2021). "Structure, Energetics, and Spectra for the Oxygen Vacancy in Rutile: Prominence of the Ti–HO–Ti Bond". The Journal of Physical Chemistry. 12 (41): 10175–10181. doi:10.1021/acs.jpclett.1c02850. PMID 34644100. S2CID 238860345.
- ↑ Hanaor, Dorian A.H.; Xu, Wanqiang; Ferry, Michael; Sorrell, Charles C.; Sorrell, Charles C. (2012). "Abnormal grain growth of rutile TiO2 induced by ZrSiO4". Journal of Crystal Growth. 359: 83–91. arXiv:1303.2761. Bibcode:2012JCrGr.359...83H. doi:10.1016/j.jcrysgro.2012.08.015. S2CID 94096447.
- ↑ Magnetism in titanium dioxide polymorphs J. Applied Physics
बाहरी संबंध
- . Encyclopedia Americana. 1920.