जर्मेनियम: Difference between revisions
No edit summary |
m (73 revisions imported from alpha:जर्मेनियम) |
||
| (26 intermediate revisions by 3 users not shown) | |||
| Line 3: | Line 3: | ||
{{infobox germanium}} | {{infobox germanium}} | ||
'''जर्मेनियम''' एक [[ रासायनिक तत्व |रासायनिक तत्व]] है, इसका [[ प्रतीक (रसायन विज्ञान) |प्रतीक]] '''Ge''' और [[परमाणु संख्या]] 32 है। यह चमकदार, कठोर-भंगुर, भूरा-सफ़ेद और दिखने में [[सिलिकॉन]] के समान होता है। यह [[ कार्बन समूह |कार्बन समूह]] में एक [[उपधातु]] है जो रासायनिक रूप में अपने समूह प्रतिवेशियो [[ सिलिकॉन | सिलिकॉन]] और [[ टिन | टिन]] के समान है। सिलिकॉन की तरह, जर्मेनियम | '''जर्मेनियम''' एक [[ रासायनिक तत्व |रासायनिक तत्व]] है, इसका [[ प्रतीक (रसायन विज्ञान) |प्रतीक]] '''Ge''' और [[परमाणु संख्या]] 32 है। यह चमकदार, कठोर-भंगुर, भूरा-सफ़ेद और दिखने में [[सिलिकॉन]] के समान होता है। यह [[ कार्बन समूह |कार्बन समूह]] में एक [[उपधातु]] है जो रासायनिक रूप में अपने समूह प्रतिवेशियो [[ सिलिकॉन | सिलिकॉन]] और [[ टिन | टिन]] के समान है। सिलिकॉन की तरह, जर्मेनियम स्वाभाविक रूप से [[ रासायनिक प्रतिक्रिया |रासायनिक प्रतिक्रिया]] और प्रकृति में [[ ऑक्सीजन | ऑक्सीजन]] के साथ परिसरों का निर्माण करता है। | ||
क्योंकि यह कभी कभी उच्च सांद्रता में दिखाई देता है, इसलिए [[तत्वों की खोज]] में जर्मेनियम की खोज तुलनात्मक रूप से देर से हुई।[[पृथ्वी की धरातली में तत्वों के सापेक्ष समृद्धि में]] जर्मेनियम पचासवें स्थान पर स्थित है। 1869 में, [[दिमित्री मेंडेलीव]] ने अपनी [[आवर्त सारणी]] में इसकी स्थिति से इसके अस्तित्व और इसके कुछ [[गुणों]] की [[भविष्यवाणी]] की, और तत्व को '''एकासिलिकॉन''' कहा। 1886 में, फ्रीबर्ग विश्वविद्यालय में [[क्लेमेंस विंकलर]] ने खनिज [[अर्गीरोडाइट]] में [[चांदी]] और [[सल्फर]] के साथ नया तत्व पाया। विंकलर ने तत्व का नाम अपने देश [[जर्मनी]] के नाम पर रखा। जर्मेनियम का खनन मुख्य रूप से [[स्पैलेराइट]] ([[जस्ता|ज़िंक]] का प्राथमिक अयस्क) से किया जाता है, हालांकि जर्मेनियम को व्यावसायिक रूप से [[चांदी, सीसा]] और [[तांबे]] के अयस्कों से भी प्राप्त किया जाता है। | |||
जर्मेनियम तत्व का उपयोग [[ ट्रांजिस्टर |ट्रांजिस्टर]] और विभिन्न अन्य इलेक्ट्रॉनिक उपकरणों में एक अर्धचालक के रूप में किया जाता है। ऐतिहासिक रूप से, अर्धचालक इलेक्ट्रॉनिक्स का पहला दशक पूरी तरह से जर्मेनियम पर आधारित था। वर्तमान में,[[ प्रमुख | प्रमुख]] अंतिम उपयोग [[तंतु प्रकाशिकी तंत्र]], [[ अवरक्त दृष्टि |अवरक्त दृष्टि,]] [[ सौर सेल |सौर सेल]] अनुप्रयोग और [[ प्रकाश उत्सर्जक डायोड |प्रकाश उत्सर्जक डायोड]] (एलईडी) हैं। जर्मेनियम यौगिकों का उपयोग[[ बहुलकीकरण | बहुलकीकरण]] उत्प्रेरक के लिए भी किया जाता है और हाल ही में[[ नैनोवायर | नैनोवायर]] के उत्पादन में इसका उपयोग किया गया है। यह तत्व बड़ी संख्या में [[ऑर्गेनोगरमेनियम यौगिकों]] का निर्माण करता है, जैसे कि [[ टेट्रामेथाइल जर्मेनियम |टेट्रामेथाइल जर्मेनियम]], जो [[ऑर्गनोमेटेलिक रसायन विज्ञान]] में उपयोगी है। जर्मेनियम को [[प्रौद्योगिकी-महत्वपूर्ण तत्व]] माना जाता है।<ref>{{Cite journal|last1=Avarmaa|first1=Katri|last2=Klemettinen|first2=Lassi|last3=O’Brien|first3=Hugh|last4=Taskinen|first4=Pekka|last5=Jokilaakso|first5=Ari|date=June 2019|title=Critical Metals Ga, Ge and In: Experimental Evidence for Smelter Recovery Improvements|journal=Minerals|language=en|volume=9|issue=6|pages=367|doi=10.3390/min9060367|bibcode=2019Mine....9..367A|doi-access=free}}</ref> | |||
जर्मेनियम को किसी भी [[जीवित जीव]] के लिए आवश्यक तत्व नहीं माना जाता है। सिलिकॉन और एल्युमीनियम के समान, प्राकृतिक रूप से मौजूद जर्मेनियम यौगिक जल में अनविलिन होते हैं और इसलिए मौखिक [[ विषाक्तता |विषाक्तता]] में कमी होती है। हालांकि, सिंथेटिक घुलनशील जर्मेनियम लवण[[ नेफ्रोटॉक्सिक ]]होते हैं, और [[ हलोजन |हलोजन]] और [[ हाइड्रोजन |हाइड्रोजन]] के साथ सिंथेटिक रासायनिक रूप से प्रतिक्रियाशील जर्मेनियम यौगिक उत्तेजक और विषाक्त पदार्थ होते हैं। | |||
== इतिहास == | == इतिहास == | ||
[[File:Mendeleev 1869 prediction of germanium (detail).svg|upright|left|thumb |जर्मेनियम की भविष्यवाणी, "?=70" (आवर्त सारणी 1869)]] | |||
1869 में रासायनिक तत्वों के आवधिक कानून पर अपनी रिपोर्ट में, रूसी रसायनज्ञ [[दिमित्री मेंडेलीव]] ने कई अज्ञात [[रासायनिक तत्वों]] के अस्तित्व की भविष्यवाणी की, जिनमें से एक [[सिलिकॉन]] और [[टिन]] के बीच स्थित [[कार्बन परिवार]] में एक अंतर को भर देगा।।<ref>{{cite journal|first=Masanori|last=Kaji|title=D. I. Mendeleev's concept of chemical elements and ''The Principles of Chemistry''|journal=Bulletin for the History of Chemistry|volume=27|issue=1|pages=4–16|year=2002|url=http://www.scs.uiuc.edu/~mainzv/HIST/awards/OPA%20Papers/2005-Kaji.pdf|access-date=2008-08-20|archive-url=https://web.archive.org/web/20081217080509/http://www.scs.uiuc.edu/~mainzv/HIST/awards/OPA%20Papers/2005-Kaji.pdf|archive-date=2008-12-17|url-status=dead }}</ref> अपनी आवर्त सारणी में इसकी स्थिति के कारण, मेंडेलीव ने इसे एकासिलिकॉन (Es) कहा, और उन्होंने इसका [[परमाणु भार]] 70 (बाद में 72) होने का अनुमान लगाया। | |||
[[File:Mendeleev 1869 prediction of germanium (detail).svg|upright|left|thumb |जर्मेनियम की भविष्यवाणी | |||
1869 में रासायनिक तत्वों के आवधिक कानून पर अपनी रिपोर्ट में, रूसी रसायनज्ञ दिमित्री मेंडेलीव ने कई अज्ञात रासायनिक तत्वों के अस्तित्व की भविष्यवाणी की, | |||
1885 के मध्य में, [[फ्रीबर्ग]], [[सैक्सोनी]] के पास एक खदान में, एक नए[[ खनिज ]]की खोज की गई थी और इसकी उच्च [[चांदी]] की सामग्री के कारण इसे [[अरगिरोडाइट]] का नाम दिया गया था।{{NoteTag|From Greek, ''argyrodite'' means ''silver-containing''.<ref>{{cite report|url=http://www.handbookofmineralogy.org/pdfs/argyrodite.pdf|publisher=Mineral Data Publishing|title=Argyrodite – {{chem|Ag|8|GeS|6}}|access-date=2008-09-01|date=|archive-date=2016-03-03|archive-url=https://web.archive.org/web/20160303221645/http://www.handbookofmineralogy.org/pdfs/argyrodite.pdf|url-status=live}}</ref>}} रसायनज्ञ क्लेमेंस विंकलर ने इस नए खनिज का विश्लेषण किया, जो चांदी, सल्फर और एक नए तत्व का संयोजन साबित हुआ। विंक्लर 1886 में नए तत्व को अलग करने में सफल रहे और उसे [[एंटीमनी]] के समान पाया। उन्होंने शुरू में नए तत्व को ईका-एंटीमोनी माना, लेकिन जल्द ही आश्वस्त हो गए कि यह इका-सिलिकॉन है।<ref name="Winkle2" /><ref name="isolation">{{cite journal |journal=Berichte der Deutschen Chemischen Gesellschaft |volume=19 |issue=1 |pages=210–211 |title = Germanium, Ge, a New Nonmetal Element |language = de |first=Clemens |last=Winkler |author-link=Clemens Winkler |year = 1887 |doi=10.1002/cber.18860190156 |url = http://gallica.bnf.fr/ark%3A/12148/bpt6k90705g/f212.chemindefer |url-status=dead |archive-url = https://web.archive.org/web/20081207033757/http://dbhs.wvusd.k12.ca.us/webdocs/Chem-History/Disc-of-Germanium.html |archive-date=December 7, 2008 }}</ref> इससे पहले कि विंकलर नए तत्व पर अपने परिणाम प्रकाशित करें, उन्होंने फैसला किया कि वह अपने तत्व का नाम नेपच्यूनियम रखेंगे, क्योंकि 1846 में [[नेपच्यून]] ग्रह की हालिया खोज इसी तरह इसके अस्तित्व की गणितीय भविष्यवाणियों से पहले हुई थी।{{NoteTag|Just as the existence of the new element had been predicted, the existence of the planet [[Neptune]] had been predicted in about 1843 by the two mathematicians [[John Couch Adams]] and [[Urbain Le Verrier]], using the calculation methods of [[celestial mechanics]]. They did this in attempts to explain the fact that the planet [[Uranus]], upon very close observation, appeared to be being pulled slightly out of position in the sky.<ref>{{cite journal |first=J. C. |last=Adams |bibcode=1846MNRAS...7..149A |title=Explanation of the observed irregularities in the motion of Uranus, on the hypothesis of disturbance by a more distant planet |journal=[[Monthly Notices of the Royal Astronomical Society]] |volume=7 |issue=9 |pages=149–152 |date=November 13, 1846 |doi=10.1093/mnras/7.9.149 |url=https://zenodo.org/record/1431905 |access-date=August 25, 2019 |archive-date=May 2, 2019 |archive-url=https://web.archive.org/web/20190502014753/https://zenodo.org/record/1431905/files/article.pdf |url-status=live }}</ref> [[James Challis]] started searching for it in July 1846, and he sighted this planet on September 23, 1846.<ref>{{cite journal |first=Rev. J. |last=Challis |bibcode=1846MNRAS...7..145C |title=Account of observations at the Cambridge observatory for detecting the planet exterior to Uranus |journal=Monthly Notices of the Royal Astronomical Society |volume=7 |issue=9 |pages=145–149 |date=November 13, 1846 |doi=10.1093/mnras/7.9.145 |url=https://zenodo.org/record/1431903 |access-date=August 25, 2019 |archive-date=May 4, 2019 |archive-url=https://web.archive.org/web/20190504065619/https://zenodo.org/record/1431903/files/article.pdf |url-status=live }}</ref>}} हालांकि, [[ नैप्टुनियम |नेप्च्यूनियम]] नाम पहले से ही एक अन्य प्रस्तावित रासायनिक तत्व को दिया गया था (हालाँकि यह वह तत्व नहीं है जिसे आज [[नेप्च्यूनियम]] नाम दिया गया है, जिसे 1940 में खोजा गया था)।{{NoteTag|R. Hermann published claims in 1877 of his discovery of a new element beneath [[tantalum]] in the periodic table, which he named ''neptunium'', after the Greek god of the oceans and seas.<ref>{{cite book |title=Scientific Miscellany |journal = The Galaxy |volume= 24 |issue= 1 |date=July 1877 |page = 131 |isbn=978-0-665-50166-1 |first = Robert |last = Sears |oclc=16890343 }}</ref><ref>{{cite journal |title=Editor's Scientific Record |journal=Harper's New Monthly Magazine |volume=55 |issue=325 |date=June 1877 |pages=152–153 |url=http://cdl.library.cornell.edu/cgi-bin/moa/moa-cgi?notisid=ABK4014-0055-21 |access-date=2008-09-22 |archive-date=2012-05-26 |archive-url=https://archive.today/20120526215615/http://cdl.library.cornell.edu/cgi-bin/moa/moa-cgi?notisid=ABK4014-0055-21 |url-status=live }}</ref> However this [[metal]] was later recognized to be an [[alloy]] of the elements [[niobium]] and tantalum.<ref>{{cite web| title = Elementymology & Elements Multidict: Niobium| first = Peter| last = van der Krogt| url = http://elements.vanderkrogt.net/element.php?sym=Nb| access-date = 2008-08-20| archive-date = 2010-01-23| archive-url = https://web.archive.org/web/20100123002753/http://elements.vanderkrogt.net/element.php?sym=Nb| url-status = live}}</ref> The name "[[neptunium]]" was later given to the synthetic element one step past [[uranium]] in the Periodic Table, which was discovered by [[nuclear physics]] researchers in 1940.<ref>{{cite book |title=Nobel Lectures, Chemistry 1942–1962 |publisher=Elsevier |date=1964 |chapter=The Nobel Prize in Chemistry 1951: presentation speech |first=A. |last=Westgren |chapter-url=http://nobelprize.org/nobel_prizes/chemistry/laureates/1951/press.html |access-date=2008-09-18 |archive-date=2008-12-10 |archive-url=https://web.archive.org/web/20081210174205/http://nobelprize.org/nobel_prizes/chemistry/laureates/1951/press.html |url-status=live }}</ref>}} इसलिए इसके बजाय, विंकलर ने अपनी मातृभूमि के सम्मान में नए तत्व का नाम जर्मेनियम (जर्मनी के लिए [[लैटिन]] शब्द [[जर्मनिया]] से) रखा।<ref name="isolation" /> आर्गाइरोडाइट अनुभवजन्य रूप से Ag<sub>8</sub>GeS<sub>6</sub> साबित हुआ । क्योंकि इस नए तत्व ने [[आर्सेनिक]] और एंटीमोनी के तत्वों के साथ कुछ समानताएं दिखाईं, इसलिए आवर्त सारणी में इसका उचित स्थान विचाराधीन था, लेकिन दिमित्री मेंडेलीव के पूर्वानुमानित तत्व "एकासिलिकॉन" के साथ इसकी समानता ने आवर्त सारणी में उस स्थान की पुष्टि कर दी।<ref name="isolation" /><ref>{{cite journal |journal = The Manufacturer and Builder |url = http://cdl.library.cornell.edu/cgi-bin/moa/pageviewer?frames=1&coll=moa&view=50&root=%2Fmoa%2Fmanu%2Fmanu0018%2F&tif=00187.TIF |year = 1887 |title = Germanium, a New Non-Metallic Element |page = 181 |access-date = 2008-08-20 |archive-date = 2008-12-19 |archive-url = https://web.archive.org/web/20081219162737/http://cdl.library.cornell.edu/cgi-bin/moa/pageviewer?frames=1&coll=moa&view=50&root=%2Fmoa%2Fmanu%2Fmanu0018%2F&tif=00187.TIF |url-status = live }}</ref> सैक्सोनी की खदानों से 500 किलोग्राम अयस्क से अतिरिक्त सामग्री के साथ, विंकलर ने 1887 में नए तत्व के रासायनिक गुणों की पुष्टि की।<ref name="Winkle2">{{cite journal |first = Clemens |last = Winkler |author-link = Clemens Winkler |journal = J. Prak. Chemie |volume = 36 |issue = 1 |date = 1887 |pages = 177–209 |title = Mittheilungen über des Germanium. Zweite Abhandlung |doi = 10.1002/prac.18870360119 |url = http://gallica.bnf.fr/ark:/12148/bpt6k90799n/f183.table |access-date = 2008-08-20 |language = de |archive-date = 2012-11-03 |archive-url = https://web.archive.org/web/20121103012004/http://gallica.bnf.fr/ark:/12148/bpt6k90799n/f183.table |url-status = live }}</ref><ref name="isolation" /><ref>{{cite journal |first = O. |last = Brunck |title = Obituary: Clemens Winkler |journal = Berichte der Deutschen Chemischen Gesellschaft |volume = 39 |issue = 4 |year = 1886 |pages = 4491–4548 |doi = 10.1002/cber.190603904164 |url = https://zenodo.org/record/1426200 |language = de |access-date = 2020-06-07 |archive-date = 2020-08-01 |archive-url = https://web.archive.org/web/20200801004057/https://zenodo.org/record/1426200 |url-status = live }}</ref> उन्होंने शुद्ध[[ जर्मेनियम टेट्राक्लोराइड | जर्मेनियम टेट्राक्लोराइड ({{chem|GeCl|4}})]] का विश्लेषण करके 72.32 का एक परमाणु भार भी निर्धारित किया, जबकि [[ लेकोक डे बोइसबॉड्रन ]]ने तत्व के स्पार्क[[ स्पेक्ट्रम ]]में रेखाओं की तुलना में 72.3 का अनुमान लगाया।<ref>{{cite journal |title = Sur le poids atomique du germanium |first = M. Lecoq |last = de Boisbaudran |journal = Comptes Rendus |year = 1886 |volume = 103 |page = 452 |url = http://gallica.bnf.fr/ark:/12148/bpt6k3059r/f454.table |access-date = 2008-08-20 |language = fr |archive-date = 2013-06-20 |archive-url = https://web.archive.org/web/20130620032945/http://gallica.bnf.fr/ark:/12148/bpt6k3059r/f454.table |url-status = live }}</ref> | |||
क्योंकि इस नए तत्व ने आर्सेनिक और एंटीमोनी के तत्वों के साथ कुछ समानताएं दिखाईं, इसलिए आवर्त सारणी में इसका उचित स्थान विचाराधीन था, लेकिन दिमित्री | |||
<div style = float: केंद्र;मार्जिन: 5px;> | विंकलर जर्मेनियम के कई नए यौगिकों को तैयार करने में सक्षम थे, जिसमें [[ जर्मेनियम फ्लोराइड |फ्लोराइड]], [[ जर्मेनियम क्लोराइड | क्लोराइड]], [[ जर्मेनियम सल्फाइड |सल्फाइड,]][[ जर्मेनियम डाइऑक्साइड | डाइऑक्साइड]], और[[ टेट्रामेथाइल जर्मेन | टेट्रामेथाइल]] (Ge(C<sub>2</sub>H<sub>5</sub>)<sub>4</sub>) और पहले ऑर्गेनोगरमैन सम्मिलित थे।<ref name="Winkle2" /> उन यौगिकों से प्राप्त भौतिक आंकड़े - जो मेंडेलीव की [[भविष्यवाणियों]] के साथ अच्छी तरह से मेल खाते थे - उसने इस खोज को मेंडेलेयेव के तत्व समय-समय पृष्ठी की महत्वपूर्ण पुष्टि बना दी।<ref name="Winkle2" /> | ||
<div style="float:" केंद्र;मार्जिन: 5px;> | |||
{| class="wikitable" | {| class="wikitable" | ||
|- | |- | ||
! | ! गुण !! एकासिलिकॉन<br />{{nobold|मेंडलीव | ||
भविष्यवाणी (1871)}}!! जर्मेनियम | |||
विंकलर | |||
खोज (1887) | |||
|- | |- | ||
| | | परमाणु भार || 72.64 || 72.63 | ||
|- | |- | ||
| | | घनत्व (g/cm<sup>3</sup>) || 5.5 || 5.35 | ||
|- | |- | ||
| | | गलनांक (°C) || उच्च || 947 | ||
|- | |- | ||
| | | वर्ण || धुमैला || धुमैला | ||
|- | |- | ||
| | | ऑक्साइड प्रकार || [[refractory|दुर्दम्य]] डाइऑक्साइड || दुर्दम्य डाइऑक्साइड | ||
|- | |- | ||
| | | ऑक्साइड घनत्व (g/cm<sup>3</sup>) || 4.7 || 4.7 | ||
|- | |- | ||
| | | ऑक्साइड गतिविधि || क्षीण क्षारकीय || क्षीण क्षारकीय | ||
|- | |- | ||
| | | क्लोराइड क्वथनांक(°C) || 100 से कम || 86 (GeCl<sub>4</sub>) | ||
|- | |- | ||
| | | क्लोराइड घनत्व (g/cm<sup>3</sup>) || 1.9 || 1.9 | ||
|}</div> | |}</div> | ||
1930 के दशक के | 1930 के दशक के अंत तक, जर्मेनियम को खराब संचालन वाली [[धातु]] माना जाता था।<ref name="DOE">{{cite journal |title=Germanium: From Its Discovery to SiGe Devices |author=Haller, E. E. |website=Department of Materials Science and Engineering, University of California, Berkeley, and Materials Sciences Division, Lawrence Berkeley National Laboratory, Berkeley |url=http://www.osti.gov/bridge/servlets/purl/922705-bthJo6/922705.PDF |access-date=2008-08-22 |date=2006-06-14 |archive-date=2019-07-10 |archive-url=https://web.archive.org/web/20190710154435/http://www.osti.gov/bridge/servlets/purl/922705-bthJo6/922705.PDF |url-status=live }}</ref> 1945 के बाद, जब इसे एक [[इलेक्ट्रॉनिक]] अर्धचालक के रूप में पहचाना गया, तब भी जर्मेनियम आर्थिक रूप से महत्वपूर्ण नहीं बना।[[ द्वितीय विश्व युद्ध | द्वितीय विश्व युद्ध]] के दौरान, कुछ विशेष [[इलेक्ट्रॉनिक्स उपकरणों]], जिनमें अधिकतर [[ डायोड |डायोड]] थे, उनमे थोड़ी मात्रा में जर्मेनियम का उपयोग किया गया था।<ref>{{cite news |author = W. K. |url = http://select.nytimes.com/gst/abstract.html?res=F30715FE3F5B157A93C2A8178ED85F478585F9 |newspaper = The New York Times |title = Germanium for Electronic Devices |access-date = 2008-08-22 |date = 1953-05-10 |archive-date = 2013-06-13 |archive-url = https://web.archive.org/web/20130613202934/http://select.nytimes.com/gst/abstract.html?res=F30715FE3F5B157A93C2A8178ED85F478585F9 |url-status = live }}</ref><ref>{{cite web |url = http://www.computerhistory.org/semiconductor/timeline/1941-semiconductor.html |title = 1941 – Semiconductor diode rectifiers serve in WW II |publisher = Computer History Museum |access-date = 2008-08-22 |archive-date = 2008-09-24 |archive-url = https://web.archive.org/web/20080924135754/http://www.computerhistory.org/semiconductor/timeline/1941-semiconductor.html |url-status = live }}</ref> <ref name="DOE" /> पहली [[ सिलिकॉन जर्मेनियम |सिलिकॉन जर्मेनियम]] मिश्र धातु 1955 में प्राप्त की गई थी।<ref>{{cite web |url = http://www.sp.phy.cam.ac.uk/~SiGe/Silicon%20Germanium%20(SiGe)%20History.html |title = SiGe History |publisher = University of Cambridge |access-date = 2008-08-22 |url-status = dead |archive-url = https://web.archive.org/web/20080805204801/http://www.sp.phy.cam.ac.uk/~SiGe/Silicon%20Germanium%20%28SiGe%29%20History.html|archive-date = 2008-08-05 }}</ref> 1945 से पहले, हर साल स्मेल्टरों में केवल कुछ सौ किलोग्राम जर्मेनियम का उत्पादन किया जाता था, लेकिन 1950 के दशक के अंत तक, दुनिया भर में वार्षिक उत्पादन {{convert|40|MT|ST|lk=on|abbr=off}} तक पहुंच गया था।<ref name="acs">{{cite news |url = http://pubs.acs.org/cen/80th/print/germanium.html |year = 2003 |title = Germanium |first = Bethany |last = Halford |work = Chemical & Engineering News |publisher = American Chemical Society |access-date = 2008-08-22 |archive-date = 2008-05-13 |archive-url = https://web.archive.org/web/20080513180858/http://pubs.acs.org/cen/80th/print/germanium.html |url-status = live }}</ref> | ||
1948 में जर्मेनियम ट्रांजिस्टर | |||
इस बीच, [[ फाइबर ऑप्टिक्स | | 1948 में जर्मेनियम ट्रांजिस्टर के विकास<ref>{{cite journal |journal = Physical Review |volume = 74 |issue = 2 |pages = 230–231 |title = The Transistor, A Semi-Conductor Triode |first = J. |last = Bardeen |author2=Brattain, W. H. |year = 1948 |doi = 10.1103/PhysRev.74.230 |bibcode = 1948PhRv...74..230B }}</ref> ने ठोस अवस्था इलेक्ट्रॉनिक्स के अनगिनत अनुप्रयोगों के द्वार खोल दिये।<ref>{{cite web |title = Electronics History 4 – Transistors |url = http://www.greatachievements.org/?id=3967 |publisher = National Academy of Engineering |access-date = 2008-08-22 |archive-date = 2007-10-20 |archive-url = https://web.archive.org/web/20071020030644/http://www.greatachievements.org/?id=3967 |url-status = live }}</ref> 1950 से 1970 के दशक की शुरुआत में, इस क्षेत्र ने जर्मेनियम के लिए एक बढ़ता हुआ बाजार प्रदान किया, लेकिन फिर उच्च-शुद्धता वाले सिलिकॉन ने ट्रांजिस्टर, डायोड और[[ सही करनेवाला | रेक्टिफायर]] में जर्मेनियम की जगह लेना शुरू कर दिया।<ref name="usgs">{{cite journal |title=Germanium – Statistics and Information |author=U.S. Geological Survey |year=2008 |journal=U.S. Geological Survey, Mineral Commodity Summaries |url=http://minerals.usgs.gov/minerals/pubs/commodity/germanium/ |quote=Select 2008 |access-date=2008-08-28 |archive-date=2008-09-16 |archive-url=https://web.archive.org/web/20080916115005/http://minerals.usgs.gov/minerals/pubs/commodity/germanium/ |url-status=live }}</ref> उदाहरण के लिए, [[ फेयरचाइल्ड सेमीकंडक्टर |फेयरचाइल्ड अर्धचालक]] बनने वाली कंपनी की स्थापना 1957 में सिलिकॉन ट्रांजिस्टर के उत्पादन के स्पष्ट उद्देश्य से की गई थी। सिलिकॉन में बेहतर विद्युत गुण होते हैं, लेकिन इसके लिए बहुत अधिक शुद्धता की आवश्यकता होती है जिसे [[सेमीकंडक्टर इलेक्ट्रॉनिक्स|अर्धचालक इलेक्ट्रॉनिक्स]] के शुरुआती वर्षों में व्यावसायिक रूप से हासिल नहीं किया जा सका।<ref>{{cite journal|journal=IEEE Transactions on Electron Devices|volume = ED-23|issue = 7|date=July 1976|title = Single Crystals of Germanium and Silicon-Basic to the Transistor and Integrated Circuit|first = Gordon K.|last = Teal |pages = 621–639|doi=10.1109/T-ED.1976.18464|bibcode=1976ITED...23..621T|s2cid = 11910543}}</ref> | ||
इस बीच, [[ फाइबर ऑप्टिक्स |फाइबर]] [[प्रकाशीय]] संचार नेटवर्क, अवरक्त[[ रात्रि दृष्टि | रात्रि दृष्टि]] प्रणाली और [[बहुलकीकरण]][[ उत्प्रेरक | उत्प्रेरक]] के लिए जर्मेनियम की मांग नाटकीय रूप से बढ़ गई।<ref name="acs" /> ये अंतिम उपयोग 2000 में दुनिया भर में जर्मेनियम की खपत का 85% प्रतिनिधित्व करते थे। <ref name="usgs" /> अमेरिकी सरकार ने 1987 में राष्ट्रीय रक्षा भंडार में 146 [[टन]] (132 [[टन]]) आपूर्ति की मांग करते हुए जर्मेनियम को एक रणनीतिक और महत्वपूर्ण सामग्री के रूप में भी नामित किया।<ref name="acs" /> | |||
जर्मेनियम सिलिकॉन से भिन्न होता है | जर्मेनियम सिलिकॉन से भिन्न होता है क्योकि इसकी आपूर्ति शोषक स्रोतों की उपलब्धता से सीमित होती है, जबकि सिलिकॉन की आपूर्ति केवल उत्पादन क्षमता तक सीमित होती है क्योंकि सिलिकॉन साधारण रेत और [[ क्वार्ट्ज |क्वार्ट्ज]] से आता है। जबकि सिलिकॉन को 1998 में $ 10 प्रति किलोग्राम से कम के लिए खरीदा जा सकता था,<ref name="acs" /> तब जर्मेनियम की कीमत लगभग $ 800 प्रति किलोग्राम थी।<ref name="acs" /> | ||
== विशेषताएँ == | == विशेषताएँ == | ||
मानक परिस्थितियों में, जर्मेनियम एक भंगुर, चांदी-सफेद, अर्ध-धातु तत्व है।<ref name="nbb" />यह रूप α- | [[मानक परिस्थितियों]] में, जर्मेनियम एक भंगुर, चांदी-सफेद, अर्ध-धातु तत्व है।<ref name="nbb" /> यह रूप एक [[एलोट्रोप]] का निर्माण करता है जिसे α-जर्मेनियम के नाम से जाना जाता है, जिसमें एक धातु चमक और[[ हीरा | हीरे]] [[की घन क्रिस्टल संरचना]] होती है, जो [[हीरे]] के समान होती है।<ref name="usgs" /> क्रिस्टल रूप में रहते हुए, जर्मेनियम की विस्थापन सीमा ऊर्जा <math>19.7^{+0.6}_{-0.5}~\text{eV}</math> होती है।<ref>{{Cite journal|last1=Agnese|first1=R.|last2=Aralis|first2=T.|last3=Aramaki|first3=T.|last4=Arnquist|first4=I. J.|last5=Azadbakht|first5=E.|last6=Baker|first6=W.|last7=Banik|first7=S.|last8=Barker|first8=D.|last9=Bauer|first9=D. A.|date=2018-08-27|title=Energy loss due to defect formation from 206Pb recoils in SuperCDMS germanium detectors|journal=Applied Physics Letters|volume=113|issue=9|pages=092101|doi=10.1063/1.5041457|issn=0003-6951|arxiv=1805.09942|bibcode=2018ApPhL.113i2101A|s2cid=118627298}}</ref> 120 [[किलोबार]] से ऊपर के दबाव पर, जर्मेनियम β-[[टिन]] के समान संरचना वाला एलोट्रोप β-जर्मेनियम बन जाता है।<ref name="HollemanAF" /> सिलिकॉन,[[ गैलियम ]], [[ विस्मुट | बिस्मथ]], [[एंटीमनी]] और[[ पानी ]]की तरह, जर्मेनियम उन कुछ पदार्थों में से एक है जो पिघली हुई अवस्था से जमने (यानी [[जमने]]) के साथ फैलता है।<ref name="HollemanAF" /> | ||
जर्मेनियम एक अर्धचालक है।[[ क्षेत्र शोधन ]] तकनीकों ने अर्धचालकों के लिए क्रिस्टलीय जर्मेनियम का उत्पादन किया है, जिसमें 10 | जर्मेनियम एक [[अर्धचालक]] है जिसमें एक [[अप्रत्यक्ष बैंडगैप]] है, जैसा कि क्रिस्टलीन सिलिकॉन में है। [[ क्षेत्र शोधन |ज़ोन शोधन]] तकनीकों ने अर्धचालकों के लिए क्रिस्टलीय जर्मेनियम का उत्पादन किया है, जिसमें 10<sup>10</sup> में केवल एक भाग की अशुद्धता है ,<ref name="lanl">{{cite web | ||
| publisher= Los Alamos National Laboratory | | publisher= Los Alamos National Laboratory | ||
| title= Germanium | | title= Germanium | ||
| Line 63: | Line 66: | ||
| archive-url= https://web.archive.org/web/20110622065850/http://periodic.lanl.gov/32.shtml | | archive-url= https://web.archive.org/web/20110622065850/http://periodic.lanl.gov/32.shtml | ||
| url-status= live | | url-status= live | ||
}}</ref> | }}</ref> जो इसे अब तक प्राप्त सबसे शुद्ध सामग्रियों में से एक बनाती है।<ref> | ||
इसे अब तक प्राप्त सबसे शुद्ध सामग्रियों में से एक | |||
{{cite book | {{cite book | ||
| title= The Primordial Universe: 28 June – 23 July 1999 | | title= The Primordial Universe: 28 June – 23 July 1999 | ||
| Line 75: | Line 77: | ||
| page= 308 | | page= 308 | ||
}} | }} | ||
</ref> | </ref> अत्यंत मजबूत[[ विद्युत चुम्बकीय ]]क्षेत्र की उपस्थिति में एक[[अर्धचालक]] बनने के लिए खोज की गई पहली अर्ध-धातु सामग्री (2005 में) [[जर्मेनियम, यूरेनियम और रोडियम की एक मिश्र धातु]] थी।<ref> | ||
{{cite journal | {{cite journal | ||
| title= Magnetic field-induced superconductivity in the ferromagnet URhGe | | title= Magnetic field-induced superconductivity in the ferromagnet URhGe | ||
| Line 93: | Line 94: | ||
| s2cid= 38460998 }} | | s2cid= 38460998 }} | ||
</ref> | </ref> | ||
शुद्ध जर्मेनियम को बहुत लंबे [[पेंच अव्यवस्थाओं]] को अनायास बाहर निकालने के लिए जाना जाता है, जिसे जर्मेनियम विस्कर्स कहा जाता है। इन विस्कर्स की वृद्धि जर्मेनियम से बने पुराने डायोड और ट्रांजिस्टर की विफलता के लिए प्राथमिक कारणों में से एक है, जैसे कि, वे अंततः क्या छूते हैं, इस पर निर्भर करते हुए, उसके आधार पर, वे [[बिजली की कमी]] का कारण बन सकते हैं।<ref>{{cite journal| title = Morphology of Germanium Whiskers | first = E. I. | last = Givargizov | journal = Kristall und Technik | volume = 7 | issue = 1–3 |doi = 10.1002/crat.19720070107| pages = 37–41| year = 1972}}</ref> | |||
=== रसायन विज्ञान === | === रसायन विज्ञान === | ||
{{category see also| | {{category see also|जर्मेनियम यौगिक}} | ||
तत्वीय जर्मेनियम लगभग 250 डिग्री सेल्सियस पर हवा में धीरे-धीरे ऑक्सीकरण करना शुरू कर देता है, जिससे [[GeO2बनता|GeO<sub>2</sub>बनता]] है।<ref>{{cite journal|doi=10.1016/S0169-4332(98)00251-7|title=KRXPS study of the oxidation of Ge(001) surface|date=1998|author=Tabet, N|journal=Applied Surface Science|volume=134|issue=1–4|pages=275–282|bibcode = 1998ApSS..134..275T|last2=Salim|first2=Mushtaq A. }}</ref> जर्मेनियम तनु[[ अम्ल ]]और [[ क्षारीय |क्षार]] में अघुलनशील होता है, लेकिन गर्म सांद्र सल्फ्यूरिक और नाइट्रिक एसिड में धीरे-धीरे घुल जाता है और पिघले हुए क्षारों के साथ विकर्ण से [[जर्मेनेट]] ({{chem|[GeO|3|]|2−}}) उत्पन्न करने के लिए क्रियाशील होता है। जर्मेनियम अधिकतर ऑक्सीकरण अवस्था +4 में होता है, हालांकि जिसके लिए कई +2 यौगिक ज्ञात हैं। <ref name = "Greenwood">{{Greenwood&Earnshaw}}</ref> अन्य ऑक्सीकरण अवस्थाएँ दुर्लभ हैं, जो +3 Ge<sub>2</sub>Cl<sub>6</sub> जैसे यौगिकों में पाई जाती है, और ऑक्साइड्स की सतह पर +3 और +1 में मिलती हैं, या [[जर्मेनाइड्स]] में नकारात्मक आक्सीकरण स्थितियाँ, जैसे कि {{chem|Mg|2|Ge}} में −4 के रूप में मिलती है।<ref>{{cite journal|doi=10.1016/S0368-2048(98)00451-4|title=XPS study of the growth kinetics of thin films obtained by thermal oxidation of germanium substrates|first3=A. L.|last3=Al-Oteibi|first2=M. A.|date=1999|last2=Salim|author=Tabet, N|journal=Journal of Electron Spectroscopy and Related Phenomena|volume=101–103|pages=233–238}}</ref> जर्मेनियम क्लस्टर आयन ([[ज़िंटल]] आयन) जैसे Ge<sub>4</sub><sup>2−</sup>, Ge<sub>9</sub><sup>4−</sup>, Ge<sub>9</sub><sup>2−</sup>, [(Ge<sub>9</sub>)<sub>2</sub>]<sup>6−</sup> को [[एथिलीनडायमाइन]] या [[क्रिप्टैंड]] की उपस्थिति में तरल अमोनिया में क्षार धातुओं और जर्मेनियम युक्त मिश्र धातुओं से निष्कर्षण द्वारा तैयार किया गया है। इन आयनों में [[ओजोनाइड्स]] O<sub>3</sub><sup>−</sup> की तरह तत्व की आक्सीकरण अवस्थाएँ पूर्णांक नहीं होतीं हैं। | |||
जर्मेनियम के दो [[ ऑक्साइड |ऑक्साइड]] ज्ञात हैं, जिन्हें [[जर्मेनियम डाइऑक्साइड]] ({{chem|GeO|2}}, जर्मेनिया) और[[ जर्मेनियम मोनोऑक्साइड | जर्मेनियम मोनोऑक्साइड]] ({{chem|GeS|2}}), , ({{chem|GeO}}) कहते है।<ref name="HollemanAF">{{cite book|last = Holleman|first = A. F.|author2=Wiberg, E.|author3=Wiberg, N.|title=Lehrbuch der Anorganischen Chemie|edition=102nd|publisher=de Gruyter|date=2007|isbn=978-3-11-017770-1|oclc = 145623740}}</ref> डाइऑक्साइड, GeO<sub>2</sub> [[ जर्मेनियम डिसल्फाइड |जर्मेनियम डाइसल्फ़ाइड (]]{{chem|GeS|2}}[[ जर्मेनियम डिसल्फाइड |)]] को भर्जन करके प्राप्त किया जा सकता है, और यह एक सफेद पाउडर है जो केवल पानी में थोड़ा घुलनशील है, लेकिन जर्मेनेट बनाने के लिए क्षार के साथ प्रतिक्रिया करता है।<ref name="HollemanAF" /> मोनोऑक्साइड, जर्मन ऑक्साइड, GeO<sub>2</sub> को तत्वीय जर्मेनियम के साथ उच्च तापमान पर प्रतिक्रिया करके प्राप्त किया जा सकता है।<ref name="HollemanAF" /> जो डाइऑक्साइड (और संबंधित ऑक्साइड्स और जर्मेनेट्स) बताता है उसमें एक असामान्य गुण होता है कि वह दृष्टिगत प्रकाश के लिए एक उच्च अपवर्तक सूचकांक रखता है, लेकिन [[अवरक्त]] प्रकाश के लिए पारदर्शी होता है।<ref>{{cite journal|doi = 10.1111/j.1151-2916.2002.tb00594.x|title = Infrared Transparent Germanate Glass-Ceramics|first = Shyam S.|last = Bayya|author2=Sanghera, Jasbinder S.|author3=Aggarwal, Ishwar D.|author4=Wojcik, Joshua A.|journal = Journal of the American Ceramic Society|volume = 85|issue = 12|pages= 3114–3116|date = 2002}}</ref><ref>{{cite journal|doi = 10.1007/BF00614256|title = Infrared reflectance and transmission spectra of germanium dioxide and its hydrolysis products|date = 1975 |last1 = Drugoveiko|first1 = O. P.|journal = Journal of Applied Spectroscopy|volume = 22|issue = 2|pages = 191–193|last2 = Evstrop'ev|first2 = K. K.|last3 = Kondrat'eva|first3 = B. S.|last4 = Petrov|first4 = Yu. A.|last5 = Shevyakov|first5 = A. M.|bibcode=1975JApSp..22..191D|s2cid = 97581394}}</ref> [[ बिस्मथ जर्मनट |बिस्मथ जर्मनट]], Bi<sub>4</sub>Ge<sub>3</sub>O<sub>12</sub> (BGO) का उपयोग[[ सिंटिलेटर | प्रस्फुरक]] के रूप में किया जाता है।<ref name="BGO">{{cite journal|title = A Bismuth Germanate-Avalanche Photodiode Module Designed for Use in High Resolution Positron Emission Tomography|last = Lightstone|first = A. W.|author2=McIntyre, R. J.|author3=Lecomte, R.|author4=Schmitt, D.|journal = IEEE Transactions on Nuclear Science| date = 1986|volume =33|issue= 1|pages = 456–459|doi =10.1109/TNS.1986.4337142|bibcode = 1986ITNS...33..456L |s2cid = 682173}}</ref> | |||
अन्य[[ काल्कोजन | चाकोजेन]] के साथ [[द्विआधारी यौगिकों]] को भी जाना जाता है, जिनमे [[ सल्फाइड |डाइसल्फ़ाइड]] ({{chem|GeS|2}}), [[ selenide |डाइसल्फ़ाइड]] ({{chem|GeSe|2}}), और [[ जर्मेनियम मोनोसल्फाइड |मोनोसल्फाइड]] (GeS), और [[ टेलुराइड (रसायन विज्ञान) |मोनोटेल्यूराइड]] (GeTe) आदि सम्मिलित है।<ref name="Greenwood" /> जब हाइड्रोजन सल्फाइड को Ge(IV) युक्त प्रबल अम्लीय घोल से गुजारा जाता है तो GeS<sub>2</sub> एक सफेद अवक्षेप के रूप में बनता है।<ref name="Greenwood" /> डाइसल्फ़ाइड पानी में और कास्टिक क्षार या क्षारीय सल्फाइड के विलयन में काफी घुलनशील है। फिर भी, यह अम्लीय पानी में घुलनशील नहीं है, जिसने विंकलर को तत्व की खोज करने की अनुमति मिलती है।<ref>{{cite journal|first =Otto H.|last = Johnson|title = Germanium and its Inorganic Compounds|journal = Chem. Rev.|date = 1952|volume= 51|issue =3| pages=431–469|doi = 10.1021/cr60160a002}}</ref> डाइसल्फ़ाइड को [[हाइड्रोजन]] की धारा में गर्म करने से मोनोसल्फाइड (GeS) बनता है, जो गहरे रंग और धात्विक चमक की पतली प्लेटों में उर्ध्वपातित हो जाता है और कास्टिक क्षार के घोल में घुलनशील होता है।<ref name="HollemanAF" /> [[क्षारीय कार्बोनेट]] और [[सल्फर]] के साथ पिघलने पर, जर्मेनियम यौगिक थियोजर्मनेट नामक लवण बनाते हैं।<ref>{{cite journal|doi=10.1039/a703634e|title=First synthesis of mesostructured thiogermanates|date=1997|last1 = Fröba|first1 = Michael |journal=Chemical Communications|issue=18|pages=1729–1730|last2=Oberender|first2=Nadine}}</ref> | |||
[[File:Germane-2D-dimensions.png|upright|left|thumb|जर्मन [[मीथेन]] के समान है।]] | |||
चार टेट्रा[[हालाइड्स]] ज्ञात हैं। सामान्य परिस्थितियों में GEI<sub>4</sub> एक ठोस, GeF<sub>4</sub> एक गैस और अन्य अस्थिर तरल पदार्थ हैं। उदाहरण के लिए, [[जर्मेनियम टेट्राक्लोराइड]], GeCl<sub>4</sub>, धातु को क्लोरीन के साथ गर्म करके 83.1 डिग्री सेल्सियस पर उबलते हुए एक रंगहीन धूआं तरल के रूप में प्राप्त किया जाता है।<ref name="HollemanAF" />सभी टेट्राहालाइड आसानी से हाइड्रेटेड जर्मेनियम डाइऑक्साइड के लिए हाइड्रोलाइज्ड हो जाते हैं।<ref name="HollemanAF" /> GeCl<sub>4</sub> का उपयोग ऑर्गेनोगरमेनियम यौगिकों के के उत्पादन में किया जाता है।<ref name = "Greenwood" /> सभी चार डायहालाइड्स ज्ञात हैं जोकि टेट्राहालाइड्स के विपरीत बहुलक ठोस हैं।<ref name = "Greenwood" /> इसके अतिरिक्त Ge<sub>2</sub>Cl<sub>6</sub> और Ge<sub>''n''</sub>Cl<sub>2''n''+2</sub> सूत्र के कुछ उच्च यौगिक ज्ञात हैं।<ref name="HollemanAF" /> असामान्य यौगिक Ge<sub>6</sub>Cl<sub>16</sub> तैयार किया गया है जिसमें [[नियोपेंटेन]] संरचना वाली Ge<sub>5</sub>Cl<sub>12</sub>इकाई सम्मिलित है।<ref>{{cite journal|title = The Crystal Structure and Raman Spectrum of Ge<sub>5</sub>Cl<sub>12</sub>·GeCl<sub>4</sub> and the Vibrational Spectrum of Ge<sub>2</sub>Cl<sub>6</sub>| last = Beattie|first = I.R.|author2=Jones, P.J.|author3=Reid, G.|author4=Webster, M.|journal = Inorg. Chem.|volume = 37|issue =23|pages = 6032–6034|date = 1998|doi =10.1021/ic9807341|pmid = 11670739}}</ref> | |||
[[जर्मेन]] (GeH<sub>4</sub>) [[मीथेन]] की संरचना के समान एक यौगिक है। पॉलीजर्मेन्स—जो [[एल्केनों]] के समान यौगिक होते हैं—जिनका सूत्र Ge<sub>''n''</sub>H<sub>2''n''+2</sub> है, जिनमें पाँच जर्मेनियम परमाणु तक हो सकते हैं, वे जाने जाते हैं।<ref name="Greenwood" /> जर्मन उनके संबंधित सिलिकॉन समकक्षों की तुलना में कम अस्थिर और कम प्रतिक्रियाशील होते हैं।<ref name="Greenwood" /> GeH<sub>4</sub> तरल अमोनिया में क्षार धातुओं के साथ प्रतिक्रिया करके सफेद क्रिस्टलीय MGeH<sub>3</sub> बनाता है जिसमें [[GeH3− आयन|GeH<sub>3</sub><sup>−</sup> आयन]] होता है।<ref name="Greenwood" /> एक, दो और तीन हैलोजन परमाणुओं के साथ जर्मेनियम हाइड्रोहलिड्स रंगहीन प्रतिक्रियाशील तरल पदार्थ हैं।<ref name="Greenwood" /> | |||
[[File:NucleophilicAdditionWithOrganogermanium.png|right|thumb|upright=1.25| ऑर्गेनोगर्मेनियम यौगिक के साथ न्यूक्लियोफिलिक जोड़]] | |||
पहला [[ऑर्गेनोगर्मेनियम]] [[यौगिक]] 1887 में विंकलर द्वारा संश्लेषित किया गया था, जो [[डायथाइलजिंक]] के साथ जर्मेनियम टेट्राक्लोराइड की प्रतिक्रिया से [[टेट्रैथाइलगर्मन]] ({{chem|Ge(C|2|H|5|)|4}}) से प्राप्त हुआ।<ref name="Winkle2" /> R<sub>4</sub>Ge प्रकार (जहाँ R एक [[ एल्काइल |एल्काइल]] है) जैसे टेट्रामेथिलगर्मेन ({{chem|Ge(C||H|3|)|4}}) और [[ टेट्रामेथाइलगर्मन |टेट्रामेथाइलगर्मन]] के ऑर्गनोजर्मेन तक सबसे सस्ते उपलब्ध जर्मेनियम अग्रदूत [[जर्मेनियम टेट्राक्लोराइड]] और एल्काइल न्यूक्लियोफाइल के माध्यम से अभिगम करते है। कार्बनिक जर्मेनियम हाइड्राइड्स जैसे कि[[ isobutylgermane | आइसोब्यूटाइलगर्मेन]] ({{chem|(CH|3|)|2|CHCH|2|GeH|3}}) कम खतरनाक पाए गए और [[अर्धचालक]] अनुप्रयोगों में विषाक्त जर्मेनियम गैस के लिए एक तरल विकल्प के रूप में उपयोग किया जा सकता है। कई जर्मेनियम [[ प्रतिक्रियाशील मध्यवर्ती |प्रतिक्रियाशील मध्यवर्ती]] ज्ञात हैं, जिन्हें [[जर्माइल मुक्त कण,]] जर्माइलीन ([[कार्बाइन]] के समान), और जर्मिनेस ([[कार्बाइन]] के समान) कहा जाता है।<ref>{{cite journal|title = Reactive intermediates in organogermanium chemistry|first = Jacques|last = Satge|journal = Pure Appl. Chem.|volume = 56|issue = 1|pages = 137–150|date =1984|doi = 10.1351/pac198456010137|s2cid = 96576323}}</ref><ref>{{cite journal|title = Organogermanium Chemistry| first = Denis|last = Quane|author2=Bottei, Rudolph S.|journal = Chemical Reviews|volume = 63|issue = 4|pages = 403–442|date =1963|doi = 10.1021/cr60224a004}}</ref> ऑर्गेनोगरमेनियम कंपाउंड [[कार्बोक्सैथाइलगर्मेसक्यूएक्सेन]] को पहली बार 1970 के दशक में रिपोर्ट किया गया था, और कुछ समय के लिए इसे अनुपूरक के रूप में उपयोग किया गया था और माना जाता था कि इसमें संभवतः ट्यूमर-विरोधी गुण हैं।<ref name="toxic" /> | |||
आइंड (1,1,3,3,5,5,5,7,7-ऑक्टाएथिल-s-हाइड्रिंडासेन-4-yl) नामक लिगैंड का उपयोग करके जर्मेनियम ऑक्सीजन (जर्मेनोन) के साथ दोहरा बंधन बनाने में सक्षम है।जर्मेनियम हाइड्राइड और जर्मेनियम टेट्राहाइड्राइड हवा के साथ मिश्रित होने पर अत्यधिक ज्वलनशील और यहां तक कि विस्फोटक होते हैं।<ref>{{cite news|last=Broadwith|first=Phillip|title=Germanium-oxygen double bond takes centre stage|url=http://www.rsc.org/chemistryworld/News/2012/March/germanone-germanium-oxygen-double-bond-created.asp|access-date=2014-05-15|newspaper=Chemistry World|date=25 March 2012|archive-date=2014-05-17|archive-url=https://web.archive.org/web/20140517121351/http://www.rsc.org/chemistryworld/News/2012/March/germanone-germanium-oxygen-double-bond-created.asp|url-status=live}}</ref> | |||
=== समस्थानिक === | |||
{{main|जर्मेनियम के समस्थानिक}} | |||
[[ | जर्मेनियम 5 प्राकृतिक[[ आइसोटोप | समस्थानिकों]] में होता है, जिसमे {{SimpleNuclide|Germanium|70}}, {{SimpleNuclide|Germanium|72}}, {{SimpleNuclide|Germanium|73}}, {{SimpleNuclide|Germanium|74}}, तथा {{SimpleNuclide|Germanium|76}} सम्मिलित है। इनमे से, {{SimpleNuclide|Germanium|76}} बहुत कम रेडियोधर्मी है, जो {{val|1.78|e=21|u=वर्षों}} के [[आधे जीवन]] के साथ [[ डबल बीटा क्षय |दोहरे बीटा क्षय]] द्वारा क्षय हो रहा है। {{SimpleNuclide|Germanium|74}} सबसे सामान्य समस्थानिक है, जिसकी[[ प्राकृतिक बहुतायत | प्राकृतिक प्रचुरता]] लगभग 36% है। {{SimpleNuclide|Germanium|76}} लगभग 7%की प्राकृतिक प्रचुरता के साथ सबसे कम सामान्य है।<ref name="nubase">{{NUBASE 2003}}</ref> जब अल्फा कणों के साथ बमबारी की जाती है, तो समस्थानिक {{SimpleNuclide|Germanium|72}} स्थिर {{SimpleNuclide|Selenium|77|link=yes}} उत्पन्न करेगा, जो प्रक्रिया में उच्च ऊर्जा इलेक्ट्रॉनों को मुक्त करता है।<ref name="72Ge" /> इस वजह से, इसका उपयोग [[ परमाणु बैटरी | परमाणु बैटरियों]] के लिए[[ रेडॉन ]]के साथ संयोजन में किया जाता है।<ref name="72Ge">Perreault, Bruce A. [http://www.google.com/patents/US7800286 "Alpha Fusion Electrical Energy Valve"], US Patent 7800286, issued September 21, 2010. {{webarchive |url=https://web.archive.org/web/20071012103442/http://www.nuenergy.org/disclosures/AlphaFusionPatent_05-04-2007.pdf |date=October 12, 2007 |title=PDF copy }}</ref> | ||
कम से कम 27 [[ रेडियो आइसोटोप |रेडियो समस्थानिक]] को भी संश्लेषित किया गया है, जिनका परमाणु द्रव्यमान 58 से 89 तक है। इनमें से सबसे स्थिर {{SimpleNuclide|Germanium|68}} है , जो [[इलेक्ट्रॉन परिग्रहण]] के साथ अवसान होता है, जिसका आधा-जीवनकाल 270.95 दिन है। सबसे अस्थायी {{SimpleNuclide|Germanium|60}} है, जिसका आधा-जीवनकाल {{val|30|ul=मिलीसेकंड}} है। जबकि जर्मेनियम के अधिकांश विकिरण समस्थानिक [[ बीटा क्षय |बीटा क्षय]] द्वारा क्षय होते हैं, जो {{SimpleNuclide|Germanium|61}} और {{SimpleNuclide|Germanium|64}} {{SubatomicParticle|beta+}} विलंबित [[प्रोटॉन उत्सर्जन]] के साथ क्षय होते हैं।<ref name="nubase" /> {{SimpleNuclide|Germanium|84}} के {{SimpleNuclide|Germanium|87}} समस्थानिक के माध्यम से भी अल्प [[विलंबित न्यूट्रॉन|{{SubatomicParticle|beta-}} विलंबित न्यूट्रॉन]] उत्सर्जन अवसान पथ दिखाते हैं।<ref name="nubase" /> | |||
कम से कम 27 [[ रेडियो आइसोटोप ]] को भी संश्लेषित किया गया है, परमाणु द्रव्यमान | |||
=== घटना === | === घटना === | ||
{{category see also|जर्मेनियम खनिज}} | {{category see also|जर्मेनियम खनिज}} | ||
| Line 118: | Line 125: | ||
जर्मेनियम[[ तारकीय न्यूक्लियोसिंथेसिस ]]द्वारा उत्पन्न होता है, जो अधिकतर [[एस-प्रक्रिया|s-प्रक्रिया]] के माध्यम से उपगामी [[ लाल विशाल |विशाल शाखा तारो]] में होता है। s-प्रक्रिया स्पंदित [[लाल विशाल]] तारों के अंदर हल्के तत्वों को धीमी गति से [[न्यूट्रॉन]] प्रग्रहण करने की प्रक्रिया है।<ref name="sterling">{{cite journal|journal=The Astrophysical Journal Letters|volume=578|issue=1|pages=L55–L58|doi=10.1086/344473|title=Discovery of Enhanced Germanium Abundances in Planetary Nebulae with the Far Ultraviolet Spectroscopic Explorer|first=N. C.|last=Sterling|author2=Dinerstein, Harriet L.|author3=Bowers, Charles W.|bibcode=2002ApJ...578L..55S|arxiv=astro-ph/0208516 |year=2002|s2cid=119395123|author2-link=Harriet Dinerstein}}</ref> जर्मेनियम को कुछ सबसे दूर के तारों और बृहस्पति के वायुमंडल में पाया गया है।<ref>{{cite journal|journal=Nature|volume=423|issue= 29|date=2003-05-01| pmid=12721614| doi=10.1038/423029a|title=Astronomy: Elements of surprise| last=Cowan|first=John| page=29|bibcode=2003Natur.423...29C |s2cid=4330398}}</ref> <ref>{{cite journal| title= The tropospheric gas composition of Jupiter's north equatorial belt /NH<sub>3</sub>, PH<sub>3</sub>, CH<sub>3</sub>D, GeH<sub>4</sub>, H<sub>2</sub>O/ and the Jovian D/H isotopic ratio| last=Kunde| first=V.|author2=Hanel, R. |author3=Maguire, W. |author4=Gautier, D. |author5=Baluteau, J. P. |author6=Marten, A. |author7=Chedin, A. |author8=Husson, N. |author9= Scott, N. |journal=Astrophysical Journal| volume= 263|date= 1982|pages= 443–467|doi=10.1086/160516| bibcode=1982ApJ...263..443K}}</ref> | जर्मेनियम[[ तारकीय न्यूक्लियोसिंथेसिस ]]द्वारा उत्पन्न होता है, जो अधिकतर [[एस-प्रक्रिया|s-प्रक्रिया]] के माध्यम से उपगामी [[ लाल विशाल |विशाल शाखा तारो]] में होता है। s-प्रक्रिया स्पंदित [[लाल विशाल]] तारों के अंदर हल्के तत्वों को धीमी गति से [[न्यूट्रॉन]] प्रग्रहण करने की प्रक्रिया है।<ref name="sterling">{{cite journal|journal=The Astrophysical Journal Letters|volume=578|issue=1|pages=L55–L58|doi=10.1086/344473|title=Discovery of Enhanced Germanium Abundances in Planetary Nebulae with the Far Ultraviolet Spectroscopic Explorer|first=N. C.|last=Sterling|author2=Dinerstein, Harriet L.|author3=Bowers, Charles W.|bibcode=2002ApJ...578L..55S|arxiv=astro-ph/0208516 |year=2002|s2cid=119395123|author2-link=Harriet Dinerstein}}</ref> जर्मेनियम को कुछ सबसे दूर के तारों और बृहस्पति के वायुमंडल में पाया गया है।<ref>{{cite journal|journal=Nature|volume=423|issue= 29|date=2003-05-01| pmid=12721614| doi=10.1038/423029a|title=Astronomy: Elements of surprise| last=Cowan|first=John| page=29|bibcode=2003Natur.423...29C |s2cid=4330398}}</ref> <ref>{{cite journal| title= The tropospheric gas composition of Jupiter's north equatorial belt /NH<sub>3</sub>, PH<sub>3</sub>, CH<sub>3</sub>D, GeH<sub>4</sub>, H<sub>2</sub>O/ and the Jovian D/H isotopic ratio| last=Kunde| first=V.|author2=Hanel, R. |author3=Maguire, W. |author4=Gautier, D. |author5=Baluteau, J. P. |author6=Marten, A. |author7=Chedin, A. |author8=Husson, N. |author9= Scott, N. |journal=Astrophysical Journal| volume= 263|date= 1982|pages= 443–467|doi=10.1086/160516| bibcode=1982ApJ...263..443K}}</ref> | ||
जर्मेनियम की [[पृथ्वी की धरा]] में विशेषज्ञता लगभग 1.6 [[पीपीएम]] है।<ref name="Holl">{{cite journal| doi=10.1016/j.oregeorev.2005.07.034|title=Metallogenesis of germanium – A review|first=R.|last=Höll|author2=Kling, M.|author3=Schroll, E.| journal=Ore Geology Reviews|volume=30|issue=3–4|date=2007| pages=145–180}}</ref> केवल कुछ ही खनिज जैसे [[आर्गाइरोडाइट, ब्राइआरटाइट, जर्मेनाइट, रेनिएराइट]] और [[स्फैलराइट]] में जर्मेनियम की पर्याप्त मात्रा होती है।<ref name="usgs" /><ref>{{Cite journal|url=https://www.researchgate.net/publication/309583931|title=The distribution of gallium, germanium and indium in conventional and non-conventional resources – Implications for global availability (PDF Download Available)|website=ResearchGate|doi=10.13140/rg.2.2.20956.18564|access-date=2017-06-10|last1=Frenzel|first1=Max|year=2016|publisher=Unpublished|archive-date=2018-10-06|archive-url=https://web.archive.org/web/20181006235214/https://www.researchgate.net/publication/309583931|url-status=live}}</ref> उनमें से केवल कुछ ही (विशेष रूप से जर्मेनाइट), बहुत कम, खनन योग्य मात्रा में पाए जाते हैं।<ref>{{cite journal|url=https://www.researchgate.net/publication/250273740|title=Eyselite, Fe3+Ge34+O7(OH), a new mineral species from Tsumeb, Namibia|journal=The Canadian Mineralogist|volume=42|issue=6|pages=1771–1776|date=December 2004|doi=10.2113/gscanmin.42.6.1771|first1=Andrew C.|last1=Roberts|display-authors=etal}}</ref><ref>{{Cite web |url=https://www.deutsche-rohstoffagentur.de/DERA/DE/Downloads/vortrag_germanium.pdf?__blob=publicationFile&v=2 |title=Archived copy |access-date=2018-10-06 |archive-date=2018-10-06 |archive-url=https://web.archive.org/web/20181006234914/https://www.deutsche-rohstoffagentur.de/DERA/DE/Downloads/vortrag_germanium.pdf?__blob=publicationFile&v=2 |url-status=live }}</ref><ref>{{Cite web |url=http://tupa.gtk.fi/raportti/arkisto/070_peh_76.pdf |title=Archived copy |access-date=2018-10-06 |archive-date=2020-03-20 |archive-url=https://web.archive.org/web/20200320190457/http://tupa.gtk.fi/raportti/arkisto/070_peh_76.pdf |url-status=live }}</ref> कुछ जिंक–तांबा–सीसा अयस्क निकायों में इतना जर्मेनियम होता है जो अंतिम अयस्क संघटन से निकालने के लिए पर्याप्त होता है।<ref name="Holl" /> कुछ कोयले की परतों में जर्मेनियम की उच्च सामग्री का कारण एक असामान्य प्राकृतिक समृद्धि प्रक्रिया होती है, जिसे जर्मेनियम के खनन स्थलों के लिए विस्तृत सर्वेक्षण के दौरान [[विक्टर मौरित्स गोल्डश्मिट]] ने खोजा।<ref name="Gold1">{{cite journal|journal=Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse|title=Ueber das Vorkommen des Germaniums in Steinkohlen und Steinkohlenprodukten|last=Goldschmidt|first=V. M.|pages=141–167|date=1930|url=http://resolver.sub.uni-goettingen.de/purl?GDZPPN002508303|access-date=2008-08-25|archive-date=2018-03-03|archive-url=https://web.archive.org/web/20180303165042/http://resolver.sub.uni-goettingen.de/purl?GDZPPN002508303|url-status=live}}</ref><ref name="Gold2">{{cite journal|journal=Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse|title=Zur Geochemie des Germaniums|last=Goldschmidt|first=V. M.|author2=Peters, Cl.|pages=141–167|url=http://resolver.sub.uni-goettingen.de/purl?GDZPPN002509180|date=1933|access-date=2008-08-25|archive-date=2008-12-01|archive-url=https://web.archive.org/web/20081201115130/http://resolver.sub.uni-goettingen.de/purl/?GDZPPN002509180|url-status=live}}</ref> अब तक की सबसे अधिक सांद्रता [[हार्टले]] कोयले की राख में 1.6% जर्मेनियम के साथ पाई गई।।<ref name="Gold1" /><ref name="Gold2" /> [[ आंतरिक मंगोलिया |भीतरी मंगोलिया]] के [[ज़िलिनहाओटे]] के पास कोयले के भंडार में, अनुमानित 1600 [[टन]] जर्मेनियम है।<ref name="Holl" /> | |||
== उत्पादन == | == उत्पादन == | ||
2011 में दुनिया भर में लगभग 118 [[टन]] जर्मेनियम का उत्पादन किया गया, जिसमें प्रमुख रूप से चीन (80 टन), रूस (5 टन) और संयुक्त राज्य अमेरिका (3 टन) सम्मिलित थे।<ref name="usgs" /> जर्मेनियम को स्पैलेराइट जिंक अयस्कों से एक उप-उत्पाद के रूप में प्राप्त किया जाता है, विशेष रूप से कम तापमान वाले तलछट-आश्रित, बड़े पैमाने पर [[Zn-Pb-Cu(-Ba)]] निक्षेप और कार्बोनेट-आश्रित Zn-Pb निक्षेप से जहां यह 0.3% तक की मात्रा में केंद्रित होता है।<ref>{{cite journal|doi=10.1016/0016-7037(85)90241-8|title=Germanium geochemistry and mineralogy|date=1985|author=Bernstein, L|journal=Geochimica et Cosmochimica Acta|volume=49|issue=11|pages=2409–2422|bibcode = 1985GeCoA..49.2409B }}</ref><ref>{{Cite journal|title = Gallium, germanium, indium and other minor and trace elements in sphalerite as a function of deposit type – A meta-analysis|last1 = Frenzel|first1 = Max|date = July 2016|journal = Ore Geology Reviews|doi = 10.1016/j.oregeorev.2015.12.017|last2 = Hirsch|first2 = Tamino|last3 = Gutzmer|first3 = Jens|volume = 76|pages = 52–78}}</ref> हाल ही के एक अध्ययन में पाया गया है कि कम से कम 10,000 टन निकालने योग्य जर्मेनियम ज्ञात जिंक संरक्षणों में है, विशेषकर [[मिसिसिपी-वैली प्रकार के जमीनों में]], जबकि कम से कम 112,000 टन कोयले के संरक्षणों में पाया जाएगा।<ref>{{Cite journal|title = On the geological availability of germanium|journal = Mineralium Deposita|date = 2013-12-29|issn = 0026-4598|pages = 471–486|volume = 49|issue = 4|doi = 10.1007/s00126-013-0506-z|first1 = Max|last1 = Frenzel|first2 = Marina P.|last2 = Ketris|first3 = Jens|last3 = Gutzmer|bibcode = 2014MinDe..49..471F|s2cid = 129902592}}</ref><ref>{{Cite journal|title = Erratum to: On the geological availability of germanium|journal = Mineralium Deposita|date = 2014-01-19|issn = 0026-4598|page = 487|volume = 49|issue = 4|doi = 10.1007/s00126-014-0509-4|first1 = Max|last1 = Frenzel|first2 = Marina P.|last2 = Ketris|first3 = Jens|last3 = Gutzmer|bibcode = 2014MinDe..49..487F|s2cid = 140620827}}</ref> 2007 में 35% मांग को पुनर्नवीनीकरण जर्मेनियम द्वारा पूरा किया गया था।<ref name="Holl" /> | 2011 में दुनिया भर में लगभग 118 [[टन]] जर्मेनियम का उत्पादन किया गया, जिसमें प्रमुख रूप से चीन (80 टन), रूस (5 टन) और संयुक्त राज्य अमेरिका (3 टन) सम्मिलित थे।<ref name="usgs" /> जर्मेनियम को स्पैलेराइट जिंक अयस्कों से एक उप-उत्पाद के रूप में प्राप्त किया जाता है, विशेष रूप से कम तापमान वाले तलछट-आश्रित, बड़े पैमाने पर [[Zn-Pb-Cu(-Ba)]] निक्षेप और कार्बोनेट-आश्रित Zn-Pb निक्षेप से जहां यह 0.3% तक की मात्रा में केंद्रित होता है।<ref>{{cite journal|doi=10.1016/0016-7037(85)90241-8|title=Germanium geochemistry and mineralogy|date=1985|author=Bernstein, L|journal=Geochimica et Cosmochimica Acta|volume=49|issue=11|pages=2409–2422|bibcode = 1985GeCoA..49.2409B }}</ref><ref>{{Cite journal|title = Gallium, germanium, indium and other minor and trace elements in sphalerite as a function of deposit type – A meta-analysis|last1 = Frenzel|first1 = Max|date = July 2016|journal = Ore Geology Reviews|doi = 10.1016/j.oregeorev.2015.12.017|last2 = Hirsch|first2 = Tamino|last3 = Gutzmer|first3 = Jens|volume = 76|pages = 52–78}}</ref> हाल ही के एक अध्ययन में पाया गया है कि कम से कम 10,000 टन निकालने योग्य जर्मेनियम ज्ञात जिंक संरक्षणों में है, विशेषकर [[मिसिसिपी-वैली प्रकार के जमीनों में]], जबकि कम से कम 112,000 टन कोयले के संरक्षणों में पाया जाएगा।<ref>{{Cite journal|title = On the geological availability of germanium|journal = Mineralium Deposita|date = 2013-12-29|issn = 0026-4598|pages = 471–486|volume = 49|issue = 4|doi = 10.1007/s00126-013-0506-z|first1 = Max|last1 = Frenzel|first2 = Marina P.|last2 = Ketris|first3 = Jens|last3 = Gutzmer|bibcode = 2014MinDe..49..471F|s2cid = 129902592}}</ref><ref>{{Cite journal|title = Erratum to: On the geological availability of germanium|journal = Mineralium Deposita|date = 2014-01-19|issn = 0026-4598|page = 487|volume = 49|issue = 4|doi = 10.1007/s00126-014-0509-4|first1 = Max|last1 = Frenzel|first2 = Marina P.|last2 = Ketris|first3 = Jens|last3 = Gutzmer|bibcode = 2014MinDe..49..487F|s2cid = 140620827}}</ref> 2007 में 35% मांग को पुनर्नवीनीकरण जर्मेनियम द्वारा पूरा किया गया था।<ref name="Holl" /> | ||
| Line 171: | Line 178: | ||
|} | |} | ||
</div> | </div> | ||
जबकि यह मुख्य रूप से [[स्पैलेराइट]] से निर्मित होता है, तथा यह [[चांदी, सीसा]] और [[तांबे]] के अयस्कों में भी पाया जाता है। जर्मेनियम का एक और स्रोत है जिसे कोयले संग्रहणों से चलने वाले बिजली उत्पादन से आने वाली[[ फ्लाई ऐश ]]भी कहा जाता है।रूस और चीन ने इसे जर्मेनियम के लिए एक स्रोत के रूप में | जबकि यह मुख्य रूप से [[स्पैलेराइट]] से निर्मित होता है, तथा यह [[चांदी, सीसा]] और [[तांबे]] के अयस्कों में भी पाया जाता है। जर्मेनियम का एक और स्रोत है जिसे कोयले संग्रहणों से चलने वाले बिजली उत्पादन से आने वाली[[ फ्लाई ऐश ]]भी कहा जाता है।रूस और चीन ने इसे जर्मेनियम के लिए एक स्रोत के रूप में उपयोग किया।<ref name="Naumov">{{cite journal|first = A. V.|last = Naumov|title = World market of germanium and its prospects|journal = Russian Journal of Non-Ferrous Metals|volume = 48|issue = 4|date = 2007|doi = 10.3103/S1067821207040049|pages =265–272|s2cid = 137187498}}</ref> रूस के भंडार [[ सखालिन |सखालिन]] द्वीप के सुदूर पूर्व और [[ व्लादिवोस्टोक |व्लादिवोस्टोक]] के उत्तर-पूर्व में स्थित हैं। चीन में निर्धारित स्थान मुख्य रूप से [[ लिंज़ांग |लिंज़ांग]], [[ युन्नान |युन्नान]] के पास [[ लिग्नाइट |लिग्नाइट]] खानों में स्थित हैं, जहाँ कोयले का खनन [[ज़िलिनहाओते]], [[भीतरी मंगोलिया]] के पास भी किया जाता है।<ref name="Holl" /> | ||
अयस्क सांद्रण अधिकतर [[सल्फ़ाइडिक]] होते हैं, वे [[रोस्टिंग]] के रूप में जानी जाने वाली प्रक्रिया में हवा के नीचे गर्म करके [[ऑक्साइड]] में परिवर्तित हो जाते हैं, | अयस्क सांद्रण अधिकतर [[सल्फ़ाइडिक]] होते हैं, वे [[रोस्टिंग]] के रूप में जानी जाने वाली प्रक्रिया में हवा के नीचे गर्म करके [[ऑक्साइड]] में परिवर्तित हो जाते हैं, | ||
: GeS<sub>2</sub> + 3 O<sub>2</sub> → GeO<sub>2</sub> + 2 SO<sub>2</sub> | : GeS<sub>2</sub> + 3 O<sub>2</sub> → GeO<sub>2</sub> + 2 SO<sub>2</sub> | ||
कुछ जर्मेनियम जो उत्पन्न होता है, उसे धूल में छोड़ दिया जाता है, जबकि बाकी को जर्मेनियम में परिवर्तित किया जाता है, जिसे बाद में सल्फ्यूरिक अम्ल द्वारा सिंडर से ((जिसमें जिंक भी होता है) निक्षालित किया जाता है। उदासीनीकरण के बाद, केवल जिंक ही | कुछ जर्मेनियम जो उत्पन्न होता है, उसे धूल में छोड़ दिया जाता है, जबकि बाकी को जर्मेनियम में परिवर्तित किया जाता है, जिसे बाद में सल्फ्यूरिक अम्ल द्वारा सिंडर से ((जिसमें जिंक भी होता है) निक्षालित किया जाता है। उदासीनीकरण के बाद, केवल जिंक ही विलयन में बना रहता है जबकि जर्मेनियम और अन्य धातुएं अवक्षेपित हो जाती हैं। [[वाल्ज़ प्रक्रिया]] द्वारा अवक्षेप में कुछ जिंक को हटाने के बाद, वेल्ज़ ऑक्साइड को दूसरी बार निक्षालित किया जाता है। [[डाइऑक्साइड]] को अवक्षेप के रूप में प्राप्त किया जाता है और [[ क्लोरीन |क्लोरीन]] गैस या हाइड्रोक्लोरिक अम्ल के साथ [[जर्मेनियम टेट्राक्लोराइड]] में परिवर्तित किया जाता है, जिसका क्वथनांक कम होता है इसे आसवन द्वारा अलग किया जा सकता है,<ref name="Naumov" /> | ||
GeO<sub>2</sub> + 4 HCl → GeCl<sub>4</sub> + 2 H<sub>2</sub>O | GeO<sub>2</sub> + 4 HCl → GeCl<sub>4</sub> + 2 H<sub>2</sub>O | ||
| Line 225: | Line 232: | ||
जैविक और अकार्बनिक जर्मेनियम दोनों से बने जर्मेनियम पूरक को एक [[वैकल्पिक दवा]] के रूप में विपणन किया गया है जो [[ लेकिमिया |ल्यूकेमिया]] और [[फेफड़ों के कैंसर]] का उपचार करने में सक्षम है।<ref name="acs" /> हालांकि, इसके लाभ का कोई [[चिकित्सीय प्रमाण]] नहीं है, कुछ प्रमाण यह सुझाव देते है कि ऐसे पूरक हानिकारक हो सकते हैं।<ref name="American Cancer Society">{{cite book |publisher=American Cancer Society |title=American Cancer Society Complete Guide to Complementary and Alternative Cancer Therapies |edition=2nd |year=2009 |isbn=978-0944235713 |editor=Ades TB |pages=[https://archive.org/details/americancancerso0000unse/page/360 360–363] |chapter=Germanium |chapter-url=https://archive.org/details/americancancerso0000unse/page/360 }}</ref> [[अमेरिकी खाद्य एवं औषधि प्रशासन]] (एफडीए) के शोध ने निष्कर्ष निकाला है कि अकार्बनिक जर्मेनियम, जब [[पोषण पूरक]] के रूप में उपयोग किया जाता है, तो "मानव स्वास्थ्य के लिए संभावित [[संकटदायी]] होता है।<ref name="toxic">{{cite journal|last = Tao|first = S. H.|author2 = Bolger, P. M.|date = June 1997|title = Hazard Assessment of Germanium Supplements|journal = [[Regulatory Toxicology and Pharmacology]]|volume = 25|issue = 3|pages = 211–219|doi = 10.1006/rtph.1997.1098|pmid = 9237323|url = https://zenodo.org/record/1229957|access-date = 2019-06-30|archive-date = 2020-03-10|archive-url = https://web.archive.org/web/20200310041729/https://zenodo.org/record/1229957|url-status = live}}</ref> | जैविक और अकार्बनिक जर्मेनियम दोनों से बने जर्मेनियम पूरक को एक [[वैकल्पिक दवा]] के रूप में विपणन किया गया है जो [[ लेकिमिया |ल्यूकेमिया]] और [[फेफड़ों के कैंसर]] का उपचार करने में सक्षम है।<ref name="acs" /> हालांकि, इसके लाभ का कोई [[चिकित्सीय प्रमाण]] नहीं है, कुछ प्रमाण यह सुझाव देते है कि ऐसे पूरक हानिकारक हो सकते हैं।<ref name="American Cancer Society">{{cite book |publisher=American Cancer Society |title=American Cancer Society Complete Guide to Complementary and Alternative Cancer Therapies |edition=2nd |year=2009 |isbn=978-0944235713 |editor=Ades TB |pages=[https://archive.org/details/americancancerso0000unse/page/360 360–363] |chapter=Germanium |chapter-url=https://archive.org/details/americancancerso0000unse/page/360 }}</ref> [[अमेरिकी खाद्य एवं औषधि प्रशासन]] (एफडीए) के शोध ने निष्कर्ष निकाला है कि अकार्बनिक जर्मेनियम, जब [[पोषण पूरक]] के रूप में उपयोग किया जाता है, तो "मानव स्वास्थ्य के लिए संभावित [[संकटदायी]] होता है।<ref name="toxic">{{cite journal|last = Tao|first = S. H.|author2 = Bolger, P. M.|date = June 1997|title = Hazard Assessment of Germanium Supplements|journal = [[Regulatory Toxicology and Pharmacology]]|volume = 25|issue = 3|pages = 211–219|doi = 10.1006/rtph.1997.1098|pmid = 9237323|url = https://zenodo.org/record/1229957|access-date = 2019-06-30|archive-date = 2020-03-10|archive-url = https://web.archive.org/web/20200310041729/https://zenodo.org/record/1229957|url-status = live}}</ref> | ||
कुछ जर्मेनियम यौगिकों को वैकल्पिक चिकित्सा चिकित्सकों द्वारा गैर-एफडीए-स्वीकृत इंजेक्टेबल | कुछ जर्मेनियम यौगिकों को वैकल्पिक चिकित्सा चिकित्सकों द्वारा गैर-एफडीए-स्वीकृत इंजेक्टेबल विलयन के रूप में प्रशासित किया गया है। सबसे पहले उपयोग किए जाने वाले जर्मेनियम के घुलनशील अकार्बनिक रूप, विशेष रूप से साइट्रेट-लैक्टेट नमक, के परिणामस्वरूप लंबे समय तक इनका उपयोग करने वाले व्यक्तियों में [[गुर्दे]] की शिथिलता, [[यकृत स्टीटोसिस]] और परिधीय [[न्यूरोपैथी]] की कुछ स्थितियाँ सामने आई। इन व्यक्तियों में प्लाज्मा और मूत्र जर्मेनियम सांद्रता, जिनमें से कई की मृत्यु हो गई, [[ अंतर्जात |अंतर्जात]] स्तरों से अधिक परिमाण के कई क्रम थे। एक और हालिया कार्बनिक रूप, बीटा-कार्बोक्सीएथिलजर्मेनियम सेस्क्यूऑक्साइड ([[प्रोपेगर्मेनियम]]) ने विषाक्त प्रभावों के समान स्पेक्ट्रम का प्रदर्शन नहीं किया है।<ref>{{cite book|author=Baselt, R. |title=Disposition of Toxic Drugs and Chemicals in Man|edition=8th|publisher=Biomedical Publications|place=Foster City, CA|date=2008|pages=693–694}}</ref> | ||
जर्मेनियम के कुछ यौगिकों में [[स्तनधारियों]] के लिए कम विषाक्तता होती है, लेकिन कुछ[[ जीवाणु | जीवाणुओ]] के प्रति ये विषाक्त प्रभाव प्रदर्शित करते हैं।<ref name="nbb">{{cite book| last = Emsley| first = John| title = Nature's Building Blocks| publisher = Oxford University Press| date = 2001| location = Oxford| pages = 506–510| isbn = 978-0-19-850341-5}}</ref> | जर्मेनियम के कुछ यौगिकों में [[स्तनधारियों]] के लिए कम विषाक्तता होती है, लेकिन कुछ[[ जीवाणु | जीवाणुओ]] के प्रति ये विषाक्त प्रभाव प्रदर्शित करते हैं।<ref name="nbb">{{cite book| last = Emsley| first = John| title = Nature's Building Blocks| publisher = Oxford University Press| date = 2001| location = Oxford| pages = 506–510| isbn = 978-0-19-850341-5}}</ref> | ||
| Line 238: | Line 245: | ||
== टिप्पणियाँ == | == टिप्पणियाँ == | ||
{{NoteFoot}} | {{NoteFoot}} | ||
== संदर्भ == | == संदर्भ == | ||
{{Reflist}} | {{Reflist}} | ||
== बाहरी संबंध == | == बाहरी संबंध == | ||
* [http://www.periodicvideos.com/videos/032.htm Germanium] at ''[[The Periodic Table of Videos]]'' (University of Nottingham) | * [http://www.periodicvideos.com/videos/032.htm Germanium] at ''[[The Periodic Table of Videos]]'' (University of Nottingham) | ||
| Line 304: | Line 264: | ||
}} | }} | ||
{{Periodic table (navbox)}} | {{Periodic table (navbox)}} | ||
[[index.php?title=Category:जर्मेनियम| जर्मेनियम ]] | |||
[[Category: जर्मेनियम | जर्मेनियम ]] | |||
[[Category: रासायनिक तत्व]] | [[Category: रासायनिक तत्व]] | ||
[[Category: मेटालोइड्स]] | [[Category: मेटालोइड्स]] | ||
[[Category: इन्फ्रारेड सेंसर सामग्री]] | [[Category: इन्फ्रारेड सेंसर सामग्री]] | ||
[[Category: ऑप्टिकल सामग्री]] | [[Category: ऑप्टिकल सामग्री]] | ||
[[Category: समूह IV अर्धचालक | [[Category: समूह IV अर्धचालक]] | ||
[[Category: दिमित्री मेंडेलीव द्वारा अनुमानित रासायनिक तत्व | [[Category: दिमित्री मेंडेलीव द्वारा अनुमानित रासायनिक तत्व]] | ||
[[Category: सामग्री जो ठंड पर विस्तार करती है]] | [[Category: सामग्री जो ठंड पर विस्तार करती है]] | ||
[[Category: हीरे क्यूबिक संरचना के साथ रासायनिक तत्व]] | [[Category: हीरे क्यूबिक संरचना के साथ रासायनिक तत्व]] | ||
| Line 321: | Line 277: | ||
[[Category: Machine Translated Page]] | [[Category: Machine Translated Page]] | ||
[[Category:Created with V14 On 10/09/2022]] | [[Category:Created with V14 On 10/09/2022]] | ||
[[Category:Vigyan Ready]] | |||
Latest revision as of 22:08, 18 December 2023
 | |||||||||||||||
| Germanium | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| उच्चारण | /dʒɜːrˈmeɪniəm/ | ||||||||||||||
| दिखावट | grayish-white | ||||||||||||||
| Standard atomic weight Ar°(Ge) |
| ||||||||||||||
| Germanium in the periodic table | |||||||||||||||
| |||||||||||||||
| Atomic number (Z) | 32 | ||||||||||||||
| समूह | group 14 (carbon group) | ||||||||||||||
| अवधि | period 4 | ||||||||||||||
| ब्लॉक | p-block | ||||||||||||||
| ऋणावेशित सूक्ष्म अणु का विन्यास | [Ar] 3d10 4s2 4p2 | ||||||||||||||
| प्रति शेल इलेक्ट्रॉन | 2, 8, 18, 4 | ||||||||||||||
| भौतिक गुण | |||||||||||||||
| Phase at STP | solid | ||||||||||||||
| गलनांक | 1211.40 K (938.25 °C, 1720.85 °F) | ||||||||||||||
| क्वथनांक | 3106 K (2833 °C, 5131 °F) | ||||||||||||||
| Density (near r.t.) | 5.323 g/cm3 | ||||||||||||||
| when liquid (at m.p.) | 5.60 g/cm3 | ||||||||||||||
| संलयन की गर्मी | 36.94 kJ/mol | ||||||||||||||
| Heat of vaporization | 334 kJ/mol | ||||||||||||||
| दाढ़ गर्मी क्षमता | 23.222 J/(mol·K) | ||||||||||||||
Vapor pressure
| |||||||||||||||
| परमाणु गुण | |||||||||||||||
| ऑक्सीकरण राज्य | −4 −3, −2, −1, 0,[2] +1, +2, +3, +4 (an amphoteric oxide) | ||||||||||||||
| इलेक्ट्रोनगेटिविटी | Pauling scale: 2.01 | ||||||||||||||
| Ionization energies |
| ||||||||||||||
| परमाणु का आधा घेरा | empirical: 122 pm | ||||||||||||||
| सहसंयोजक त्रिज्या | 122 pm | ||||||||||||||
| [वैन डेर वाल्स रेडियस]] | 211 pm | ||||||||||||||
| Spectral lines of germanium | |||||||||||||||
| अन्य गुण | |||||||||||||||
| प्राकृतिक घटना | primordial | ||||||||||||||
| क्रिस्टल की संरचना | face-centered diamond-cubic | ||||||||||||||
| Speed of sound thin rod | 5400 m/s (at 20 °C) | ||||||||||||||
| थर्मल विस्तार | 6.0 µm/(m⋅K) | ||||||||||||||
| ऊष्मीय चालकता | 60.2 W/(m⋅K) | ||||||||||||||
| विद्युत प्रतिरोधकता | 1 Ω⋅m (at 20 °C) | ||||||||||||||
| ऊर्जा अंतराल | 0.67 eV (at 300 K) | ||||||||||||||
| चुंबकीय आदेश | diamagnetic[3] | ||||||||||||||
| दाढ़ चुंबकीय संवेदनशीलता | −76.84×10−6 cm3/mol[4] | ||||||||||||||
| यंग मापांक | 103 GPa[5] | ||||||||||||||
| कतरनी मापांक | 41 GPa[5] | ||||||||||||||
| थोक मापांक | 75 GPa[5] | ||||||||||||||
| पॉइसन अनुपात | 0.26[5] | ||||||||||||||
| मोहन कठोरता | 6.0 | ||||||||||||||
| CAS नंबर | 7440-56-4 | ||||||||||||||
| History | |||||||||||||||
| नामी | after Germany, homeland of the discoverer | ||||||||||||||
| भविष्यवाणी | Dmitri Mendeleev (1869) | ||||||||||||||
| खोज] | Clemens Winkler (1886) | ||||||||||||||
| |||||||||||||||
जर्मेनियम एक रासायनिक तत्व है, इसका प्रतीक Ge और परमाणु संख्या 32 है। यह चमकदार, कठोर-भंगुर, भूरा-सफ़ेद और दिखने में सिलिकॉन के समान होता है। यह कार्बन समूह में एक उपधातु है जो रासायनिक रूप में अपने समूह प्रतिवेशियो सिलिकॉन और टिन के समान है। सिलिकॉन की तरह, जर्मेनियम स्वाभाविक रूप से रासायनिक प्रतिक्रिया और प्रकृति में ऑक्सीजन के साथ परिसरों का निर्माण करता है।
क्योंकि यह कभी कभी उच्च सांद्रता में दिखाई देता है, इसलिए तत्वों की खोज में जर्मेनियम की खोज तुलनात्मक रूप से देर से हुई।पृथ्वी की धरातली में तत्वों के सापेक्ष समृद्धि में जर्मेनियम पचासवें स्थान पर स्थित है। 1869 में, दिमित्री मेंडेलीव ने अपनी आवर्त सारणी में इसकी स्थिति से इसके अस्तित्व और इसके कुछ गुणों की भविष्यवाणी की, और तत्व को एकासिलिकॉन कहा। 1886 में, फ्रीबर्ग विश्वविद्यालय में क्लेमेंस विंकलर ने खनिज अर्गीरोडाइट में चांदी और सल्फर के साथ नया तत्व पाया। विंकलर ने तत्व का नाम अपने देश जर्मनी के नाम पर रखा। जर्मेनियम का खनन मुख्य रूप से स्पैलेराइट (ज़िंक का प्राथमिक अयस्क) से किया जाता है, हालांकि जर्मेनियम को व्यावसायिक रूप से चांदी, सीसा और तांबे के अयस्कों से भी प्राप्त किया जाता है।
जर्मेनियम तत्व का उपयोग ट्रांजिस्टर और विभिन्न अन्य इलेक्ट्रॉनिक उपकरणों में एक अर्धचालक के रूप में किया जाता है। ऐतिहासिक रूप से, अर्धचालक इलेक्ट्रॉनिक्स का पहला दशक पूरी तरह से जर्मेनियम पर आधारित था। वर्तमान में, प्रमुख अंतिम उपयोग तंतु प्रकाशिकी तंत्र, अवरक्त दृष्टि, सौर सेल अनुप्रयोग और प्रकाश उत्सर्जक डायोड (एलईडी) हैं। जर्मेनियम यौगिकों का उपयोग बहुलकीकरण उत्प्रेरक के लिए भी किया जाता है और हाल ही में नैनोवायर के उत्पादन में इसका उपयोग किया गया है। यह तत्व बड़ी संख्या में ऑर्गेनोगरमेनियम यौगिकों का निर्माण करता है, जैसे कि टेट्रामेथाइल जर्मेनियम, जो ऑर्गनोमेटेलिक रसायन विज्ञान में उपयोगी है। जर्मेनियम को प्रौद्योगिकी-महत्वपूर्ण तत्व माना जाता है।[6]
जर्मेनियम को किसी भी जीवित जीव के लिए आवश्यक तत्व नहीं माना जाता है। सिलिकॉन और एल्युमीनियम के समान, प्राकृतिक रूप से मौजूद जर्मेनियम यौगिक जल में अनविलिन होते हैं और इसलिए मौखिक विषाक्तता में कमी होती है। हालांकि, सिंथेटिक घुलनशील जर्मेनियम लवणनेफ्रोटॉक्सिक होते हैं, और हलोजन और हाइड्रोजन के साथ सिंथेटिक रासायनिक रूप से प्रतिक्रियाशील जर्मेनियम यौगिक उत्तेजक और विषाक्त पदार्थ होते हैं।
इतिहास
1869 में रासायनिक तत्वों के आवधिक कानून पर अपनी रिपोर्ट में, रूसी रसायनज्ञ दिमित्री मेंडेलीव ने कई अज्ञात रासायनिक तत्वों के अस्तित्व की भविष्यवाणी की, जिनमें से एक सिलिकॉन और टिन के बीच स्थित कार्बन परिवार में एक अंतर को भर देगा।।[7] अपनी आवर्त सारणी में इसकी स्थिति के कारण, मेंडेलीव ने इसे एकासिलिकॉन (Es) कहा, और उन्होंने इसका परमाणु भार 70 (बाद में 72) होने का अनुमान लगाया।
1885 के मध्य में, फ्रीबर्ग, सैक्सोनी के पास एक खदान में, एक नएखनिज की खोज की गई थी और इसकी उच्च चांदी की सामग्री के कारण इसे अरगिरोडाइट का नाम दिया गया था।[note 1] रसायनज्ञ क्लेमेंस विंकलर ने इस नए खनिज का विश्लेषण किया, जो चांदी, सल्फर और एक नए तत्व का संयोजन साबित हुआ। विंक्लर 1886 में नए तत्व को अलग करने में सफल रहे और उसे एंटीमनी के समान पाया। उन्होंने शुरू में नए तत्व को ईका-एंटीमोनी माना, लेकिन जल्द ही आश्वस्त हो गए कि यह इका-सिलिकॉन है।[9][10] इससे पहले कि विंकलर नए तत्व पर अपने परिणाम प्रकाशित करें, उन्होंने फैसला किया कि वह अपने तत्व का नाम नेपच्यूनियम रखेंगे, क्योंकि 1846 में नेपच्यून ग्रह की हालिया खोज इसी तरह इसके अस्तित्व की गणितीय भविष्यवाणियों से पहले हुई थी।[note 2] हालांकि, नेप्च्यूनियम नाम पहले से ही एक अन्य प्रस्तावित रासायनिक तत्व को दिया गया था (हालाँकि यह वह तत्व नहीं है जिसे आज नेप्च्यूनियम नाम दिया गया है, जिसे 1940 में खोजा गया था)।[note 3] इसलिए इसके बजाय, विंकलर ने अपनी मातृभूमि के सम्मान में नए तत्व का नाम जर्मेनियम (जर्मनी के लिए लैटिन शब्द जर्मनिया से) रखा।[10] आर्गाइरोडाइट अनुभवजन्य रूप से Ag8GeS6 साबित हुआ । क्योंकि इस नए तत्व ने आर्सेनिक और एंटीमोनी के तत्वों के साथ कुछ समानताएं दिखाईं, इसलिए आवर्त सारणी में इसका उचित स्थान विचाराधीन था, लेकिन दिमित्री मेंडेलीव के पूर्वानुमानित तत्व "एकासिलिकॉन" के साथ इसकी समानता ने आवर्त सारणी में उस स्थान की पुष्टि कर दी।[10][17] सैक्सोनी की खदानों से 500 किलोग्राम अयस्क से अतिरिक्त सामग्री के साथ, विंकलर ने 1887 में नए तत्व के रासायनिक गुणों की पुष्टि की।[9][10][18] उन्होंने शुद्ध[[जर्मेनियम टेट्राक्लोराइड | जर्मेनियम टेट्राक्लोराइड (GeCl
4)]] का विश्लेषण करके 72.32 का एक परमाणु भार भी निर्धारित किया, जबकि लेकोक डे बोइसबॉड्रन ने तत्व के स्पार्कस्पेक्ट्रम में रेखाओं की तुलना में 72.3 का अनुमान लगाया।[19]
विंकलर जर्मेनियम के कई नए यौगिकों को तैयार करने में सक्षम थे, जिसमें फ्लोराइड, क्लोराइड, सल्फाइड, डाइऑक्साइड, और टेट्रामेथाइल (Ge(C2H5)4) और पहले ऑर्गेनोगरमैन सम्मिलित थे।[9] उन यौगिकों से प्राप्त भौतिक आंकड़े - जो मेंडेलीव की भविष्यवाणियों के साथ अच्छी तरह से मेल खाते थे - उसने इस खोज को मेंडेलेयेव के तत्व समय-समय पृष्ठी की महत्वपूर्ण पुष्टि बना दी।[9]
| गुण | एकासिलिकॉन मेंडलीव भविष्यवाणी (1871)!! जर्मेनियम विंकलर खोज (1887) | |
|---|---|---|
| परमाणु भार | 72.64 | 72.63 |
| घनत्व (g/cm3) | 5.5 | 5.35 |
| गलनांक (°C) | उच्च | 947 |
| वर्ण | धुमैला | धुमैला |
| ऑक्साइड प्रकार | दुर्दम्य डाइऑक्साइड | दुर्दम्य डाइऑक्साइड |
| ऑक्साइड घनत्व (g/cm3) | 4.7 | 4.7 |
| ऑक्साइड गतिविधि | क्षीण क्षारकीय | क्षीण क्षारकीय |
| क्लोराइड क्वथनांक(°C) | 100 से कम | 86 (GeCl4) |
| क्लोराइड घनत्व (g/cm3) | 1.9 | 1.9 |
1930 के दशक के अंत तक, जर्मेनियम को खराब संचालन वाली धातु माना जाता था।[20] 1945 के बाद, जब इसे एक इलेक्ट्रॉनिक अर्धचालक के रूप में पहचाना गया, तब भी जर्मेनियम आर्थिक रूप से महत्वपूर्ण नहीं बना। द्वितीय विश्व युद्ध के दौरान, कुछ विशेष इलेक्ट्रॉनिक्स उपकरणों, जिनमें अधिकतर डायोड थे, उनमे थोड़ी मात्रा में जर्मेनियम का उपयोग किया गया था।[21][22] [20] पहली सिलिकॉन जर्मेनियम मिश्र धातु 1955 में प्राप्त की गई थी।[23] 1945 से पहले, हर साल स्मेल्टरों में केवल कुछ सौ किलोग्राम जर्मेनियम का उत्पादन किया जाता था, लेकिन 1950 के दशक के अंत तक, दुनिया भर में वार्षिक उत्पादन 40 metric tons (44 short tons) तक पहुंच गया था।[24]
1948 में जर्मेनियम ट्रांजिस्टर के विकास[25] ने ठोस अवस्था इलेक्ट्रॉनिक्स के अनगिनत अनुप्रयोगों के द्वार खोल दिये।[26] 1950 से 1970 के दशक की शुरुआत में, इस क्षेत्र ने जर्मेनियम के लिए एक बढ़ता हुआ बाजार प्रदान किया, लेकिन फिर उच्च-शुद्धता वाले सिलिकॉन ने ट्रांजिस्टर, डायोड और रेक्टिफायर में जर्मेनियम की जगह लेना शुरू कर दिया।[27] उदाहरण के लिए, फेयरचाइल्ड अर्धचालक बनने वाली कंपनी की स्थापना 1957 में सिलिकॉन ट्रांजिस्टर के उत्पादन के स्पष्ट उद्देश्य से की गई थी। सिलिकॉन में बेहतर विद्युत गुण होते हैं, लेकिन इसके लिए बहुत अधिक शुद्धता की आवश्यकता होती है जिसे अर्धचालक इलेक्ट्रॉनिक्स के शुरुआती वर्षों में व्यावसायिक रूप से हासिल नहीं किया जा सका।[28]
इस बीच, फाइबर प्रकाशीय संचार नेटवर्क, अवरक्त रात्रि दृष्टि प्रणाली और बहुलकीकरण उत्प्रेरक के लिए जर्मेनियम की मांग नाटकीय रूप से बढ़ गई।[24] ये अंतिम उपयोग 2000 में दुनिया भर में जर्मेनियम की खपत का 85% प्रतिनिधित्व करते थे। [27] अमेरिकी सरकार ने 1987 में राष्ट्रीय रक्षा भंडार में 146 टन (132 टन) आपूर्ति की मांग करते हुए जर्मेनियम को एक रणनीतिक और महत्वपूर्ण सामग्री के रूप में भी नामित किया।[24]
जर्मेनियम सिलिकॉन से भिन्न होता है क्योकि इसकी आपूर्ति शोषक स्रोतों की उपलब्धता से सीमित होती है, जबकि सिलिकॉन की आपूर्ति केवल उत्पादन क्षमता तक सीमित होती है क्योंकि सिलिकॉन साधारण रेत और क्वार्ट्ज से आता है। जबकि सिलिकॉन को 1998 में $ 10 प्रति किलोग्राम से कम के लिए खरीदा जा सकता था,[24] तब जर्मेनियम की कीमत लगभग $ 800 प्रति किलोग्राम थी।[24]
विशेषताएँ
मानक परिस्थितियों में, जर्मेनियम एक भंगुर, चांदी-सफेद, अर्ध-धातु तत्व है।[29] यह रूप एक एलोट्रोप का निर्माण करता है जिसे α-जर्मेनियम के नाम से जाना जाता है, जिसमें एक धातु चमक और हीरे की घन क्रिस्टल संरचना होती है, जो हीरे के समान होती है।[27] क्रिस्टल रूप में रहते हुए, जर्मेनियम की विस्थापन सीमा ऊर्जा होती है।[30] 120 किलोबार से ऊपर के दबाव पर, जर्मेनियम β-टिन के समान संरचना वाला एलोट्रोप β-जर्मेनियम बन जाता है।[31] सिलिकॉन,गैलियम , बिस्मथ, एंटीमनी औरपानी की तरह, जर्मेनियम उन कुछ पदार्थों में से एक है जो पिघली हुई अवस्था से जमने (यानी जमने) के साथ फैलता है।[31]
जर्मेनियम एक अर्धचालक है जिसमें एक अप्रत्यक्ष बैंडगैप है, जैसा कि क्रिस्टलीन सिलिकॉन में है। ज़ोन शोधन तकनीकों ने अर्धचालकों के लिए क्रिस्टलीय जर्मेनियम का उत्पादन किया है, जिसमें 1010 में केवल एक भाग की अशुद्धता है ,[32] जो इसे अब तक प्राप्त सबसे शुद्ध सामग्रियों में से एक बनाती है।[33] अत्यंत मजबूतविद्युत चुम्बकीय क्षेत्र की उपस्थिति में एकअर्धचालक बनने के लिए खोज की गई पहली अर्ध-धातु सामग्री (2005 में) जर्मेनियम, यूरेनियम और रोडियम की एक मिश्र धातु थी।[34]
शुद्ध जर्मेनियम को बहुत लंबे पेंच अव्यवस्थाओं को अनायास बाहर निकालने के लिए जाना जाता है, जिसे जर्मेनियम विस्कर्स कहा जाता है। इन विस्कर्स की वृद्धि जर्मेनियम से बने पुराने डायोड और ट्रांजिस्टर की विफलता के लिए प्राथमिक कारणों में से एक है, जैसे कि, वे अंततः क्या छूते हैं, इस पर निर्भर करते हुए, उसके आधार पर, वे बिजली की कमी का कारण बन सकते हैं।[35]
रसायन विज्ञान
तत्वीय जर्मेनियम लगभग 250 डिग्री सेल्सियस पर हवा में धीरे-धीरे ऑक्सीकरण करना शुरू कर देता है, जिससे GeO2बनता है।[36] जर्मेनियम तनुअम्ल और क्षार में अघुलनशील होता है, लेकिन गर्म सांद्र सल्फ्यूरिक और नाइट्रिक एसिड में धीरे-धीरे घुल जाता है और पिघले हुए क्षारों के साथ विकर्ण से जर्मेनेट ([GeO
3]2−
) उत्पन्न करने के लिए क्रियाशील होता है। जर्मेनियम अधिकतर ऑक्सीकरण अवस्था +4 में होता है, हालांकि जिसके लिए कई +2 यौगिक ज्ञात हैं। [37] अन्य ऑक्सीकरण अवस्थाएँ दुर्लभ हैं, जो +3 Ge2Cl6 जैसे यौगिकों में पाई जाती है, और ऑक्साइड्स की सतह पर +3 और +1 में मिलती हैं, या जर्मेनाइड्स में नकारात्मक आक्सीकरण स्थितियाँ, जैसे कि Mg
2Ge में −4 के रूप में मिलती है।[38] जर्मेनियम क्लस्टर आयन (ज़िंटल आयन) जैसे Ge42−, Ge94−, Ge92−, [(Ge9)2]6− को एथिलीनडायमाइन या क्रिप्टैंड की उपस्थिति में तरल अमोनिया में क्षार धातुओं और जर्मेनियम युक्त मिश्र धातुओं से निष्कर्षण द्वारा तैयार किया गया है। इन आयनों में ओजोनाइड्स O3− की तरह तत्व की आक्सीकरण अवस्थाएँ पूर्णांक नहीं होतीं हैं।
जर्मेनियम के दो ऑक्साइड ज्ञात हैं, जिन्हें जर्मेनियम डाइऑक्साइड (GeO
2, जर्मेनिया) और जर्मेनियम मोनोऑक्साइड (GeS
2), , (GeO) कहते है।[31] डाइऑक्साइड, GeO2 जर्मेनियम डाइसल्फ़ाइड (GeS
2) को भर्जन करके प्राप्त किया जा सकता है, और यह एक सफेद पाउडर है जो केवल पानी में थोड़ा घुलनशील है, लेकिन जर्मेनेट बनाने के लिए क्षार के साथ प्रतिक्रिया करता है।[31] मोनोऑक्साइड, जर्मन ऑक्साइड, GeO2 को तत्वीय जर्मेनियम के साथ उच्च तापमान पर प्रतिक्रिया करके प्राप्त किया जा सकता है।[31] जो डाइऑक्साइड (और संबंधित ऑक्साइड्स और जर्मेनेट्स) बताता है उसमें एक असामान्य गुण होता है कि वह दृष्टिगत प्रकाश के लिए एक उच्च अपवर्तक सूचकांक रखता है, लेकिन अवरक्त प्रकाश के लिए पारदर्शी होता है।[39][40] बिस्मथ जर्मनट, Bi4Ge3O12 (BGO) का उपयोग प्रस्फुरक के रूप में किया जाता है।[41]
अन्य चाकोजेन के साथ द्विआधारी यौगिकों को भी जाना जाता है, जिनमे डाइसल्फ़ाइड (GeS
2), डाइसल्फ़ाइड (GeSe
2), और मोनोसल्फाइड (GeS), और मोनोटेल्यूराइड (GeTe) आदि सम्मिलित है।[37] जब हाइड्रोजन सल्फाइड को Ge(IV) युक्त प्रबल अम्लीय घोल से गुजारा जाता है तो GeS2 एक सफेद अवक्षेप के रूप में बनता है।[37] डाइसल्फ़ाइड पानी में और कास्टिक क्षार या क्षारीय सल्फाइड के विलयन में काफी घुलनशील है। फिर भी, यह अम्लीय पानी में घुलनशील नहीं है, जिसने विंकलर को तत्व की खोज करने की अनुमति मिलती है।[42] डाइसल्फ़ाइड को हाइड्रोजन की धारा में गर्म करने से मोनोसल्फाइड (GeS) बनता है, जो गहरे रंग और धात्विक चमक की पतली प्लेटों में उर्ध्वपातित हो जाता है और कास्टिक क्षार के घोल में घुलनशील होता है।[31] क्षारीय कार्बोनेट और सल्फर के साथ पिघलने पर, जर्मेनियम यौगिक थियोजर्मनेट नामक लवण बनाते हैं।[43]
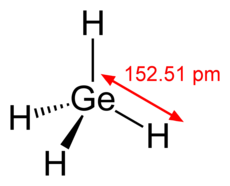
चार टेट्राहालाइड्स ज्ञात हैं। सामान्य परिस्थितियों में GEI4 एक ठोस, GeF4 एक गैस और अन्य अस्थिर तरल पदार्थ हैं। उदाहरण के लिए, जर्मेनियम टेट्राक्लोराइड, GeCl4, धातु को क्लोरीन के साथ गर्म करके 83.1 डिग्री सेल्सियस पर उबलते हुए एक रंगहीन धूआं तरल के रूप में प्राप्त किया जाता है।[31]सभी टेट्राहालाइड आसानी से हाइड्रेटेड जर्मेनियम डाइऑक्साइड के लिए हाइड्रोलाइज्ड हो जाते हैं।[31] GeCl4 का उपयोग ऑर्गेनोगरमेनियम यौगिकों के के उत्पादन में किया जाता है।[37] सभी चार डायहालाइड्स ज्ञात हैं जोकि टेट्राहालाइड्स के विपरीत बहुलक ठोस हैं।[37] इसके अतिरिक्त Ge2Cl6 और GenCl2n+2 सूत्र के कुछ उच्च यौगिक ज्ञात हैं।[31] असामान्य यौगिक Ge6Cl16 तैयार किया गया है जिसमें नियोपेंटेन संरचना वाली Ge5Cl12इकाई सम्मिलित है।[44]
जर्मेन (GeH4) मीथेन की संरचना के समान एक यौगिक है। पॉलीजर्मेन्स—जो एल्केनों के समान यौगिक होते हैं—जिनका सूत्र GenH2n+2 है, जिनमें पाँच जर्मेनियम परमाणु तक हो सकते हैं, वे जाने जाते हैं।[37] जर्मन उनके संबंधित सिलिकॉन समकक्षों की तुलना में कम अस्थिर और कम प्रतिक्रियाशील होते हैं।[37] GeH4 तरल अमोनिया में क्षार धातुओं के साथ प्रतिक्रिया करके सफेद क्रिस्टलीय MGeH3 बनाता है जिसमें GeH3− आयन होता है।[37] एक, दो और तीन हैलोजन परमाणुओं के साथ जर्मेनियम हाइड्रोहलिड्स रंगहीन प्रतिक्रियाशील तरल पदार्थ हैं।[37]
पहला ऑर्गेनोगर्मेनियम यौगिक 1887 में विंकलर द्वारा संश्लेषित किया गया था, जो डायथाइलजिंक के साथ जर्मेनियम टेट्राक्लोराइड की प्रतिक्रिया से टेट्रैथाइलगर्मन (Ge(C
2H
5)
4) से प्राप्त हुआ।[9] R4Ge प्रकार (जहाँ R एक एल्काइल है) जैसे टेट्रामेथिलगर्मेन (Ge(CH
3)
4) और टेट्रामेथाइलगर्मन के ऑर्गनोजर्मेन तक सबसे सस्ते उपलब्ध जर्मेनियम अग्रदूत जर्मेनियम टेट्राक्लोराइड और एल्काइल न्यूक्लियोफाइल के माध्यम से अभिगम करते है। कार्बनिक जर्मेनियम हाइड्राइड्स जैसे कि आइसोब्यूटाइलगर्मेन ((CH
3)
2CHCH
2GeH
3) कम खतरनाक पाए गए और अर्धचालक अनुप्रयोगों में विषाक्त जर्मेनियम गैस के लिए एक तरल विकल्प के रूप में उपयोग किया जा सकता है। कई जर्मेनियम प्रतिक्रियाशील मध्यवर्ती ज्ञात हैं, जिन्हें जर्माइल मुक्त कण, जर्माइलीन (कार्बाइन के समान), और जर्मिनेस (कार्बाइन के समान) कहा जाता है।[45][46] ऑर्गेनोगरमेनियम कंपाउंड कार्बोक्सैथाइलगर्मेसक्यूएक्सेन को पहली बार 1970 के दशक में रिपोर्ट किया गया था, और कुछ समय के लिए इसे अनुपूरक के रूप में उपयोग किया गया था और माना जाता था कि इसमें संभवतः ट्यूमर-विरोधी गुण हैं।[47]
आइंड (1,1,3,3,5,5,5,7,7-ऑक्टाएथिल-s-हाइड्रिंडासेन-4-yl) नामक लिगैंड का उपयोग करके जर्मेनियम ऑक्सीजन (जर्मेनोन) के साथ दोहरा बंधन बनाने में सक्षम है।जर्मेनियम हाइड्राइड और जर्मेनियम टेट्राहाइड्राइड हवा के साथ मिश्रित होने पर अत्यधिक ज्वलनशील और यहां तक कि विस्फोटक होते हैं।[48]
समस्थानिक
जर्मेनियम 5 प्राकृतिक समस्थानिकों में होता है, जिसमे 70
Ge
, 72
Ge
, 73
Ge
, 74
Ge
, तथा 76
Ge
सम्मिलित है। इनमे से, 76
Ge
बहुत कम रेडियोधर्मी है, जो 1.78×1021 वर्षों के आधे जीवन के साथ दोहरे बीटा क्षय द्वारा क्षय हो रहा है। 74
Ge
सबसे सामान्य समस्थानिक है, जिसकी प्राकृतिक प्रचुरता लगभग 36% है। 76
Ge
लगभग 7%की प्राकृतिक प्रचुरता के साथ सबसे कम सामान्य है।[49] जब अल्फा कणों के साथ बमबारी की जाती है, तो समस्थानिक 72
Ge
स्थिर 77
Se
उत्पन्न करेगा, जो प्रक्रिया में उच्च ऊर्जा इलेक्ट्रॉनों को मुक्त करता है।[50] इस वजह से, इसका उपयोग परमाणु बैटरियों के लिएरेडॉन के साथ संयोजन में किया जाता है।[50]
कम से कम 27 रेडियो समस्थानिक को भी संश्लेषित किया गया है, जिनका परमाणु द्रव्यमान 58 से 89 तक है। इनमें से सबसे स्थिर 68
Ge
है , जो इलेक्ट्रॉन परिग्रहण के साथ अवसान होता है, जिसका आधा-जीवनकाल 270.95 दिन है। सबसे अस्थायी 60
Ge
है, जिसका आधा-जीवनकाल 30 मिलीसेकंड है। जबकि जर्मेनियम के अधिकांश विकिरण समस्थानिक बीटा क्षय द्वारा क्षय होते हैं, जो 61
Ge
और 64
Ge
β+
विलंबित प्रोटॉन उत्सर्जन के साथ क्षय होते हैं।[49] 84
Ge
के 87
Ge
समस्थानिक के माध्यम से भी अल्प
β−
विलंबित न्यूट्रॉन उत्सर्जन अवसान पथ दिखाते हैं।[49]
घटना
जर्मेनियमतारकीय न्यूक्लियोसिंथेसिस द्वारा उत्पन्न होता है, जो अधिकतर s-प्रक्रिया के माध्यम से उपगामी विशाल शाखा तारो में होता है। s-प्रक्रिया स्पंदित लाल विशाल तारों के अंदर हल्के तत्वों को धीमी गति से न्यूट्रॉन प्रग्रहण करने की प्रक्रिया है।[51] जर्मेनियम को कुछ सबसे दूर के तारों और बृहस्पति के वायुमंडल में पाया गया है।[52] [53]
जर्मेनियम की पृथ्वी की धरा में विशेषज्ञता लगभग 1.6 पीपीएम है।[54] केवल कुछ ही खनिज जैसे आर्गाइरोडाइट, ब्राइआरटाइट, जर्मेनाइट, रेनिएराइट और स्फैलराइट में जर्मेनियम की पर्याप्त मात्रा होती है।[27][55] उनमें से केवल कुछ ही (विशेष रूप से जर्मेनाइट), बहुत कम, खनन योग्य मात्रा में पाए जाते हैं।[56][57][58] कुछ जिंक–तांबा–सीसा अयस्क निकायों में इतना जर्मेनियम होता है जो अंतिम अयस्क संघटन से निकालने के लिए पर्याप्त होता है।[54] कुछ कोयले की परतों में जर्मेनियम की उच्च सामग्री का कारण एक असामान्य प्राकृतिक समृद्धि प्रक्रिया होती है, जिसे जर्मेनियम के खनन स्थलों के लिए विस्तृत सर्वेक्षण के दौरान विक्टर मौरित्स गोल्डश्मिट ने खोजा।[59][60] अब तक की सबसे अधिक सांद्रता हार्टले कोयले की राख में 1.6% जर्मेनियम के साथ पाई गई।।[59][60] भीतरी मंगोलिया के ज़िलिनहाओटे के पास कोयले के भंडार में, अनुमानित 1600 टन जर्मेनियम है।[54]
उत्पादन
2011 में दुनिया भर में लगभग 118 टन जर्मेनियम का उत्पादन किया गया, जिसमें प्रमुख रूप से चीन (80 टन), रूस (5 टन) और संयुक्त राज्य अमेरिका (3 टन) सम्मिलित थे।[27] जर्मेनियम को स्पैलेराइट जिंक अयस्कों से एक उप-उत्पाद के रूप में प्राप्त किया जाता है, विशेष रूप से कम तापमान वाले तलछट-आश्रित, बड़े पैमाने पर Zn-Pb-Cu(-Ba) निक्षेप और कार्बोनेट-आश्रित Zn-Pb निक्षेप से जहां यह 0.3% तक की मात्रा में केंद्रित होता है।[61][62] हाल ही के एक अध्ययन में पाया गया है कि कम से कम 10,000 टन निकालने योग्य जर्मेनियम ज्ञात जिंक संरक्षणों में है, विशेषकर मिसिसिपी-वैली प्रकार के जमीनों में, जबकि कम से कम 112,000 टन कोयले के संरक्षणों में पाया जाएगा।[63][64] 2007 में 35% मांग को पुनर्नवीनीकरण जर्मेनियम द्वारा पूरा किया गया था।[54]
| वर्ष | लागत ($/किलो)[65] |
|---|---|
| 1999 | 1,400 |
| 2000 | 1,250 |
| 2001 | 890 |
| 2002 | 620 |
| 2003 | 380 |
| 2004 | 600 |
| 2005 | 660 |
| 2006 | 880 |
| 2007 | 1,240 |
| 2008 | 1,490 |
| 2009 | 950 |
| 2010 | 940 |
| 2011 | 1,625 |
| 2012 | 1,680 |
| 2013 | 1,875 |
| 2014 | 1,900 |
| 2015 | 1,760 |
| 2016 | 950 |
| 2017 | 1,358 |
| 2018 | 1,300 |
| 2019 | 1,240 |
| 2020 | 1,000 |
जबकि यह मुख्य रूप से स्पैलेराइट से निर्मित होता है, तथा यह चांदी, सीसा और तांबे के अयस्कों में भी पाया जाता है। जर्मेनियम का एक और स्रोत है जिसे कोयले संग्रहणों से चलने वाले बिजली उत्पादन से आने वालीफ्लाई ऐश भी कहा जाता है।रूस और चीन ने इसे जर्मेनियम के लिए एक स्रोत के रूप में उपयोग किया।[66] रूस के भंडार सखालिन द्वीप के सुदूर पूर्व और व्लादिवोस्टोक के उत्तर-पूर्व में स्थित हैं। चीन में निर्धारित स्थान मुख्य रूप से लिंज़ांग, युन्नान के पास लिग्नाइट खानों में स्थित हैं, जहाँ कोयले का खनन ज़िलिनहाओते, भीतरी मंगोलिया के पास भी किया जाता है।[54]
अयस्क सांद्रण अधिकतर सल्फ़ाइडिक होते हैं, वे रोस्टिंग के रूप में जानी जाने वाली प्रक्रिया में हवा के नीचे गर्म करके ऑक्साइड में परिवर्तित हो जाते हैं,
- GeS2 + 3 O2 → GeO2 + 2 SO2
कुछ जर्मेनियम जो उत्पन्न होता है, उसे धूल में छोड़ दिया जाता है, जबकि बाकी को जर्मेनियम में परिवर्तित किया जाता है, जिसे बाद में सल्फ्यूरिक अम्ल द्वारा सिंडर से ((जिसमें जिंक भी होता है) निक्षालित किया जाता है। उदासीनीकरण के बाद, केवल जिंक ही विलयन में बना रहता है जबकि जर्मेनियम और अन्य धातुएं अवक्षेपित हो जाती हैं। वाल्ज़ प्रक्रिया द्वारा अवक्षेप में कुछ जिंक को हटाने के बाद, वेल्ज़ ऑक्साइड को दूसरी बार निक्षालित किया जाता है। डाइऑक्साइड को अवक्षेप के रूप में प्राप्त किया जाता है और क्लोरीन गैस या हाइड्रोक्लोरिक अम्ल के साथ जर्मेनियम टेट्राक्लोराइड में परिवर्तित किया जाता है, जिसका क्वथनांक कम होता है इसे आसवन द्वारा अलग किया जा सकता है,[66]
GeO2 + 4 HCl → GeCl4 + 2 H2O
GeO2 + 2 Cl2 → GeCl4 + O2
जर्मेनियम टेट्राक्लोराइड को या तो ऑक्साइड (GeO2) में हाइड्रोलाइज़ किया जाता है या संयुक्त आस्तीविक्षेपण द्वारा शोधित और फिर हाइड्रोलाइज़ किया जाता है।[66] अत्यधिक शुद्ध GeO2 अब जर्मेनियम ग्लास के उत्पादन के लिए उपयुक्त है। इसे हाइड्रोजन के साथ प्रतिक्रिया करके तत्व में बदल दिया जाता है, जिससे अवरक्त प्रकाशिकी और अर्धचालक उत्पादन के लिए उपयुक्त जर्मेनियम का उत्पादन होता है,
GeO2 + 2 H2 → Ge + 2 H2O
इस्पात उत्पादन और अन्य औद्योगिक प्रक्रियाओं के लिए सामान्य तौर पर कार्बन का उपयोग करके जर्मेनियम को कम किया जाता है,[67]
- GeO2 + C → Ge + CO2
अनुप्रयोग
2007 में दुनिया भर में जर्मेनियम का प्रमुख अंतिम उपयोग कुछ इस प्रकार अनुमानित था, जैसे 35% तंतु प्रकाशिकी के लिए, 30% अवरक्त प्रकाशिकी, 15% बहुलकीकरण उत्प्रेरक, और 15% इलेक्ट्रॉनिक्स और सौर विद्युत अनुप्रयोगों के लिए।[27] शेष 5% का उपयोग फास्फोर, धातुकर्म, और कैमोथेरेपी जैसे उपयोगों में हुआ।[27]
प्रकाशिकी

- आन्तरक 8 µm
- आवरण 125 µm
- बफर 250 µm
- जैकेट 400 µm
जर्मेनिया (GeO2) की विशेष गुणधर्मों में इसका उच्च परावर्तन सूची और इसका कम प्रकाशिक परिक्षेपण सम्मिलित हैं। ये इसे वाइड-एंगल कैमरा लेंस , माइक्रोस्कोपी और प्रकाशिक तंतु के मुख्य भाग के लिए विशेष रूप से उपयोगी बनाते हैं।[68][69] इसने सिलिका तंतु के लिए डोपेंट के रूप में टाइटेनिया की जगह ले ली है, जिससे बाद में होने वाले ताप उपचार को समाप्त कर दिया गया, जिससे फाइबर भंगुर हो गए।[70] 2002 के अंत में, तंतु प्रकाशिकी उद्योग ने संयुक्त राज्य अमेरिका में वार्षिक जर्मेनियम उपयोग का 60% उपभोग किया, लेकिन यह दुनिया भर में खपत का 10% से भी कम है।[69] GeSbTe एक अवस्था परिवर्तन पदार्थ है जिसका उपयोग अपने प्रकाशिकी गुणों के लिए किया जाता है, जैसा कि पुनर्लेखनीय डीवीडीज में उपयोग होता है।[71]
क्योंकि जर्मेनियम अवरक्त तरंगदैर्ग में पारदर्शी है, इसलिए यह एक महत्वपूर्ण अवरक्त प्रकाशिकी पदार्थ है जो आसानी से लेंस और खिड़कियों में काटा और चमकाया जा सकता है। इसका उपयोग विशेष रूप से निष्क्रिय थर्मल इमेजिंग के लिए 8 से 14 माइक्रोन परास में काम करने वाले ऊष्मीय प्रतिबिंबन कैमरों में मुख्य प्रकाशिकी के रूप में और सैन्य, मोबाइल रात्रि दृष्टि और अग्निशमन अनुप्रयोगों में ऊष्म बिंदु का पता लगाने के लिए किया जाता है।[67] इसका उपयोग अवरक्त स्पेक्ट्रमदर्शी और अन्य ऑप्टिकल उपकरणों में किया जाता है, जिन्हें बेहद संवेदनशील अवरक्त संसूचको की आवश्यकता होती है।[69] इसका अपवर्तनांक (4.0) बहुत अधिक है और इसे परावर्तन रोधी एजेंटों के साथ लेपित किया जाना चाहिए। विशेष रूप से, हीरे की तरह कार्बन (डीएलसी), अपवर्तक सूचकांक 2.0 का एक बहुत ही कठिन विशेष प्रतिपरावर्तन विलेपन, एक अच्छा मेल है जो एक हीरे की कठोर सतह का उत्पादन करता है जो बहुत अधिक पर्यावरणीय दुरुपयोग का सामना कर सकता है।[72][73]
इलेक्ट्रॉनिक्स
जर्मेनियम को सिलिकॉन के साथ मिश्रित किया जा सकता है, क्योकि सिलिकॉन-जर्मेनियम मिश्रित धातुएं तेजी से उच्च गति एकीकृत परिपथ के लिए एक महत्वपूर्ण अर्धचालक सामग्री बन रही हैं। Si-SiGe हेटेरोजंक्शन के गुणधर्मों का उपयोग करने वाले परिपथ सिलिकॉन का उपयोग करने वाले परिपथो की तुलना में बहुत तेज हो सकते हैं।[74] [27] सिलिकॉन चिप उद्योग की स्थापित और कम लागत की उत्पादन तकनीकों के साथ, उच्च-गति गुणधर्मों वाले SiGe चिप्स बनाए जा सकते हैं।[27]
उच्च दक्षता वाले सौर पेनल जर्मेनियम का एक प्रमुख उपयोग हैं। क्योंकि जर्मेनियम और गैलियम आर्सेनाइड में लगभग समान जालक स्थिरांक होता है, इसलिए जर्मेनियम सब्सट्रेट का उपयोग गैलियम-आरिनाइड सौर सेल्स बनाने के लिए किया जा सकता है।[75] जर्मेनियम अंतरिक्ष अनुप्रयोगों के लिए उच्च दक्षता वाले बहुपक्षीय प्रकाशवोल्टीय सेल के लिए वेफर्स का सब्सट्रेट है, जैसे कि मंगल गवेक्षण रोवर्स, जो जर्मेनियम सेल्स पर ट्रिपल-जंक्शन गैलियम आर्सेनाइड का उपयोग करते हैं।[76] ऑटोमोबाइल हेडलाइट्स और एलसीडी स्क्रीन को बैकलाइट करने के लिए उपयोग की जाने वाली उच्च चमक वाली एलईडी भी एक महत्वपूर्ण अनुप्रयोग है।[27]
ऊष्मारोधी पर जर्मेनियम (GeOI) सब्सट्रेट को लघु चिप्स पर सिलिकॉन के लिए एक संभावित प्रतिस्थापन के रूप में देखा जाता है।[27] GeOI सब्सट्रेट पर आधारित CMOS परिपथ हाल ही में बताया गया है।[77] इलेक्ट्रॉनिक्स में अन्य उपयोगों में फ्लोरोसेंट लैंप में फॉस्फोरस [32]और ठोस- अवस्था प्रकाश उत्सर्जक डायोड (एलईडी) सम्मिलित हैं।[27] जर्मेनियम ट्रांजिस्टर्स को कुछ संगीतकारों द्वारा उपयोग किया जाता है विशेषकर पहले रॉक और रोल युग के डलास आर्बिटर फज़ फेस के पेडल्स में, जो "फज़"-टोन की विशेष ध्वनि गुणलक्षण को पुनर्निर्मित करना चाहते हैं। [78]
जर्मेनियम को एक संभावित सामग्री के रूप में अध्ययन किया गया है जो प्रत्यारोपण जैव इलेक्ट्रानिकी संवेदको के लिए हो सकती हैं, जो शरीर में विषारीत होते हैं और किसी भी हानिकारक हाइड्रोजन गैस उत्पन्न किये बिना, जिंक ऑक्साइड और इंडियम गैलियम जिंक ऑक्साइड के आधारित कार्यान्वयन को बदलते हैं।
अन्य उपयोग
जर्मेनियम डाइऑक्साइड का उपयोग पॉलीइथाइलीन टेरेफथलेट (पीईटी) के उत्पादन में बहुलकीकरण के लिए उत्प्रेरक में भी किया जाता है।[79] इस पॉलिएस्टर की उच्च चमक जापान में विपणन की जाने वाली पीईटी बोतलों के लिए विशेष रूप से पसंद की जाती है।[79] संयुक्त राज्य अमेरिका में, बहुलकीकरण उत्प्रेरक के लिए जर्मेनियम का उपयोग नहीं किया जाता है।[27]
सिलिका (SIO2) और जर्मेनियम डाइऑक्साइड (GeO2) के बीच समानता के कारण, कुछ गैस वर्णलेखिकी स्तंभ में सिलिका स्थिर अवस्था को GeO2 द्वारा प्रतिस्थापित किया जा सकता है2।[80]
हाल ही के वर्षों में, जर्मेनियम की बहुमूल्य धातु मिश्रणों में बढ़ते हुए उपयोग हुई है। स्टर्लिंग सिल्वर मिश्रणों में, उदाहरण के लिए, यह आग का स्केल कम करता है, धूमिल प्रतिरोध को बढ़ाता है, और अवक्षेपण कठोरण में सुधार करता है। धूमिल-रोधी चांदी मिश्र धातु ट्रेडमार्क वाले अर्जेन्टियम में 1.2% जर्मेनियम होता है।[27]
एकल क्रिस्टल उच्च शुद्धता वाले जर्मेनियम से बने अर्धचालक संसूचक विकिरण स्रोतों की सटीक पहचान कर सकते हैं - उदाहरण के लिए हवाई अड्डे की सुरक्षा में।[81] जर्मेनियम एकल क्रिस्टल न्यूट्रॉन प्रकीर्णन और सिंक्रोट्रॉन एक्स-रे विवर्तन में उपयोग की जाने वाली बीमलाइन के लिए और एकवर्णक के लिए उपयोगी है। न्यूट्रॉन और उच्च ऊर्जा एक्स-रे अनुप्रयोगों में सिलिकॉन की तुलना में परावर्तनशीलता के लाभ हैं।[82] उच्च शुद्धता वाले जर्मेनियम के क्रिस्टल का उपयोग गामा स्पेक्ट्रोस्कोपी और गहरे द्रव्य की खोज के लिए संसूचको में किया जाता है।[83] फॉस्फोरस, क्लोरीन और सल्फर के निर्धारण के लिए एक्स-रे स्पेक्ट्रोमीटर में जर्मेनियम क्रिस्टल का भी उपयोग किया जाता है।[84]
जर्मेनियम स्पिनट्रोनिक्स और प्रचक्रण -आधारित क्वांटम कम्प्यूटिंग अनुप्रयोगों के लिए एक महत्वपूर्ण सामग्री के रूप में उभर रहा है। 2010 में, शोधकर्ताओं ने कमरे के तापमान प्रचक्रण परिवहन का प्रदर्शन किया[85] और हाल ही में जर्मेनियम में दाता इलेक्ट्रॉन प्रचक्रण में बहुत लंबे समय तक सुसंगतता देखी गई है।[86]
जर्मेनियम और स्वास्थ्य
जर्मेनियम को पौधों या जानवरों के स्वास्थ्य के लिए आवश्यक नहीं माना जाता है।[87] पर्यावरण में जर्मेनियम का स्वास्थ्य पर बहुत कम या कोई प्रभाव नहीं पड़ता है। इसका मुख्य कारण यह है कि यह सामान्य तौर पर केवल अयस्कों और कार्बनयुक्त सामग्रियों में एक सूक्ष्ममात्रिक तत्त्व के रूप में होता है, और विभिन्न औद्योगिक और इलेक्ट्रॉनिक अनुप्रयोगों में बहुत कम मात्रा में सम्मिलित होता है, जिनके अंतर्ग्रहण की संभावना नहीं होती है।[27] समान कारणों से, अंतिम उपयोग वाले जर्मेनियम का पर्यावरण पर जैव खतरे के रूप में बहुत कम प्रभाव पड़ता है। जर्मेनियम के कुछ प्रतिक्रियाशील मध्यवर्ती यौगिक जहरीले होते हैं (जिसके लिए नीचे सावधानियां देखें, नीचे)।[88]
जैविक और अकार्बनिक जर्मेनियम दोनों से बने जर्मेनियम पूरक को एक वैकल्पिक दवा के रूप में विपणन किया गया है जो ल्यूकेमिया और फेफड़ों के कैंसर का उपचार करने में सक्षम है।[24] हालांकि, इसके लाभ का कोई चिकित्सीय प्रमाण नहीं है, कुछ प्रमाण यह सुझाव देते है कि ऐसे पूरक हानिकारक हो सकते हैं।[87] अमेरिकी खाद्य एवं औषधि प्रशासन (एफडीए) के शोध ने निष्कर्ष निकाला है कि अकार्बनिक जर्मेनियम, जब पोषण पूरक के रूप में उपयोग किया जाता है, तो "मानव स्वास्थ्य के लिए संभावित संकटदायी होता है।[47]
कुछ जर्मेनियम यौगिकों को वैकल्पिक चिकित्सा चिकित्सकों द्वारा गैर-एफडीए-स्वीकृत इंजेक्टेबल विलयन के रूप में प्रशासित किया गया है। सबसे पहले उपयोग किए जाने वाले जर्मेनियम के घुलनशील अकार्बनिक रूप, विशेष रूप से साइट्रेट-लैक्टेट नमक, के परिणामस्वरूप लंबे समय तक इनका उपयोग करने वाले व्यक्तियों में गुर्दे की शिथिलता, यकृत स्टीटोसिस और परिधीय न्यूरोपैथी की कुछ स्थितियाँ सामने आई। इन व्यक्तियों में प्लाज्मा और मूत्र जर्मेनियम सांद्रता, जिनमें से कई की मृत्यु हो गई, अंतर्जात स्तरों से अधिक परिमाण के कई क्रम थे। एक और हालिया कार्बनिक रूप, बीटा-कार्बोक्सीएथिलजर्मेनियम सेस्क्यूऑक्साइड (प्रोपेगर्मेनियम) ने विषाक्त प्रभावों के समान स्पेक्ट्रम का प्रदर्शन नहीं किया है।[89]
जर्मेनियम के कुछ यौगिकों में स्तनधारियों के लिए कम विषाक्तता होती है, लेकिन कुछ जीवाणुओ के प्रति ये विषाक्त प्रभाव प्रदर्शित करते हैं।[29]
रासायनिक रूप से प्रतिक्रियाशील जर्मेनियम यौगिकों के लिए सावधानियां
जबकि जर्मेनियम के उपयोग में स्वयं सावधानियों की आवश्यकता नहीं होती है, लेकिन जर्मेनियम के कुछ कृत्रिम रूप से उत्पादित यौगिक काफी प्रतिक्रियाशील होते हैं और संपर्क में आने पर मानव स्वास्थ्य के लिए उसी समय संकटदायी बन सकते है।उदाहरण के लिए, जर्मेनियम टेट्राक्लोराइड और जर्मेन (GeH4) क्रमशः एक तरल और एक गैस हैं, जो आंखों, त्वचा, फेफड़े और गले के लिए काफी उत्तेजनशील हो सकते हैं।
यह भी देखें
टिप्पणियाँ
- ↑ From Greek, argyrodite means silver-containing.[8]
- ↑ Just as the existence of the new element had been predicted, the existence of the planet Neptune had been predicted in about 1843 by the two mathematicians John Couch Adams and Urbain Le Verrier, using the calculation methods of celestial mechanics. They did this in attempts to explain the fact that the planet Uranus, upon very close observation, appeared to be being pulled slightly out of position in the sky.[11] James Challis started searching for it in July 1846, and he sighted this planet on September 23, 1846.[12]
- ↑ R. Hermann published claims in 1877 of his discovery of a new element beneath tantalum in the periodic table, which he named neptunium, after the Greek god of the oceans and seas.[13][14] However this metal was later recognized to be an alloy of the elements niobium and tantalum.[15] The name "neptunium" was later given to the synthetic element one step past uranium in the Periodic Table, which was discovered by nuclear physics researchers in 1940.[16]
संदर्भ
- ↑ "Standard Atomic Weights: Germanium". CIAAW. 2009.
- ↑ "New Type of Zero-Valent Tin Compound". Chemistry Europe. 27 August 2016.
- ↑ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ↑ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 0-8493-0464-4.
- ↑ 5.0 5.1 5.2 5.3 "Properties of Germanium". Ioffe Institute.
- ↑ Avarmaa, Katri; Klemettinen, Lassi; O’Brien, Hugh; Taskinen, Pekka; Jokilaakso, Ari (June 2019). "Critical Metals Ga, Ge and In: Experimental Evidence for Smelter Recovery Improvements". Minerals (in English). 9 (6): 367. Bibcode:2019Mine....9..367A. doi:10.3390/min9060367.
- ↑ Kaji, Masanori (2002). "D. I. Mendeleev's concept of chemical elements and The Principles of Chemistry" (PDF). Bulletin for the History of Chemistry. 27 (1): 4–16. Archived from the original (PDF) on 2008-12-17. Retrieved 2008-08-20.
- ↑ Argyrodite – Ag
8GeS
6[[Category: Templates Vigyan Ready]] (PDF) (Report). Mineral Data Publishing. Archived (PDF) from the original on 2016-03-03. Retrieved 2008-09-01.{{cite report}}: URL–wikilink conflict (help) - ↑ 9.0 9.1 9.2 9.3 9.4 Winkler, Clemens (1887). "Mittheilungen über des Germanium. Zweite Abhandlung". J. Prak. Chemie (in Deutsch). 36 (1): 177–209. doi:10.1002/prac.18870360119. Archived from the original on 2012-11-03. Retrieved 2008-08-20.
- ↑ 10.0 10.1 10.2 10.3 Winkler, Clemens (1887). "Germanium, Ge, a New Nonmetal Element". Berichte der Deutschen Chemischen Gesellschaft (in Deutsch). 19 (1): 210–211. doi:10.1002/cber.18860190156. Archived from the original on December 7, 2008.
- ↑ Adams, J. C. (November 13, 1846). "Explanation of the observed irregularities in the motion of Uranus, on the hypothesis of disturbance by a more distant planet". Monthly Notices of the Royal Astronomical Society. 7 (9): 149–152. Bibcode:1846MNRAS...7..149A. doi:10.1093/mnras/7.9.149. Archived (PDF) from the original on May 2, 2019. Retrieved August 25, 2019.
- ↑ Challis, Rev. J. (November 13, 1846). "Account of observations at the Cambridge observatory for detecting the planet exterior to Uranus". Monthly Notices of the Royal Astronomical Society. 7 (9): 145–149. Bibcode:1846MNRAS...7..145C. doi:10.1093/mnras/7.9.145. Archived (PDF) from the original on May 4, 2019. Retrieved August 25, 2019.
- ↑ Sears, Robert (July 1877). Scientific Miscellany. p. 131. ISBN 978-0-665-50166-1. OCLC 16890343.
{{cite book}}:|journal=ignored (help) - ↑ "Editor's Scientific Record". Harper's New Monthly Magazine. 55 (325): 152–153. June 1877. Archived from the original on 2012-05-26. Retrieved 2008-09-22.
- ↑ van der Krogt, Peter. "Elementymology & Elements Multidict: Niobium". Archived from the original on 2010-01-23. Retrieved 2008-08-20.
- ↑ Westgren, A. (1964). "The Nobel Prize in Chemistry 1951: presentation speech". Nobel Lectures, Chemistry 1942–1962. Elsevier. Archived from the original on 2008-12-10. Retrieved 2008-09-18.
- ↑ "Germanium, a New Non-Metallic Element". The Manufacturer and Builder: 181. 1887. Archived from the original on 2008-12-19. Retrieved 2008-08-20.
- ↑ Brunck, O. (1886). "Obituary: Clemens Winkler". Berichte der Deutschen Chemischen Gesellschaft (in Deutsch). 39 (4): 4491–4548. doi:10.1002/cber.190603904164. Archived from the original on 2020-08-01. Retrieved 2020-06-07.
- ↑ de Boisbaudran, M. Lecoq (1886). "Sur le poids atomique du germanium". Comptes Rendus (in français). 103: 452. Archived from the original on 2013-06-20. Retrieved 2008-08-20.
- ↑ 20.0 20.1 Haller, E. E. (2006-06-14). "Germanium: From Its Discovery to SiGe Devices" (PDF). Department of Materials Science and Engineering, University of California, Berkeley, and Materials Sciences Division, Lawrence Berkeley National Laboratory, Berkeley. Archived (PDF) from the original on 2019-07-10. Retrieved 2008-08-22.
- ↑ W. K. (1953-05-10). "Germanium for Electronic Devices". The New York Times. Archived from the original on 2013-06-13. Retrieved 2008-08-22.
- ↑ "1941 – Semiconductor diode rectifiers serve in WW II". Computer History Museum. Archived from the original on 2008-09-24. Retrieved 2008-08-22.
- ↑ "SiGe History". University of Cambridge. Archived from the original on 2008-08-05. Retrieved 2008-08-22.
- ↑ 24.0 24.1 24.2 24.3 24.4 24.5 Halford, Bethany (2003). "Germanium". Chemical & Engineering News. American Chemical Society. Archived from the original on 2008-05-13. Retrieved 2008-08-22.
- ↑ Bardeen, J.; Brattain, W. H. (1948). "The Transistor, A Semi-Conductor Triode". Physical Review. 74 (2): 230–231. Bibcode:1948PhRv...74..230B. doi:10.1103/PhysRev.74.230.
- ↑ "Electronics History 4 – Transistors". National Academy of Engineering. Archived from the original on 2007-10-20. Retrieved 2008-08-22.
- ↑ 27.00 27.01 27.02 27.03 27.04 27.05 27.06 27.07 27.08 27.09 27.10 27.11 27.12 27.13 27.14 U.S. Geological Survey (2008). "Germanium – Statistics and Information". U.S. Geological Survey, Mineral Commodity Summaries. Archived from the original on 2008-09-16. Retrieved 2008-08-28.
Select 2008
- ↑ Teal, Gordon K. (July 1976). "Single Crystals of Germanium and Silicon-Basic to the Transistor and Integrated Circuit". IEEE Transactions on Electron Devices. ED-23 (7): 621–639. Bibcode:1976ITED...23..621T. doi:10.1109/T-ED.1976.18464. S2CID 11910543.
- ↑ 29.0 29.1 Emsley, John (2001). Nature's Building Blocks. Oxford: Oxford University Press. pp. 506–510. ISBN 978-0-19-850341-5.
- ↑ Agnese, R.; Aralis, T.; Aramaki, T.; Arnquist, I. J.; Azadbakht, E.; Baker, W.; Banik, S.; Barker, D.; Bauer, D. A. (2018-08-27). "Energy loss due to defect formation from 206Pb recoils in SuperCDMS germanium detectors". Applied Physics Letters. 113 (9): 092101. arXiv:1805.09942. Bibcode:2018ApPhL.113i2101A. doi:10.1063/1.5041457. ISSN 0003-6951. S2CID 118627298.
- ↑ 31.0 31.1 31.2 31.3 31.4 31.5 31.6 31.7 31.8 Holleman, A. F.; Wiberg, E.; Wiberg, N. (2007). Lehrbuch der Anorganischen Chemie (102nd ed.). de Gruyter. ISBN 978-3-11-017770-1. OCLC 145623740.
- ↑ 32.0 32.1 "Germanium". Los Alamos National Laboratory. Archived from the original on 2011-06-22. Retrieved 2008-08-28.
- ↑ Chardin, B. (2001). "Dark Matter: Direct Detection". In Binetruy, B (ed.). The Primordial Universe: 28 June – 23 July 1999. Springer. p. 308. ISBN 978-3-540-41046-1.
- ↑ Lévy, F.; Sheikin, I.; Grenier, B.; Huxley, A. (August 2005). "Magnetic field-induced superconductivity in the ferromagnet URhGe". Science. 309 (5739): 1343–1346. Bibcode:2005Sci...309.1343L. doi:10.1126/science.1115498. PMID 16123293. S2CID 38460998.
- ↑ Givargizov, E. I. (1972). "Morphology of Germanium Whiskers". Kristall und Technik. 7 (1–3): 37–41. doi:10.1002/crat.19720070107.
- ↑ Tabet, N; Salim, Mushtaq A. (1998). "KRXPS study of the oxidation of Ge(001) surface". Applied Surface Science. 134 (1–4): 275–282. Bibcode:1998ApSS..134..275T. doi:10.1016/S0169-4332(98)00251-7.
- ↑ 37.0 37.1 37.2 37.3 37.4 37.5 37.6 37.7 37.8 Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ Tabet, N; Salim, M. A.; Al-Oteibi, A. L. (1999). "XPS study of the growth kinetics of thin films obtained by thermal oxidation of germanium substrates". Journal of Electron Spectroscopy and Related Phenomena. 101–103: 233–238. doi:10.1016/S0368-2048(98)00451-4.
- ↑ Bayya, Shyam S.; Sanghera, Jasbinder S.; Aggarwal, Ishwar D.; Wojcik, Joshua A. (2002). "Infrared Transparent Germanate Glass-Ceramics". Journal of the American Ceramic Society. 85 (12): 3114–3116. doi:10.1111/j.1151-2916.2002.tb00594.x.
- ↑ Drugoveiko, O. P.; Evstrop'ev, K. K.; Kondrat'eva, B. S.; Petrov, Yu. A.; Shevyakov, A. M. (1975). "Infrared reflectance and transmission spectra of germanium dioxide and its hydrolysis products". Journal of Applied Spectroscopy. 22 (2): 191–193. Bibcode:1975JApSp..22..191D. doi:10.1007/BF00614256. S2CID 97581394.
- ↑ Lightstone, A. W.; McIntyre, R. J.; Lecomte, R.; Schmitt, D. (1986). "A Bismuth Germanate-Avalanche Photodiode Module Designed for Use in High Resolution Positron Emission Tomography". IEEE Transactions on Nuclear Science. 33 (1): 456–459. Bibcode:1986ITNS...33..456L. doi:10.1109/TNS.1986.4337142. S2CID 682173.
- ↑ Johnson, Otto H. (1952). "Germanium and its Inorganic Compounds". Chem. Rev. 51 (3): 431–469. doi:10.1021/cr60160a002.
- ↑ Fröba, Michael; Oberender, Nadine (1997). "First synthesis of mesostructured thiogermanates". Chemical Communications (18): 1729–1730. doi:10.1039/a703634e.
- ↑ Beattie, I.R.; Jones, P.J.; Reid, G.; Webster, M. (1998). "The Crystal Structure and Raman Spectrum of Ge5Cl12·GeCl4 and the Vibrational Spectrum of Ge2Cl6". Inorg. Chem. 37 (23): 6032–6034. doi:10.1021/ic9807341. PMID 11670739.
- ↑ Satge, Jacques (1984). "Reactive intermediates in organogermanium chemistry". Pure Appl. Chem. 56 (1): 137–150. doi:10.1351/pac198456010137. S2CID 96576323.
- ↑ Quane, Denis; Bottei, Rudolph S. (1963). "Organogermanium Chemistry". Chemical Reviews. 63 (4): 403–442. doi:10.1021/cr60224a004.
- ↑ 47.0 47.1 Tao, S. H.; Bolger, P. M. (June 1997). "Hazard Assessment of Germanium Supplements". Regulatory Toxicology and Pharmacology. 25 (3): 211–219. doi:10.1006/rtph.1997.1098. PMID 9237323. Archived from the original on 2020-03-10. Retrieved 2019-06-30.
- ↑ Broadwith, Phillip (25 March 2012). "Germanium-oxygen double bond takes centre stage". Chemistry World. Archived from the original on 2014-05-17. Retrieved 2014-05-15.
- ↑ 49.0 49.1 49.2 Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The NUBASE evaluation of nuclear and decay properties", Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729....3A, doi:10.1016/j.nuclphysa.2003.11.001
- ↑ 50.0 50.1 Perreault, Bruce A. "Alpha Fusion Electrical Energy Valve", US Patent 7800286, issued September 21, 2010. PDF copy at the Wayback Machine (archived October 12, 2007)
- ↑ Sterling, N. C.; Dinerstein, Harriet L.; Bowers, Charles W. (2002). "Discovery of Enhanced Germanium Abundances in Planetary Nebulae with the Far Ultraviolet Spectroscopic Explorer". The Astrophysical Journal Letters. 578 (1): L55–L58. arXiv:astro-ph/0208516. Bibcode:2002ApJ...578L..55S. doi:10.1086/344473. S2CID 119395123.
- ↑ Cowan, John (2003-05-01). "Astronomy: Elements of surprise". Nature. 423 (29): 29. Bibcode:2003Natur.423...29C. doi:10.1038/423029a. PMID 12721614. S2CID 4330398.
- ↑ Kunde, V.; Hanel, R.; Maguire, W.; Gautier, D.; Baluteau, J. P.; Marten, A.; Chedin, A.; Husson, N.; Scott, N. (1982). "The tropospheric gas composition of Jupiter's north equatorial belt /NH3, PH3, CH3D, GeH4, H2O/ and the Jovian D/H isotopic ratio". Astrophysical Journal. 263: 443–467. Bibcode:1982ApJ...263..443K. doi:10.1086/160516.
- ↑ 54.0 54.1 54.2 54.3 54.4 Höll, R.; Kling, M.; Schroll, E. (2007). "Metallogenesis of germanium – A review". Ore Geology Reviews. 30 (3–4): 145–180. doi:10.1016/j.oregeorev.2005.07.034.
- ↑ Frenzel, Max (2016). "The distribution of gallium, germanium and indium in conventional and non-conventional resources – Implications for global availability (PDF Download Available)". ResearchGate. Unpublished. doi:10.13140/rg.2.2.20956.18564. Archived from the original on 2018-10-06. Retrieved 2017-06-10.
- ↑ Roberts, Andrew C.; et al. (December 2004). "Eyselite, Fe3+Ge34+O7(OH), a new mineral species from Tsumeb, Namibia". The Canadian Mineralogist. 42 (6): 1771–1776. doi:10.2113/gscanmin.42.6.1771.
- ↑ "Archived copy" (PDF). Archived (PDF) from the original on 2018-10-06. Retrieved 2018-10-06.
{{cite web}}: CS1 maint: archived copy as title (link) - ↑ "Archived copy" (PDF). Archived (PDF) from the original on 2020-03-20. Retrieved 2018-10-06.
{{cite web}}: CS1 maint: archived copy as title (link) - ↑ 59.0 59.1 Goldschmidt, V. M. (1930). "Ueber das Vorkommen des Germaniums in Steinkohlen und Steinkohlenprodukten". Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse: 141–167. Archived from the original on 2018-03-03. Retrieved 2008-08-25.
- ↑ 60.0 60.1 Goldschmidt, V. M.; Peters, Cl. (1933). "Zur Geochemie des Germaniums". Nachrichten von der Gesellschaft der Wissenschaften zu Göttingen, Mathematisch-Physikalische Klasse: 141–167. Archived from the original on 2008-12-01. Retrieved 2008-08-25.
- ↑ Bernstein, L (1985). "Germanium geochemistry and mineralogy". Geochimica et Cosmochimica Acta. 49 (11): 2409–2422. Bibcode:1985GeCoA..49.2409B. doi:10.1016/0016-7037(85)90241-8.
- ↑ Frenzel, Max; Hirsch, Tamino; Gutzmer, Jens (July 2016). "Gallium, germanium, indium and other minor and trace elements in sphalerite as a function of deposit type – A meta-analysis". Ore Geology Reviews. 76: 52–78. doi:10.1016/j.oregeorev.2015.12.017.
- ↑ Frenzel, Max; Ketris, Marina P.; Gutzmer, Jens (2013-12-29). "On the geological availability of germanium". Mineralium Deposita. 49 (4): 471–486. Bibcode:2014MinDe..49..471F. doi:10.1007/s00126-013-0506-z. ISSN 0026-4598. S2CID 129902592.
- ↑ Frenzel, Max; Ketris, Marina P.; Gutzmer, Jens (2014-01-19). "Erratum to: On the geological availability of germanium". Mineralium Deposita. 49 (4): 487. Bibcode:2014MinDe..49..487F. doi:10.1007/s00126-014-0509-4. ISSN 0026-4598. S2CID 140620827.
- ↑ R.N. Soar (1977). USGS Minerals Information. January 2003, January 2004, January 2005, January 2006, January 2007, January 2010. ISBN 978-0-85934-039-7. OCLC 16437701. Archived from the original on 2013-05-07. Retrieved 2013-04-22.
{{cite book}}:|journal=ignored (help) - ↑ 66.0 66.1 66.2 Naumov, A. V. (2007). "World market of germanium and its prospects". Russian Journal of Non-Ferrous Metals. 48 (4): 265–272. doi:10.3103/S1067821207040049. S2CID 137187498.
- ↑ 67.0 67.1 Moskalyk, R. R. (2004). "Review of germanium processing worldwide". Minerals Engineering. 17 (3): 393–402. doi:10.1016/j.mineng.2003.11.014.
- ↑ Rieke, G. H. (2007). "Infrared Detector Arrays for Astronomy". Annual Review of Astronomy and Astrophysics. 45 (1): 77–115. Bibcode:2007ARA&A..45...77R. doi:10.1146/annurev.astro.44.051905.092436. S2CID 26285029.
- ↑ 69.0 69.1 69.2 Brown, Jr., Robert D. (2000). "Germanium" (PDF). U.S. Geological Survey. Archived (PDF) from the original on 2011-06-08. Retrieved 2008-09-22.
- ↑ "Chapter III: Optical Fiber For Communications" (PDF). Stanford Research Institute. Archived (PDF) from the original on 2014-12-05. Retrieved 2008-08-22.
- ↑ "Understanding Recordable & Rewritable DVD" (PDF) (First ed.). Optical Storage Technology Association (OSTA). Archived from the original (PDF) on 2009-04-19. Retrieved 2008-09-22.
- ↑ Lettington, Alan H. (1998). "Applications of diamond-like carbon thin films". Carbon. 36 (5–6): 555–560. doi:10.1016/S0008-6223(98)00062-1.
- ↑ Gardos, Michael N.; Bonnie L. Soriano; Steven H. Propst (1990). Feldman, Albert; Holly, Sandor (eds.). "Study on correlating rain erosion resistance with sliding abrasion resistance of DLC on germanium". Proc. SPIE. SPIE Proceedings. 1325 (Mechanical Properties): 99. Bibcode:1990SPIE.1325...99G. doi:10.1117/12.22449. S2CID 137425193.
- ↑ Washio, K. (2003). "SiGe HBT and BiCMOS technologies for optical transmission and wireless communication systems". IEEE Transactions on Electron Devices. 50 (3): 656–668. Bibcode:2003ITED...50..656W. doi:10.1109/TED.2003.810484.
- ↑ Bailey, Sheila G.; Raffaelle, Ryne; Emery, Keith (2002). "Space and terrestrial photovoltaics: synergy and diversity". Progress in Photovoltaics: Research and Applications. 10 (6): 399–406. Bibcode:2002sprt.conf..202B. doi:10.1002/pip.446. hdl:2060/20030000611. S2CID 98370426.
- ↑ Crisp, D.; Pathare, A.; Ewell, R. C. (January 2004). "The performance of gallium arsenide/germanium solar cells at the Martian surface". Acta Astronautica. 54 (2): 83–101. Bibcode:2004AcAau..54...83C. doi:10.1016/S0094-5765(02)00287-4.
- ↑ Wu, Heng; Ye, Peide D. (August 2016). "Fully Depleted Ge CMOS Devices and Logic Circuits on Si" (PDF). IEEE Transactions on Electron Devices. 63 (8): 3028–3035. Bibcode:2016ITED...63.3028W. doi:10.1109/TED.2016.2581203. S2CID 3231511. Archived (PDF) from the original on 2019-03-06. Retrieved 2019-03-04.
- ↑ Szweda, Roy (2005). "Germanium phoenix". III-Vs Review. 18 (7): 55. doi:10.1016/S0961-1290(05)71310-7.
- ↑ 79.0 79.1 Thiele, Ulrich K. (2001). "The Current Status of Catalysis and Catalyst Development for the Industrial Process of Poly(ethylene terephthalate) Polycondensation". International Journal of Polymeric Materials. 50 (3): 387–394. doi:10.1080/00914030108035115. S2CID 98758568.
- ↑ Fang, Li; Kulkarni, Sameer; Alhooshani, Khalid; Malik, Abdul (2007). "Germania-Based, Sol-Gel Hybrid Organic-Inorganic Coatings for Capillary Microextraction and Gas Chromatography". Anal. Chem. 79 (24): 9441–9451. doi:10.1021/ac071056f. PMID 17994707.
- ↑ Keyser, Ronald; Twomey, Timothy; Upp, Daniel. "Performance of Light-Weight, Battery-Operated, High Purity Germanium Detectors for Field Use" (PDF). Oak Ridge Technical Enterprise Corporation (ORTEC). Archived from the original (PDF) on October 26, 2007. Retrieved 2008-09-06.
- ↑ Ahmed, F. U.; Yunus, S. M.; Kamal, I.; Begum, S.; Khan, Aysha A.; Ahsan, M. H.; Ahmad, A. A. Z. (1996). "Optimization of Germanium for Neutron Diffractometers". International Journal of Modern Physics E. 5 (1): 131–151. Bibcode:1996IJMPE...5..131A. doi:10.1142/S0218301396000062.
- ↑ Diehl, R.; Prantzos, N.; Vonballmoos, P. (2006). "Astrophysical constraints from gamma-ray spectroscopy". Nuclear Physics A. 777 (2006): 70–97. arXiv:astro-ph/0502324. Bibcode:2006NuPhA.777...70D. CiteSeerX 10.1.1.256.9318. doi:10.1016/j.nuclphysa.2005.02.155. S2CID 2360391.
- ↑ Eugene P. Bertin (1970). Principles and practice of X-ray spectrometric analysis, Chapter 5.4 – Analyzer crystals, Table 5.1, p. 123; Plenum Press
- ↑ Shen, C.; Trypiniotis, T.; Lee, K. Y.; Holmes, S. N.; Mansell, R.; Husain, M.; Shah, V.; Li, X. V.; Kurebayashi, H. (2010-10-18). "Spin transport in germanium at room temperature" (PDF). Applied Physics Letters. 97 (16): 162104. Bibcode:2010ApPhL..97p2104S. doi:10.1063/1.3505337. ISSN 0003-6951. Archived (PDF) from the original on 2017-09-22. Retrieved 2018-11-16.
- ↑ Sigillito, A. J.; Jock, R. M.; Tyryshkin, A. M.; Beeman, J. W.; Haller, E. E.; Itoh, K. M.; Lyon, S. A. (2015-12-07). "Electron Spin Coherence of Shallow Donors in Natural and Isotopically Enriched Germanium". Physical Review Letters. 115 (24): 247601. arXiv:1506.05767. Bibcode:2015PhRvL.115x7601S. doi:10.1103/PhysRevLett.115.247601. PMID 26705654. S2CID 13299377.
- ↑ 87.0 87.1 Ades TB, ed. (2009). "Germanium". American Cancer Society Complete Guide to Complementary and Alternative Cancer Therapies (2nd ed.). American Cancer Society. pp. 360–363. ISBN 978-0944235713.
- ↑ Brown Jr., Robert D. Commodity Survey:Germanium (PDF) (Report). US Geological Surveys. Archived (PDF) from the original on 2018-03-04. Retrieved 2008-09-09.
- ↑ Baselt, R. (2008). Disposition of Toxic Drugs and Chemicals in Man (8th ed.). Foster City, CA: Biomedical Publications. pp. 693–694.
बाहरी संबंध
- Germanium at The Periodic Table of Videos (University of Nottingham)





