होमिओबॉक्स: Difference between revisions
m (added Category:Vigyan Ready using HotCat) |
m (6 revisions imported from alpha:होमिओबॉक्स) |
(No difference)
| |
Latest revision as of 14:56, 14 December 2023
होमिओबॉक्स एक न्यूक्लिक अम्ल अनुक्रम है, जो लगभग 180 क्षारक युग्म लंबा है, जो भ्रूण के विकास के प्रारम्भिक चरणों में बड़े मापक्रम पर शारीरिक विशेषताओं को नियंत्रित करता है। होमिओबॉक्स में उत्परिवर्तन पूर्ण विकसित जीव की बड़े मापक्रम पर शारीरिक विशेषताओं को बदल सकता है।
होमिओबॉक्स जीन के भीतर पाए जाते हैं जो जानवरों, कवक, पौधों और कई एकल कोशिका सुकेंद्रकी में शारीरिक विकास (संरचनाविकास) के प्रतिरूप के नियमन में सम्मिलित होते हैं।[1] होमिओबॉक्स जीन समप्रक्षेत्र प्रोटीन उत्पादों को कूटलेखन करते हैं जो प्रतिलेखन कारक हैं जो एक विशिष्ट प्रोटीन गुना संरचना साझा करते हैं जो लक्ष्य जीन की अभिव्यक्ति को विनियमित करने के लिए डीएनए को बांधते हैं। [2][3][1] समप्रक्षेत्र प्रोटीन प्रारंभिक भ्रूण विकास के उपरान्त जीन अभिव्यक्ति और कोशिका विभेदन को नियंत्रित करते हैं, इस प्रकार होमिओबॉक्स जीन में उत्परिवर्तन विकासात्मक विकारों का कारण बन सकता है। [4]
अंगांतरण विलियम बेटसन द्वारा गढ़ा गया एक शब्द है, जो शरीर के एक अलग हिस्से को दूसरे शरीर के अंग के साथ बदलने का वर्णन करता है, उदाहरण के लिए. एंटेनापीडिया-फल मक्खी के सिर पर लगे एंटीना को पैरों से बदलना।[5] होमिओबॉक्स और समप्रक्षेत्र शब्दों में होमियो-उपसर्ग इस उत्परिवर्तन से उत्पन्न होता है, जो तब देखा जाता है जब इनमें से कुछ जीन जानवरों में उत्परिवर्तित होते हैं। होमिओबॉक्स कार्यक्षेत्र को सबसे पहले कई ड्रोसोफिला समापवर्धी और विभाजन प्रोटीन में पहचाना गया था, लेकिन अब इसे कशेरुक सहित कई अन्य जानवरों में अच्छी तरह से संरक्षित माना जाता है। [2][6][7]
खोज
होमिओबॉक्स जीन के अस्तित्व की खोज सबसे पहले ड्रोसोफिला में समापवर्धी परिवर्तन के लिए उत्तरदायी जीन को अलग करके की गई थी, जहां पैर अपेक्षित एंटीना के स्थान पर सिर से बढ़ते हैं। वाल्टर गेह्रिंग ने एंटेनापेडिया नामक एक जीन की पहचान की जो इस समापवर्धी समलक्षणी का कारण बना था। [8] एंटेनापीडिया के विश्लेषण से पता चला कि इस जीन में 180 बेस जोड़ी अनुक्रम सम्मिलित था जो डीएनए आबद्धकर कार्यक्षेत्र को कूटलेखित करता था, जिसे विलियम मैकगिनिस ने होमिओबॉक्स कहा था। [9] एंटीनापीडिया होमिओबॉक्स अनुक्रम वाले अतिरिक्त ड्रोसोफिला जीन के अस्तित्व की विवरणी स्वतंत्र रूप से अर्न्स्ट हैफेन, माइकल लेविन (जीवविज्ञानी), विलियम मैकगिनिस और स्विट्जरलैंड में बेसल विश्वविद्यालय के वाल्टर जैकब गेह्रिंग और इंडियाना विश्वविद्यालय (ब्लूमिंगटन) 1984 में ब्लूमिंगटन, इंडियाना मेंके मैथ्यू पी. स्कॉट और एमी वेनर द्वारा की गई थी।[10][11] एडवर्ड एम. डी रॉबर्टिस और विलियम मैकगिनिस द्वारा समजात जीनों के अलगाव से पता चला कि विभिन्न प्रजातियों के कई जीनों में होमिओबॉक्स सम्मिलित था। [12][13] होमिओबॉक्स युक्त जीनों के बीच विकासवादी संबंधों का विवरण देने वाले बाद के जातिवृत्तिक अध्ययनों से पता चला कि ये जीन सभी खोजक जानवरों में उपस्थित हैं।
समप्रक्षेत्र संरचना
विशिष्ट समप्रक्षेत्र प्रोटीन वलय में तीन ऐल्का कुंडलिनी से बना 60- एमिनो अम्ल लंबा कार्यक्षेत्र होता है। निम्नलिखित आम सहमति अनुक्रम समप्रक्षेत्र (~ 60 अमीनो अम्ल श्रृंखला) दिखाता है:[14]
Helix 1 Helix 2 Helix 3/4
RRRKRTAYTRYQLLELEKEएफHएफNRYLTRRRRIELAHSLNLTERHIKIWएफQNRRMKWKKEN
....|....|....|....|....|....|....|....|....|....|....|....|
10 20 30 40 50 60
कुंडली 2 और कुंडली 3 एक तथाकथित कुंडली-पंक्ति-कुंडली (एचटीएच) संरचना बनाते हैं, जहां दो अल्फा कुंडली एक छोटे विपाश क्षेत्र से जुड़े होते हैं। समप्रक्षेत्र के एन-अवसानक दो हेलिक्स प्रतिसमांतर (जैव रसायन) हैं और लंबे सी अवसानक कुंडली पहले दो द्वारा स्थापित अक्षों के लगभग लंबवत हैं। यह तीसरा कुंडली है जो कई हाइड्रोजन आबंध और जलविरागी अन्योन्यक्रिया के साथ-साथ पानी के अणुओं के माध्यम से अप्रत्यक्ष पारस्परिक प्रभाव के माध्यम से डीएनए के साथ सीधे संपर्क करता है, जो डीएनए के प्रमुख खांचे के भीतर विशिष्ट पार्श्व शृंखला और उजागर न्यूक्लियोटाइड के बीच होता है। [6]
सुकेंद्रकी में समप्रक्षेत्र प्रोटीन पाए जाते हैं। [1] एचटीएच रूपांकन के माध्यम से, वे अकेन्द्रिकिक प्रतिलेखन कारकों के साथ सीमित अनुक्रम समानता और संरचनात्मक समानता साझा करते हैं,[15] जैसे कि लैम्ब्डा फेज प्रोटीन जो प्राक्केंद्रकी में जीन की अभिव्यक्ति को बदल देता है। एचटीएच मोटिफ कुछ अनुक्रम समानता दिखाता है लेकिन डीएनए-आबद्धकर प्रोटीन (उदाहरण के लिए, प्रोटीन फलन अवलोकन और दमनकारी प्रोटीन, समप्रक्षेत्र प्रोटीन इत्यादि) की एक विस्तृत श्रृंखला में एक समान संरचना दिखाता है। इन विभिन्न प्रोटीनों में एचटीएच रूपांकनों के बीच एक प्रमुख अंतर ग्लाइसिन के लिए त्रिविम रासायनिक आवश्यकता से उत्पन्न होता है, जो मुख्य श्रृंखला के साथ बीटा-कार्बन के स्टेरिक हस्तक्षेप से बचने के लिए आवश्यक है: सीआरओ और दमनकारी प्रोटीन के लिए ग्लाइसिन अनिवार्य प्रतीत होता है, जबकि कई घरेलू और अन्य डीएनए-बाध्यकारी प्रोटीनों के लिए आवश्यकता में छूट दी गई है।
अनुक्रम विशिष्टता
समप्रक्षेत्र विशेष रूप से और गैर-विशेष रूप से बी-डीएनए दोनों को सी-अवसानक मान्यता कुंडली के साथ डीएनए के प्रमुख खांचे में संरेखित कर सकता है और एन-अंतक पर असंरचित पेप्टाइड पूंछ को छोटे खांचे में संरेखित कर सकता है। प्रत्यभिज्ञा कुंडली और अन्तर-कुंडली विपाश्स आर्जीनिन और लाइसिन अवशेषों से समृद्ध हैं, जो डीएनए बैकबोन में हाइड्रोजन बंध बनाते हैं। कुंडली संकुलन को स्थिर करने में मान्यता कुंडली सहायता के केंद्र में संरक्षण (आनुवांशिकी) जलभीत अपशिष्ट है। समप्रक्षेत्र प्रोटीन डीएनए अनुक्रम 5'-टीएएटी-3' के लिए प्राथमिकता दिखाते हैं; अनुक्रम-स्वतंत्र बंधन काफी कम आत्मीयता के साथ होता है। एकल समप्रक्षेत्र प्रोटीन की विशिष्टता सामान्यतः विशिष्ट लक्ष्य जीन संवर्धक को पहचानने के लिए पर्याप्त नहीं होती है, जिससे आबद्धकर अनुक्रम विशिष्टता और लक्ष्य जीन अभिव्यक्ति को नियंत्रित करने के लिए सहगुणक आबद्धकर एक महत्वपूर्ण तंत्र बन जाता है। उच्च लक्ष्य विशिष्टता प्राप्त करने के लिए, समप्रक्षेत्र प्रोटीन एक विशिष्ट लक्ष्य जीन के संवर्धक (जीव विज्ञान) को पहचानने के लिए अन्य प्रतिलेखन कारकों के साथ संकुल बनाते हैं।
जैविक कार्य
संरक्षित एचटीएच मोटिफ के डीएनए आबद्धकर गुणों के कारण समप्रक्षेत्र प्रोटीन अनुलेखन कारक के रूप में कार्य करते हैं। समप्रक्षेत्र प्रोटीन को प्रधान नियंत्रण जीन माना जाता है, जिसका अर्थ है कि एक एकल प्रोटीन कई लक्ष्य जीनों की अभिव्यक्ति को नियंत्रित कर सकता है। समप्रक्षेत्र प्रोटीन भ्रूणजनन के उपरान्त शरीर अक्षौं और शरीर संरचनाओं के निर्माण को निर्देशित करते हैं। [16] कई समप्रक्षेत्र प्रोटीन व्यक्तिगत जैविक ऊतक और अंग (शरीर रचना) का उत्पादन करने के लिए आवश्यक केंद्र-विनियमित जीन के जलप्रपात को प्रारम्भ करके कोशिकीय भेदभाव को प्रेरित करते हैं। फैमिली के अन्य प्रोटीन, जैसे होमिओबॉक्स प्रोटीन एनएएनओजी बहुक्तिक बनाए रखने और कोशिका विभेदन को रोकने में सम्मिलित हैं।
विनियमन
हॉक्स जीन और उनके संबंधित माइक्रोआरएनए तंग ऊतक-विशिष्ट, दिक्कालीय नियंत्रण के साथ अत्यधिक संरक्षित विकासात्मक निष्णात नियामक हैं। इन जीनों को कई कैंसरों में अनियमित माना जाता है और इन्हें प्रायः डीएनए मेथिलिकरण द्वारा नियंत्रित किया जाता है। [17][18] हॉक्स जीन का नियमन अत्यधिक जटिल है और इसमें पारस्परिक अंतःक्रियाएं सम्मिलित होती हैं, जो अधिकतर निरोधात्मक होती हैं। ड्रोसोफिला को लार्वा विकास के उपरान्त होने वाले जोड़ी-नियम और गैप जीन के अधोनियमन के बाद हॉक्स जीन की अभिव्यक्ति को बनाए रखने के लिए पॉलीकोम्ब-समूह प्रोटीन और ट्राइथोरैक्स-समूह प्रोटीन संकुल का उपयोग करने के लिए जाना जाता है। पॉलीकोम्ब-समूह प्रोटीन क्रोमेटिन संरचना के प्रतिरुपण द्वारा हॉक्स जीन को शांत कर सकते हैं। [19]
उत्परिवर्तन
होमिओबॉक्स जीन में उत्परिवर्तन शरीर खंड की पहचान में आसानी से दिखाई देने वाले समलक्षणी परिवर्तन उत्पन्न कर सकता है, जैसे ड्रोसोफिला में एंटेनापेडिया और द्विवक्ष उत्परिवर्ती समलक्षणी है। होमिओबॉक्स जीन के दोहराव से नए शरीर खंड उत्पन्न हो सकते हैं, और इस तरह के दोहराव खंडित जानवरों के विकास में महत्वपूर्ण रहे होंगे।
विकास
होमिओबॉक्स स्वयं एमरे एंजाइम के सी-टर्मिनस पर एक गैर-डीएनए-बाध्यकारी ट्रांसमेम्ब्रेन कार्यक्षेत्र से विकसित हुआ हो सकता है। यह संक्रमणकालीन पुरातत्व, लोकिआर्कियम से प्राप्त मेटागेनोमिक डेटा पर आधारित है, जिसे सभी सुकेंद्रकी के पूर्वज के सबसे करीब अकेन्द्रिक माना जाता है। [20]
होमिओबॉक्स जीन अनुक्रमों और समप्रक्षेत्र प्रोटीन संरचनाओं के फ़ाइलोजेनेटिक विश्लेषण से पता चलता है कि पौधों, कवक और जानवरों के अंतिम सामान्य पूर्वज में कम से कम दो होमिओबॉक्स जीन थे। [21] आणविक साक्ष्य से पता चलता है कि कुछ सीमित संख्या में हॉक्स जीन, प्रारम्भिक वास्तविक बिलाटेरिया से पहले से ही नाइडेरिया में उपस्थित हैं, जिससे ये जीन प्री-पैलियोज़ोइक बन गए हैं। [22] यह स्वीकार किया जाता है कि तीन प्रमुख पशु एएनटीपी-श्रेणी स्तवक, हॉक्स, पैराहॉक्स और एनके (मेटाहॉक्स), खंडीय दोहराव का परिणाम हैं। पहले दोहराव ने मेटाहॉक्स और प्रोटोहॉक्स का निर्माण किया, जिसे बाद में हॉक्स और पैराहॉक्स में दोहराया गया। स्तवक स्वयं एक एएनटीपी-क्लास होमिओबॉक्स जीन के अग्रानुक्रम दोहराव द्वारा बनाए गए थे। [23] सुकेंद्रकी में पाए जाने वाले कई होमिओबॉक्स जीन के लिए जीन दोहराव और उसके बाद नवकार्यात्मकता उत्तरदायी है। [24][25] होमिओबॉक्स जीन और जीन समूहों की तुलना का उपयोग पूरे मेटाज़ोअन में जीनोम संरचना और शरीर आकृति विज्ञान के विकास को समझने के लिए किया गया है। [26]
होमिओबॉक्स जीन के प्रकार
हॉक्स जीन
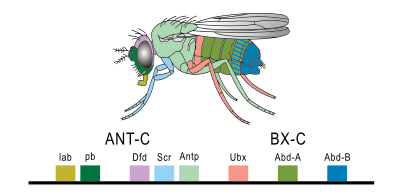
होक्स जीन होमिओबॉक्स जीन का सबसे आम ज्ञात उपसमूह है। वे आवश्यक उत्तरजंतु जीन हैं जो पूर्वकाल-पश्च अक्ष के साथ भ्रूण क्षेत्रों की पहचान निर्धारित करते हैं। [27] पहला कशेरुकी हॉक्स जीन 1984 में एडवर्ड एम. डी रॉबर्टिस और उनके सहयोगियों द्वारा ज़ेनोपस में अलग किया गया था। [28] जीन के इस सेट में मुख्य रुचि जीनोम में उनके अद्वितीय व्यवहार और व्यवस्था से उत्पन्न होती है। हॉक्स जीन सामान्यतः एक संगठित समूह में पाए जाते हैं। एक स्तवक के भीतर हॉक्स जीन का रैखिक क्रम सीधे उस क्रम से संबंधित होता है जो वे विकास के उपरान्त समय और स्थान दोनों में व्यक्त होते हैं। इस घटना को सरैखिता कहा जाता है।
इन घरेलू जीन में उत्परिवर्तन के कारण भ्रूण के विकास के उपरान्त शरीर के खंडों में विस्थापन होता है। इसे अस्थानिक अभिव्यक्ति कहा जाता है। उदाहरण के लिए, जब एक जीन नष्ट हो जाता है तो वह खंड अधिक पूर्ववर्ती खंड में विकसित हो जाता है, जबकि एक उत्परिवर्तन जो कार्य में वृद्धि की ओर ले जाता है, एक खंड को अधिक पीछे वाले खंड में विकसित करने का कारण बनता है। प्रसिद्ध उदाहरण ड्रोसोफिला में एंटेनापीडिया और द्विवक्ष संकुल हैं, जो क्रमशः एंटीना के स्थान पर पैरों के विकास और प्रतिलिपि वक्ष के विकास का कारण बन सकते हैं। [29]
कशेरुकियों में, चार सजातीय (जीव विज्ञान) समूह कार्य में आंशिक रूप से अनावश्यक हैं, लेकिन उन्होंने कई व्युत्पन्न कार्य भी प्राप्त कर लिए हैं। उदाहरण के लिए, एचओएक्सए और एचओएक्सडी लिम्ब (एनाटॉमी) अक्ष के साथ खंड पहचान निर्दिष्ट करते हैं। [30][31] होक्स फैमिली के विशिष्ट सदस्यों को आव्यूह अवकर्षण, इंटीग्रिन और ईसीएम के घटकों में परिवर्तनों को व्यवस्थित करके संवहनी रीमॉडलिंग, वाहिकाजनन और बीमारी में फंसाया गया है। [32] एचओएक्सए5 धमनीकलाकाठिन्य में सम्मिलित है। [33][34] एचओएक्सडी3 और एचओएक्सबी3 प्रोइनवेसिव, वाहिकाजनक जीन हैं जो क्रमशः ईसीएस में बी 3 और ए5 इंटीग्रिन और ईएफएनए1 को कोटिवर्धन करते हैं। [35][36][37][38] एचओएक्सए3 एमएमपी14 और यूपीएआर को कोटिवर्धन करके अंतर्कलीय सेल (ईसी) प्रवसन को प्रेरित करता है। इसके विपरीत, एचओएक्सडी10 और एचओएक्सए5 में ईसी प्रवसन और वाहिकाजनन को दबाने और क्रमशः टीआईएमपी1 को कोटिवर्धन करने/यूपीएआर और एमएमपी14 को डाउनरेगुलेट करने और टीएसपी2 को कोटिवर्धन करने/वीईजीएफआर2, ईएफएनए1, हिफ़1अल्फ़ा और कॉक्स -2 को डाउनरेगुलेट करने के द्वारा एडहेरेन्स संधिस्थल को स्थिर करने का विपरीत प्रभाव पड़ता है। [39][40] एचओएक्सए5 पीटीईएन को डाउनरेगुलेट करके अर्बुद दमनकर्ता पी53 और एकेटी1 को भी कोटिवर्धन करता है। [41] यह दिखाया गया है कि एचओएक्सए5 के दमन से हेमांगीओमा की वृद्धि कम हो जाती है। [42] एचओएक्सए5 का जीन अभिव्यक्ति पर दूरगामी प्रभाव पड़ता है, जिससे स्तन कैंसर कोशिका रेखाओं में इसके सम्मिलित होने पर ~300 जीन कोटिवर्धन हो जाते हैं। [42] एचओएक्सए5 प्रोटीन पारक्रमण कार्यक्षेत्र ओवरएक्प्रेशन एचयूवीईसीएस के लिए टीएनएफअल्फा-प्रेरणीय मोनोसाइट आबद्धकर के निषेध द्वारा दिखाई गई सूजन को रोकता है। [43][44]
लिम जीन
एलआईएम जीन (तीन प्रोटीनों के नाम के प्रारम्भिक अक्षरों के नाम पर जहां विशेषता कार्यक्षेत्र की पहली बार पहचान की गई थी) दो 60 अमीनो अम्ल सिस्टीन और हिस्टिडाइन-समृद्ध एलआईएम कार्यक्षेत्र और एक समप्रक्षेत्र को कूटलेखित करते हैं। लिम कार्यक्षेत्र प्रोटीन-प्रोटीन पारस्परिक प्रभाव में कार्य करते हैं और जिंक अणुओं को बांध सकते हैं। लिम कार्यक्षेत्र प्रोटीन कोशिका द्रव्य और न्यूक्लियस दोनों में पाए जाते हैं। वे साइटोस्केलेटल रीमॉडलिंग में, केन्द्रीय आसंजन स्थलों पर, प्रोटीन संकुल के लिए मचान के रूप में और प्रतिलेखन कारकों के रूप में कार्य करते हैं। [45]
पैक्स जीन
अधिकांश पैक्स जीन में एक होमिओबॉक्स और एक युग्मित कार्यक्षेत्र होता है जो आबद्धकर विशिष्टता को बढ़ाने के लिए डीएनए को भी बांधता है, हालांकि कुछ पैक्स जीन ने होमिओबॉक्स अनुक्रम के सभी या कुछ हिस्से को खो दिया है। [46] पैक्स जीन भ्रूण विभाजन (जीव विज्ञान), तंत्रिका तंत्र विकास, ललाट नेत्र क्षेत्र, कंकाल विकास और चेहरे की संरचनाओं के निर्माण में कार्य करते हैं। पीएएक्स6 नेत्र विकास का एक मुख्य नियामक है, जैसे कि जीन नेत्र पुटिका और उसके बाद की नेत्र संरचनाओं के विकास के लिए आवश्यक है। [47]
पीओयू जीन
पीओयू क्षेत्र वाले प्रोटीन में एक समप्रक्षेत्र और एक अलग, संरचनात्मक रूप से समरूप पीओयू कार्यक्षेत्र होता है जिसमें दो कुंडली-पंक्ति-कुंडली रूपांकन होते हैं और डीएनए को भी बांधते हैं। दोनों कार्यक्षेत्र एक लचीले विपाश से जुड़े हुए हैं जो डीएनए कुंडली के चारों ओर विस्तारित होने के लिए काफी लंबा है, जिससे दोनों कार्यक्षेत्र लक्ष्य डीएनए के विपरीत किनारों पर जुड़ सकते हैं, जो सामूहिक रूप से सर्वसम्मति अनुक्रम 5'-एटीजीसीएएएटी-3 के साथ आठ-आधार खंड को कवर करते हैं। ' पीओयू प्रोटीन के अलग-अलग कार्यक्षेत्र डीएनए को केवल शक्तिहीन रूप से बांधते हैं, लेकिन जुड़े होने पर शक्तिशाली अनुक्रम-विशिष्ट संबंध रखते हैं। पीओयू कार्यक्षेत्र में जीवाणुभोजी, विशेष रूप से लैम्डा विभोजी में व्यक्त दमनकर्ताओं के साथ महत्वपूर्ण संरचनात्मक समानता है।
वनस्पति होमिओबॉक्स जीन
जानवरों की तरह, पौधे के होमिओबॉक्स जीन विशिष्ट 60 अमीनो अम्ल लंबे डीएनए-बाध्यकारी समप्रक्षेत्र के लिए बीजांक करते हैं या टेल (तीन अमीनो अम्ल विपाश विस्तारण) की स्तिथि में होमिओबॉक्स जीन 63 अमीनो अम्ल से युक्त एक असामान्य समप्रक्षेत्र के लिए कोड करते हैं। उनकी संरक्षित इंट्रॉन-एक्सॉन संरचना और अद्वितीय को कार्यक्षेत्र वास्तुकला के अनुसार उन्हें 14 अलग-अलग वर्गों में बांटा गया है: एचडी-ज़िप I से IV, बीईएल, केएनओएक्स, पीएलआईएनसी, वॉक्स, पीएचडी, डीडीटी,एनडीएक्स, एलडी, सवाडी और पिंटॉक्स है। [24] कार्यक्षेत्र का संरक्षण टेल और गैर-टेल समप्रक्षेत्र प्रोटीन के लिए एक सामान्य यूकेरियोटिक वंश का सुझाव देता है। [48] [49]
मानव होमिओबॉक्स जीन
मनुष्यों में हॉक्स जीन चार गुणसूत्र समूहों में व्यवस्थित होते हैं:
| नाम | गुणसूत्र | वंशाणु |
| एचओएक्सए (या कभी-कभी एचओएक्स1) - HOXA@ | गुणसूत्र 7 | एचओएक्सए1, एचओएक्सए2, एचओएक्सए3, एचओएक्सए4, एचओएक्सए5, एचओएक्सए6, एचओएक्सए7, एचओएक्सए9, एचओएक्सए10, एचओएक्सए11, एचओएक्सए13 |
| एचओएक्सबी - HOXB@ | गुणसूत्र 17 | एचओएक्सबी1, एचओएक्सबी2, एचओएक्सबी3, एचओएक्सबी4, एचओएक्सबी5, एचओएक्सबी6, एचओएक्सबी7, एचओएक्सबी8, एचओएक्सबी9, एचओएक्सबी13 |
| एचओएक्ससी - HOXC@ | गुणसूत्र 12 | एचओएक्ससी4, एचओएक्ससी5, एचओएक्ससी6, एचओएक्ससी8, एचओएक्ससी9, एचओएक्ससी10, एचओएक्ससी11, एचओएक्ससी12, एचओएक्ससी13 |
| एचओएक्सडी - HOXD@ | गुणसूत्र 2 | एचओएक्सडी1, एचओएक्सडी3, एचओएक्सडी4, एचओएक्सडी8, एचओएक्सडी9, एचओएक्सडी10, एचओएक्सडी11, एचओएक्सडी12, एचओएक्सडी13 |
पैराहॉक्स जीन समान रूप से चार क्षेत्रों में पाए जाते हैं। इनमें सीडीएक्स1, सीडीएक्स2, सीडीएक्स जीएसएक्स1, जीएसएक्स2; और पीडीएक्स1 प्रोटीन फैमिली सम्मिलित हैं। हॉक्स-जैसे माने जाने वाले अन्य जीनों में ईवीएक्स1, ईवीएक्स2 जीबीएक्स1, जीबीएक्स2; एमईओएक्स1, एमईओएक्स2; और एमएनएक्स1 सम्मिलित हैं। एनके-जैसे (एनकेएल) जीन, जिनमें से कुछ को मेटाहॉक्स माना जाता है, उनको हॉक्स-जैसे जीन के साथ एक बड़े एएनटीपी-जैसे समूह में समूहीकृत किया जाता है।[50][51]
मनुष्य में डीएलएक्स जीन फैमिली होता है: डीएलएक्स1, डीएलएक्स2, डीएलएक्स3 (जीन), डीएलएक्स4, डीएलएक्स5, और डीएलएक्स6। डीएलएक्स जीन तंत्रिका तंत्र और अंगों के विकास में सम्मिलित होते हैं। [52] उन्हें एनके-जैसे जीन का उपवर्ग माना जाता है।[50]
मानवीय टीएएलई (तीन अमीनो अम्ल विपाश विस्तारण) असामान्य समप्रक्षेत्र के लिए होमिओबॉक्स जीन में 60 के स्थान पर 63 अमीनो अम्ल होते हैं:
आईआरएक्स1, आईआरएक्स2, आईआरएक्स3, आईआरएक्स4, आईआरएक्स5, आईआरएक्स6; एमईआईएस1, एमईआईएस2, एमईआईएस3; एमकेएक्स; पीबीएक्स1, पीबीएक्स2, पीबीएक्स3, पीबीएक्स4; पीकेएनओएक्स1, पीकेएनओएक्स2; टीजीआईएफ1, टीजीआईएफ2, टीजीआईएफ2एलएक्स, टीजीआईएफ2एलवाई।[50]
इसके अतिरिक्त, मनुष्यों में निम्नलिखित होमिओबॉक्स जीन और प्रोटीन होते हैं: [50]
- लिम-क्लास: आइएसएल1, आइएसएल2;एलएचएक्स1,एलएचएक्स2, एलएचएक्स3, एलएचएक्स4, एलएचएक्स5, एलएचएक्स6, एलएचएक्स8, एलएचएक्स9;[lower-alpha 1] एलएमएक्स1ए, एलएमएक्स1बी
- पीओयू-क्लास: एचडीएक्स (जीन);पीओयू1एफ1; पीओयू2एफ1; पीओयू2एफ2; पीओयू2एफ3; पीओयू3एफ1; पीओयू3एफ2; पीओयू3एफ3; पीओयू3एफ4; पीओयू4एफ1; पीओयू4एफ2; पीओयू4एफ3; पीओयू5एफ1; पीओयू5एफ1P1; पीओयू5एफ1P4; पीओयू5एफ2; पीओयू6एफ1; और पीओयू6एफ2
- सीईआरएस-क्लास: एलएएसएस2, एलएएसएस3, एलएएसएस4, एलएएसएस5, एलएएसएस6;
- एचएनएफ-क्लास: एचएमबॉक्स1; टीसीएफ1, टीसीएफ2;
- साइन-क्लास: एसआईएक्स1, एसआईएक्स2, एसआईएक्स3, एसआईएक्स4, एसआईएक्स5, एसआईएक्स6[lower-alpha 2]
- कट-क्लास: ओएनईसीयूटी1, ओएनईसीयूटी2, ओएनईसीयूटी3; सीयूएक्स1 (जीन), सीयूएक्स2; एसएटीबी1, एसएटीबी2;
- जेडएफ-क्लास: एडीएनपी (जीन), एडीएनपी2; टीएसएचजेड1, टीएसएचजेड2, टीएसएचजेड3; जेडईबी1, जेडईबी2; ज़ेडएचएचएक्स2, ज़ेडएचएचएक्स3, ज़ेडएचएचएक्स4; जेएचएक्स1, होमज़;
- पीआरडी-क्लास: एएलएक्स1 सीएआरटी1), एएलएक्स3, एएलएक्स4; एआरजीएफएक्स; अरिस्टालेस संबंधित होमिओबॉक्स; डीएमबीएक्स1; डीपीआरएक्स; डीआरजीएक्स; डीयूएक्सए, डीयूएक्सबी, डीयूएक्स (डीयूएक्स1, डीयूएक्स2, डीयूएक्स3, डीयूएक्स4, डीयूएक्स4c, डीयूएक्स5);[lower-alpha 3] ईएसएक्स1; जीएससी (जीन), जीएससी2; एचईएसएक्स1; एचओपीएक्स; आईएसएक्स;एलईयूटीएक्स; एमआईएक्सएल1; कोई बॉक्स नहीं; ओटीपी (जीन); ओटीएक्स1, ओटीएक्स2, सीआरएक्स (जीन); पीएएक्स2, पीएएक्स3, पीएएक्स4, पीएएक्स5, पीएएक्स6, पीएएक्स7, पीएएक्स8;[lower-alpha 4] पीएचओएक्स2ए, पीएचओएक्स2बी; पीआईटीएक्स1, पीआईटीएक्स2, पीआईटीएक्स3; पीआरओपी1; पीआरआरएक्स1, पीआरआरएक्स2; आरएएक्स (जीन), आरएएक्स2; Rएचओएक्सएफ1, Rएचओएक्सएफ2/Rएचओएक्सएफ2B; सेबोक्स; छोटे कद का होमिओबॉक्स जीन, Sएचओएक्स2; टीपीआरएक्स1; यूएनसीएक्स; वीएसएक्स1, वीएसएक्स2
- एनकेएल-क्लास: बीएआरएचएल1, बीएआरएचएल2; बीएआरएक्स1, बीएआरएक्स2; मस्तिष्क-विशिष्ट होमिओबॉक्स; डीबीएक्स1, डीबीएक्स2; ईएमएक्स1, ईएमएक्स2; EN1 (जीन), EN2 (जीन); एचएचईएक्स; एचएलएक्स (जीन); एलबीएक्स1, एलबीएक्स2; एमएसएक्स1, एमएसएक्स2 (जीन); होमिओबॉक्स प्रोटीन एनएएनओजी; नॉटोकॉर्ड होमिओबॉक्स (NOTO) जीन; टीएलएक्स1, टीएलएक्स2, टीएलएक्स3; टीएसएचजेड1, टीएसएचजेड2, टीएसएचजेड3; वीएएक्स1, वीएएक्स2, वेंटएक्स;
- एनएक्स: एनके2 होमिओबॉक्स 1|एनकेएक्स2-1, एनकेएक्स2-4; एनकेएक्स2-2, एनकेएक्स2-8; एनकेएक्स3-1, एनकेएक्स3-2; एनकेएक्स2-3, एनकेएक्स2-5, एनकेएक्स2-6;[lower-alpha 5] एचएमएक्स1, एचएमएक्सए, एचएमएक्सए;[lower-alpha 6] एनकेएक्स6-1; एनकेएक्स6-2; एनकेएक्स6-3;
यह भी देखें
- विकासवादी विकासात्मक जीवविज्ञान
- शारीरिक योजना
संदर्भ
- ↑ 1.0 1.1 1.2 Bürglin TR, Affolter M (June 2016). "Homeodomain proteins: an update". Chromosoma. 125 (3): 497–521. doi:10.1007/s00412-015-0543-8. PMC 4901127. PMID 26464018.
- ↑ 2.0 2.1 Gehring WJ (August 1992). "परिप्रेक्ष्य में होमोबॉक्स". Trends in Biochemical Sciences. 17 (8): 277–80. doi:10.1016/0968-0004(92)90434-B. PMID 1357790.
- ↑ Gehring WJ (December 1993). "होमोबॉक्स की खोज". Gene. 135 (1–2): 215–21. doi:10.1016/0378-1119(93)90068-E. PMID 7903947.
- ↑ Reference, Genetics Home. "होमोबॉक्स". Genetics Home Reference (in English). Archived from the original on 2019-12-21. Retrieved 2019-11-20.
- ↑ Materials for the study of variation, treated with especial regard to discontinuity in the origin of species William Bateson 1861–1926. London : Macmillan 1894 xv, 598 p
- ↑ 6.0 6.1 Schofield PN (1987). "पैटर्न, पहेलियाँ और प्रतिमान - होमोबॉक्स की पहेली". Trends Neurosci. 10: 3–6. doi:10.1016/0166-2236(87)90113-5. S2CID 53188259.
- ↑ Scott MP, Tamkun JW, Hartzell GW (July 1989). "होम्योडोमेन की संरचना और कार्य". Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 989 (1): 25–48. doi:10.1016/0304-419x(89)90033-4. PMID 2568852.
- ↑ Garber RL, Kuroiwa A, Gehring WJ (1983). "ड्रोसोफिला में होमियोटिक लोकस एंटेनापीडिया के जीनोमिक और सीडीएनए क्लोन". The EMBO Journal. 2 (11): 2027–36. doi:10.1002/j.1460-2075.1983.tb01696.x. PMC 555405. PMID 6416827.
- ↑ "Walter Jakob Gehring (1939-2014) | The Embryo Project Encyclopedia". embryo.asu.edu. Archived from the original on 2019-12-09. Retrieved 2019-12-09.
- ↑ McGinnis W, Levine MS, Hafen E, Kuroiwa A, Gehring WJ (1984). "ड्रोसोफिला एंटेनापीडिया और बिथोरैक्स कॉम्प्लेक्स के होमियोटिक जीन में एक संरक्षित डीएनए अनुक्रम". Nature. 308 (5958): 428–33. Bibcode:1984Natur.308..428M. doi:10.1038/308428a0. PMID 6323992. S2CID 4235713.
- ↑ Scott MP, Weiner AJ (July 1984). "Structural relationships among genes that control development: sequence homology between the Antennapedia, Ultrabithorax, and fushi tarazu loci of Drosophila". Proceedings of the National Academy of Sciences of the United States of America. 81 (13): 4115–9. Bibcode:1984PNAS...81.4115S. doi:10.1073/pnas.81.13.4115. PMC 345379. PMID 6330741.
- ↑ Carrasco, Andrés E.; McGinnis, William; Gehring, Walter J.; De Robertis, Eddy M. (1984). "प्रारंभिक भ्रूणजनन के दौरान व्यक्त एक्स. लाविस जीन की क्लोनिंग, ड्रोसोफिला होमियोटिक जीन के समजात पेप्टाइड क्षेत्र के लिए कोडिंग". Cell (in English). 37 (2): 409–414. doi:10.1016/0092-8674(84)90371-4. PMID 6327066. S2CID 30114443.
- ↑ McGinnis W, Garber RL, Wirz J, Kuroiwa A, Gehring WJ (June 1984). "ड्रोसोफिला होमियोटिक जीन में एक समजात प्रोटीन-कोडिंग अनुक्रम और अन्य मेटाज़ोअन में इसका संरक्षण". Cell (in English). 37 (2): 403–8. doi:10.1016/0092-8674(84)90370-2. PMID 6327065. S2CID 40456645. Archived from the original on 2021-05-04. Retrieved 2019-12-09.
- ↑ Bürglin TR. "होमोबॉक्स पेज" (gif). Karolinksa Institute. Archived from the original on 2011-07-21. Retrieved 2010-01-30.
- ↑ "CATH Superfamily 1.10.10.60". www.cathdb.info. Archived from the original on 9 August 2017. Retrieved 27 March 2018.
- ↑ Corsetti MT, Briata P, Sanseverino L, Daga A, Airoldi I, Simeone A, et al. (September 1992). "तीन मानव होम्योडोमैन प्रोटीन के विभेदक डीएनए बाइंडिंग गुण". Nucleic Acids Research. 20 (17): 4465–72. doi:10.1093/nar/20.17.4465. PMC 334173. PMID 1357628.
- ↑ Dunn J, Thabet S, Jo H (July 2015). "एंडोथेलियल जीन अभिव्यक्ति और एथेरोस्क्लेरोसिस में प्रवाह-निर्भर एपिजेनेटिक डीएनए मिथाइलेशन". Arteriosclerosis, Thrombosis, and Vascular Biology. 35 (7): 1562–9. doi:10.1161/ATVBAHA.115.305042. PMC 4754957. PMID 25953647.
- ↑ Bhatlekar S, Fields JZ, Boman BM (August 2014). "HOX जीन और मानव कैंसर के विकास में उनकी भूमिका". Journal of Molecular Medicine. 92 (8): 811–23. doi:10.1007/s00109-014-1181-y. PMID 24996520. S2CID 17159381.
- ↑ Portoso M, Cavalli G (2008). "The Role of RNAi and Noncoding RNAs in Polycomb Mediated Control of Gene Expression and Genomic Programming". RNA and the Regulation of Gene Expression: A Hidden Layer of Complexity. Caister Academic Press. ISBN 978-1-904455-25-7. Archived from the original on 2012-01-02. Retrieved 2008-02-27.
- ↑ Bozorgmehr JH (2018). "लोकिआर्किया में MraY के सी-टर्मिनस पर होमोबॉक्स की उत्पत्ति". doi:10.13140/RG.2.2.35941.65760. Archived from the original on 2021-05-04. Retrieved 2018-10-26 – via ResearchGate.
{{cite journal}}: Cite journal requires|journal=(help) - ↑ Bharathan G, Janssen BJ, Kellogg EA, Sinha N (December 1997). "Did homeodomain proteins duplicate before the origin of angiosperms, fungi, and metazoa?". Proceedings of the National Academy of Sciences of the United States of America. 94 (25): 13749–53. Bibcode:1997PNAS...9413749B. doi:10.1073/pnas.94.25.13749. JSTOR 43805. PMC 28378. PMID 9391098.
- ↑ Ryan JF, Mazza ME, Pang K, Matus DQ, Baxevanis AD, Martindale MQ, Finnerty JR (January 2007). "Pre-bilaterian origins of the Hox cluster and the Hox code: evidence from the sea anemone, Nematostella vectensis". PLOS ONE. 2 (1): e153. Bibcode:2007PLoSO...2..153R. doi:10.1371/journal.pone.0000153. PMC 1779807. PMID 17252055.
- ↑ Garcia-Fernàndez J (December 2005). "होमोबॉक्स जीन समूहों की उत्पत्ति और विकास". Nature Reviews Genetics. 6 (12): 881–92. doi:10.1038/nrg1723. PMID 16341069. S2CID 42823485.
- ↑ 24.0 24.1 Mukherjee K, Brocchieri L, Bürglin TR (December 2009). "पादप होमोबॉक्स जीन का व्यापक वर्गीकरण और विकासवादी विश्लेषण". Molecular Biology and Evolution. 26 (12): 2775–94. doi:10.1093/molbev/msp201. PMC 2775110. PMID 19734295.
- ↑ Holland PW (2013). "होमोबॉक्स जीन का विकास". Wiley Interdisciplinary Reviews: Developmental Biology. 2 (1): 31–45. doi:10.1002/wdev.78. PMID 23799629. S2CID 44396110.
- ↑ Ferrier, David E. K. (2016). "Evolution of Homeobox Gene Clusters in Animals: The Giga-Cluster and Primary vs. Secondary Clustering". Frontiers in Ecology and Evolution (in English). 4. doi:10.3389/fevo.2016.00036. ISSN 2296-701X.
- ↑ Alonso CR (November 2002). "Hox proteins: sculpting body parts by activating localized cell death". Current Biology. 12 (22): R776-8. doi:10.1016/S0960-9822(02)01291-5. PMID 12445403. S2CID 17558233.
- ↑ Carrasco AE, McGinnis W, Gehring WJ, De Robertis EM (June 1984). "प्रारंभिक भ्रूणजनन के दौरान व्यक्त एक्स. लाविस जीन की क्लोनिंग, ड्रोसोफिला होमियोटिक जीन के समजात पेप्टाइड क्षेत्र के लिए कोडिंग". Cell. 37 (2): 409–14. doi:10.1016/0092-8674(84)90371-4. PMID 6327066. S2CID 30114443.
- ↑ Schneuwly S, Klemenz R, Gehring WJ (1987). "होमियोटिक जीन एंटेनापीडिया की एक्टोपिक अभिव्यक्ति द्वारा ड्रोसोफिला की शारीरिक योजना को फिर से डिजाइन करना". Nature. 325 (6107): 816–8. Bibcode:1987Natur.325..816S. doi:10.1038/325816a0. PMID 3821869. S2CID 4320668.
- ↑ Fromental-Ramain C, Warot X, Messadecq N, LeMeur M, Dollé P, Chambon P (October 1996). "Hoxa-13 and Hoxd-13 play a crucial role in the patterning of the limb autopod". Development. 122 (10): 2997–3011. doi:10.1242/dev.122.10.2997. PMID 8898214.
- ↑ Zákány J, Duboule D (April 1999). "अंकों के विकास और विकास में हॉक्स जीन". Cell and Tissue Research. 296 (1): 19–25. doi:10.1007/s004410051262. PMID 10199961. S2CID 3192774.
- ↑ Gorski DH, Walsh K (November 2000). "संवहनी रीमॉडलिंग और एंजियोजेनेसिस में होमोबॉक्स जीन की भूमिका". Circulation Research. 87 (10): 865–72. doi:10.1161/01.res.87.10.865. PMID 11073881.
- ↑ Dunn J, Thabet S, Jo H (July 2015). "एंडोथेलियल जीन अभिव्यक्ति और एथेरोस्क्लेरोसिस में प्रवाह-निर्भर एपिजेनेटिक डीएनए मिथाइलेशन". Arteriosclerosis, Thrombosis, and Vascular Biology. 35 (7): 1562–9. doi:10.1161/ATVBAHA.115.305042. PMC 4754957. PMID 25953647.
- ↑ Dunn J, Simmons R, Thabet S, Jo H (October 2015). "एंडोथेलियल सेल कतरनी तनाव प्रतिक्रिया और एथेरोस्क्लेरोसिस में एपिजेनेटिक्स की भूमिका". The International Journal of Biochemistry & Cell Biology. 67: 167–76. doi:10.1016/j.biocel.2015.05.001. PMC 4592147. PMID 25979369.
- ↑ Boudreau N, Andrews C, Srebrow A, Ravanpay A, Cheresh DA (October 1997). "Induction of the angiogenic phenotype by Hox D3". The Journal of Cell Biology. 139 (1): 257–64. doi:10.1083/jcb.139.1.257. PMC 2139816. PMID 9314544.
- ↑ Boudreau NJ, Varner JA (February 2004). "The homeobox transcription factor Hox D3 promotes integrin alpha5beta1 expression and function during angiogenesis". The Journal of Biological Chemistry. 279 (6): 4862–8. doi:10.1074/jbc.M305190200. PMID 14610084.
- ↑ Myers C, Charboneau A, Boudreau N (January 2000). "Homeobox B3 promotes capillary morphogenesis and angiogenesis". The Journal of Cell Biology. 148 (2): 343–51. doi:10.1083/jcb.148.2.343. PMC 2174277. PMID 10648567.
- ↑ Chen Y, Xu B, Arderiu G, Hashimoto T, Young WL, Boudreau N, Yang GY (November 2004). "Retroviral delivery of homeobox D3 gene induces cerebral angiogenesis in mice". Journal of Cerebral Blood Flow and Metabolism. 24 (11): 1280–7. doi:10.1097/01.WCB.0000141770.09022.AB. PMID 15545924.
- ↑ Myers C, Charboneau A, Cheung I, Hanks D, Boudreau N (December 2002). "होमोबॉक्स डी10 की निरंतर अभिव्यक्ति एंजियोजेनेसिस को रोकती है". The American Journal of Pathology. 161 (6): 2099–109. doi:10.1016/S0002-9440(10)64488-4. PMC 1850921. PMID 12466126.
- ↑ Mace KA, Hansen SL, Myers C, Young DM, Boudreau N (June 2005). "HOXA3 induces cell migration in endothelial and epithelial cells promoting angiogenesis and wound repair". Journal of Cell Science. 118 (Pt 12): 2567–77. doi:10.1242/jcs.02399. PMID 15914537.
- ↑ Rhoads K, Arderiu G, Charboneau A, Hansen SL, Hoffman W, Boudreau N (2005). "A role for Hox A5 in regulating angiogenesis and vascular patterning". Lymphatic Research and Biology. 3 (4): 240–52. doi:10.1089/lrb.2005.3.240. PMID 16379594.
- ↑ 42.0 42.1 Arderiu G, Cuevas I, Chen A, Carrio M, East L, Boudreau NJ (2007). "HoxA5 stabilizes adherens junctions via increased Akt1". Cell Adhesion & Migration. 1 (4): 185–95. doi:10.4161/cam.1.4.5448. PMC 2634105. PMID 19262140.
- ↑ Zhu Y, Cuevas IC, Gabriel RA, Su H, Nishimura S, Gao P, et al. (June 2009). "Restoring transcription factor HoxA5 expression inhibits the growth of experimental hemangiomas in the brain". Journal of Neuropathology and Experimental Neurology. 68 (6): 626–32. doi:10.1097/NEN.0b013e3181a491ce. PMC 2728585. PMID 19458547.
- ↑ Chen H, Rubin E, Zhang H, Chung S, Jie CC, Garrett E, et al. (May 2005). "Identification of transcriptional targets of HOXA5". The Journal of Biological Chemistry. 280 (19): 19373–80. doi:10.1074/jbc.M413528200. PMID 15757903.
- ↑ Kadrmas JL, Beckerle MC (November 2004). "The LIM domain: from the cytoskeleton to the nucleus". Nature Reviews Molecular Cell Biology. 5 (11): 920–31. doi:10.1038/nrm1499. PMID 15520811. S2CID 6030950.
- ↑ Gruss P, Walther C (May 1992). "विकास में पैक्स". Cell (in English). 69 (5): 719–22. doi:10.1016/0092-8674(92)90281-G. PMID 1591773. S2CID 44613005. Archived from the original on 2021-05-02. Retrieved 2019-12-11.
- ↑ Walther C, Gruss P (December 1991). "Pax-6, a murine paired box gene, is expressed in the developing CNS". Development. 113 (4): 1435–49. doi:10.1242/dev.113.4.1435. PMID 1687460.
- ↑ Bürglin TR (November 1997). "टेल सुपरक्लास होमोबॉक्स जीन (MEIS, PBC, KNOX, Iroquois, TGIF) के विश्लेषण से पौधों और जानवरों के बीच संरक्षित एक नए डोमेन का पता चलता है।". Nucleic Acids Research. 25 (21): 4173–80. doi:10.1093/nar/25.21.4173. PMC 147054. PMID 9336443.
- ↑ Derelle R, Lopez P, Le Guyader H, Manuel M (2007). "होम्योडोमैन प्रोटीन यूकेरियोट्स के पैतृक आणविक टूलकिट से संबंधित हैं". Evolution & Development. 9 (3): 212–9. doi:10.1111/j.1525-142X.2007.00153.x. PMID 17501745. S2CID 9530210.
- ↑ 50.0 50.1 50.2 50.3 50.4 Holland PW, Booth HA, Bruford EA (October 2007). "सभी मानव होमोबॉक्स जीनों का वर्गीकरण और नामकरण". BMC Biology. 5 (1): 47. doi:10.1186/1741-7007-5-47. PMC 2211742. PMID 17963489.
- ↑ Coulier, François; Popovici, Cornel; Villet, Régis; Birnbaum, Daniel (15 December 2000). "मेटाहॉक्स जीन क्लस्टर". Journal of Experimental Zoology. 288 (4): 345–351. doi:10.1002/1097-010X(20001215)288:4<345::AID-JEZ7>3.0.CO;2-Y. PMID 11144283.
- ↑ Kraus P, Lufkin T (July 2006). "स्तनधारी अंग और क्रैनियोफेशियल विकास का डीएलएक्स होमोबॉक्स जीन नियंत्रण". American Journal of Medical Genetics. Part A. 140 (13): 1366–74. doi:10.1002/ajmg.a.31252. PMID 16688724. S2CID 32619323.
अग्रिम पठन
- Lodish H, Berk A, Matsudaira P, Kaiser CA, Krieger M, Scott MP, Zipursky L, Darnell J (2003). Molecular Cell Biology (5th ed.). New York: W.H. Freeman and Company. ISBN 978-0-7167-4366-8.
- Tooze C, Branden J (1999). Introduction to protein structure (2nd ed.). New York: Garland Pub. pp. 159–66. ISBN 978-0-8153-2305-1.
- Ogishima S, Tanaka H (January 2007). "Missing link in the evolution of Hox clusters". Gene. 387 (1–2): 21–30. doi:10.1016/j.gene.2006.08.011. PMID 17098381.
बाहरी संबंध
- The Homeodomain Resource (National Human Genome Research Institute, National Institutes oएफ Health)
- HomeoDB: a database oएफ homeobox वंशाणुs diversity. जेडhong Yएफ, Butts T, Holland PWH, since 2008.
- Eukaryotic Linear Motif resource motif class LIG_HOMEOBOX
- Homeobox at the US National Library of Medicine Medical Subject Headings (MeSH)
Cite error: <ref> tags exist for a group named "lower-alpha", but no corresponding <references group="lower-alpha"/> tag was found