बन्सेन कोशिका: Difference between revisions
(Created page with "thumb|बन्सेन की कोशिकाबन्सन सेल एक जस्ता -कार्बन प्राथम...") |
No edit summary |
||
| Line 1: | Line 1: | ||
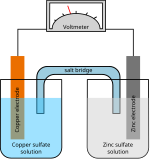
[[Image:Bunsen cell.jpg|thumb|बन्सेन की कोशिका]] | [[Image:Bunsen cell.jpg|thumb|बन्सेन की कोशिका]]बन्सेन सेल एक जिंक-कार्बन प्राथमिक सेल है (बोलचाल की भाषा में इसे "बैटरी" कहा जाता है) जो नाइट्रिक या क्रोमिक अम्ल में कार्बन कैथोड से एक झरझरा पॉट द्वारा अलग किए गए तनु सल्फ्यूरिक अम्ल में जिंक एनोड से बना होता है। | ||
== सेल विवरण == | === सेल विवरण === | ||
बन्सेन सेल लगभग 1.9 | बन्सेन सेल लगभग 1.9 वोल्ट का है और निम्नलिखित अभिक्रिया से उत्पन्न होता है:<ref>{{cite book | author = Carhart, Henry Smith | title = प्राथमिक बैटरियाँ| year = 1891 | publisher = Allyn and Bacon | location = Boston | pages = [https://archive.org/details/bub_gb_6aA3AAAAMAAJ/page/n187 179]–180 | url = https://archive.org/details/bub_gb_6aA3AAAAMAAJ | quote = बन्सेन कोशिका प्रतिक्रियाएँ।| access-date = 2008-09-13}}</ref> | ||
: Zn+H<sub>2</sub> | : Zn + H<sub>2</sub>SO<sub>4</sub> + 2 HNO<sub>3</sub> ⇌ ZnSO<sub>4</sub> + 2 H<sub>2</sub>O + 2 NO<sub>2</sub>(g) | ||
उपरोक्त | उपरोक्त अभिक्रिया के अनुसार, जब जिंक और सल्फ्यूरिक अम्ल का 1 मोल (या भाग) प्रत्येक नाइट्रिक अम्ल के 2 मोल (या भाग) के साथ अभिक्रिया करता है, तो परिणामी उत्पाद 1 मोल (या भाग) जिंक सल्फेट और 2 मोल ( या भाग) प्रत्येक जल और नाइट्रोजन डाइऑक्साइड (गैसीय, बुलबुले के रूप में)बनते हैं। | ||
सेल का नाम इसके आविष्कारक, जर्मन रसायनज्ञ | सेल का नाम इसके आविष्कारक, जर्मन रसायनज्ञ रॉबर्ट विल्हेम बन्सन के नाम पर रखा गया है, जिन्होंने ग्रोव के महंगे प्लैटिनम कैथोड को चूर्णित कोयले और कोक के रूप में कार्बन से बदलकर ग्रोव सेल में सुधार किया। ग्रोव की बैटरी की तरह, बन्सेन ने नाइट्रोजन डाइऑक्साइड का हानिकारक धुआं उत्सर्जित किया। | ||
बन्सेन ने इस सेल का उपयोग धातुएँ निकालने के लिए किया। | बन्सेन ने इस सेल का उपयोग धातुएँ निकालने के लिए किया। हेनरी मोइसन ने पहली बार फ्लोरीन प्राप्त करने के लिए हाइड्रोजन फ्लोराइड के विद्युत् अपघटन के लिए 90 कोशिकाओं के ढेर का उपयोग किया। | ||
==यह भी देखें== | ===यह भी देखें=== | ||
=== [[बैटरी का इतिहास]] === | |||
* [[बैटरी प्रकारों की सूची]] | * [[बैटरी प्रकारों की सूची]] | ||
* [[बैटरी नामकरण]] | * [[बैटरी नामकरण]] | ||
== संदर्भ == | === संदर्भ === | ||
{{Reflist}} | {{Reflist}} | ||
=== अग्रिम पठन === | |||
== अग्रिम पठन == | |||
*{{cite book | last = Ayrton | first = W.E. |author2=T. Mather | title = Practical Electricity | publisher = Cassell and Company | year = 1911 | location = London | pages = 183–185 }} | *{{cite book | last = Ayrton | first = W.E. |author2=T. Mather | title = Practical Electricity | publisher = Cassell and Company | year = 1911 | location = London | pages = 183–185 }} | ||
*{{cite book | last = Peschel | first = Karl Friedrich | title = Elements of Physics | publisher = Longman, Brown, Green, and Longmans | year = 1846 | url = https://archive.org/details/bub_gb_JqsLAAAAYAAJ | quote = bunsen cell. | page = [https://archive.org/details/bub_gb_JqsLAAAAYAAJ/page/n92 82] }} | *{{cite book | last = Peschel | first = Karl Friedrich | title = Elements of Physics | publisher = Longman, Brown, Green, and Longmans | year = 1846 | url = https://archive.org/details/bub_gb_JqsLAAAAYAAJ | quote = bunsen cell. | page = [https://archive.org/details/bub_gb_JqsLAAAAYAAJ/page/n92 82] }} | ||
| Line 44: | Line 44: | ||
| doi = 10.1002/andp.18411301109|bibcode = 1841AnP...130..417B | url = https://zenodo.org/record/1423584 | | doi = 10.1002/andp.18411301109|bibcode = 1841AnP...130..417B | url = https://zenodo.org/record/1423584 | ||
}} | }} | ||
===बाहरी संबंध=== | |||
==बाहरी संबंध== | |||
{{Commons category}} | {{Commons category}} | ||
*[https://web.archive.org/web/20060211010543/http://chem.ch.huji.ac.il/~eugeniik/history/bunsen.html#battery Bunsen "Battery"] | *[https://web.archive.org/web/20060211010543/http://chem.ch.huji.ac.il/~eugeniik/history/bunsen.html#battery Bunsen "Battery"] | ||
Revision as of 11:02, 8 August 2023
बन्सेन सेल एक जिंक-कार्बन प्राथमिक सेल है (बोलचाल की भाषा में इसे "बैटरी" कहा जाता है) जो नाइट्रिक या क्रोमिक अम्ल में कार्बन कैथोड से एक झरझरा पॉट द्वारा अलग किए गए तनु सल्फ्यूरिक अम्ल में जिंक एनोड से बना होता है।
सेल विवरण
बन्सेन सेल लगभग 1.9 वोल्ट का है और निम्नलिखित अभिक्रिया से उत्पन्न होता है:[1]
- Zn + H2SO4 + 2 HNO3 ⇌ ZnSO4 + 2 H2O + 2 NO2(g)
उपरोक्त अभिक्रिया के अनुसार, जब जिंक और सल्फ्यूरिक अम्ल का 1 मोल (या भाग) प्रत्येक नाइट्रिक अम्ल के 2 मोल (या भाग) के साथ अभिक्रिया करता है, तो परिणामी उत्पाद 1 मोल (या भाग) जिंक सल्फेट और 2 मोल ( या भाग) प्रत्येक जल और नाइट्रोजन डाइऑक्साइड (गैसीय, बुलबुले के रूप में)बनते हैं।
सेल का नाम इसके आविष्कारक, जर्मन रसायनज्ञ रॉबर्ट विल्हेम बन्सन के नाम पर रखा गया है, जिन्होंने ग्रोव के महंगे प्लैटिनम कैथोड को चूर्णित कोयले और कोक के रूप में कार्बन से बदलकर ग्रोव सेल में सुधार किया। ग्रोव की बैटरी की तरह, बन्सेन ने नाइट्रोजन डाइऑक्साइड का हानिकारक धुआं उत्सर्जित किया।
बन्सेन ने इस सेल का उपयोग धातुएँ निकालने के लिए किया। हेनरी मोइसन ने पहली बार फ्लोरीन प्राप्त करने के लिए हाइड्रोजन फ्लोराइड के विद्युत् अपघटन के लिए 90 कोशिकाओं के ढेर का उपयोग किया।
यह भी देखें
बैटरी का इतिहास
संदर्भ
- ↑ Carhart, Henry Smith (1891). प्राथमिक बैटरियाँ. Boston: Allyn and Bacon. pp. 179–180. Retrieved 2008-09-13.
बन्सेन कोशिका प्रतिक्रियाएँ।
अग्रिम पठन
- Ayrton, W.E.; T. Mather (1911). Practical Electricity. London: Cassell and Company. pp. 183–185.
- Peschel, Karl Friedrich (1846). Elements of Physics. Longman, Brown, Green, and Longmans. p. 82.
bunsen cell.
- R. Bunsen (1841). "Ueber eine neue Construction der galvanischen Säule". Annalen der Chemie und Pharmacie. 38 (3): 311–313. doi:10.1002/jlac.18410380306.
- R. Bunsen (1841). "Ueber die Anwendung der Kohle zu Volta'schen Batterien". Annalen der Physik und Chemie. 130 (11): 417–430. Bibcode:1841AnP...130..417B. doi:10.1002/andp.18411301109.