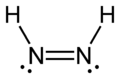डायमाइड: Difference between revisions
No edit summary |
No edit summary |
||
| (5 intermediate revisions by 3 users not shown) | |||
| Line 43: | Line 43: | ||
डायमाइड जिसे डायजेन या डाईमाइन भी कहा जाता है, एक यौगिक है जिसका सूत्र HN=NH है। यह दो [[ज्यामितीय आइसोमर|ज्यामितीय आइसोमर्स]], ''ई'' (''ट्रांस'') और ''जेड'' (''सिस'') के रूप में उपस्थित है। डाइमाइड के कार्बनिक डेरिवेटिव के लिए डायजेन शब्द अधिक सामान्य है। इस प्रकार, [[azobenzene|एज़ोबेंज़ीन]] एक कार्बनिक डायज़ीन का एक उदाहरण है। | डायमाइड जिसे डायजेन या डाईमाइन भी कहा जाता है, एक यौगिक है जिसका सूत्र HN=NH है। यह दो [[ज्यामितीय आइसोमर|ज्यामितीय आइसोमर्स]], ''ई'' (''ट्रांस'') और ''जेड'' (''सिस'') के रूप में उपस्थित है। डाइमाइड के कार्बनिक डेरिवेटिव के लिए डायजेन शब्द अधिक सामान्य है। इस प्रकार, [[azobenzene|एज़ोबेंज़ीन]] एक कार्बनिक डायज़ीन का एक उदाहरण है। | ||
== संश्लेषण == | == संश्लेषण == | ||
डायमाइड के लिए एक पारंपरिक मार्ग में हाइड्रोजन पेरोक्साइड या हवा के साथ [[हाइड्राज़ीन]] का ऑक्सीकरण सम्मिलित है।<ref name=OS>{{OrgSynth | author1 = Ohno, M.|author2=Okamoto, M. | title = cis-Cyclododecene | collvol = 5 | collvolpages = 281 | year = 1973 | prep = cv5p0281}}</ref> वैकल्पिक रूप से [[डायथाइल एज़ोडीकार्बोक्सिलेट]] या [[एजोडाइकार्बोनामाइड]] के हाइड्रोलिसिस डायमाइड प्रदान करता है:<ref>{{cite book | title = अकार्बनिक रसायन शास्त्र|author1=Wiberg, E. |author2=Holleman, A. F. | publisher = [[Elsevier]] | year = 2001 | isbn = 9780123526519 | chapter = 1.2.7: Diimine, N<sub>2</sub>H<sub>2</sub> | page = 628 | chapter-url = https://books.google.com/books?id=LxhQPdMRfVIC&pg=PA628}}</ref> | डायमाइड के लिए एक पारंपरिक मार्ग में हाइड्रोजन पेरोक्साइड या हवा के साथ [[हाइड्राज़ीन]] का ऑक्सीकरण सम्मिलित है।<ref name=OS>{{OrgSynth | author1 = Ohno, M.|author2=Okamoto, M. | title = cis-Cyclododecene | collvol = 5 | collvolpages = 281 | year = 1973 | prep = cv5p0281}}</ref> वैकल्पिक रूप से [[डायथाइल एज़ोडीकार्बोक्सिलेट]] या [[एजोडाइकार्बोनामाइड]] के हाइड्रोलिसिस डायमाइड प्रदान करता है:<ref>{{cite book | title = अकार्बनिक रसायन शास्त्र|author1=Wiberg, E. |author2=Holleman, A. F. | publisher = [[Elsevier]] | year = 2001 | isbn = 9780123526519 | chapter = 1.2.7: Diimine, N<sub>2</sub>H<sub>2</sub> | page = 628 | chapter-url = https://books.google.com/books?id=LxhQPdMRfVIC&pg=PA628}}</ref> | ||
:{{chem2|HO\sC(\dO)\sN\dN\sC(\dO)\sOH → HN\dNH + 2 CO2}} | :{{chem2|HO\sC(\dO)\sN\dN\sC(\dO)\sOH → HN\dNH + 2 CO2}} | ||
| Line 49: | Line 49: | ||
आजकल, डायमाइड 2,4,6-ट्राइसोप्रोपाइलबेनजेनसल्फोनीलहाइड्राजाइड के थर्मल अपघटन द्वारा उत्पन्न होता है।<ref>{{cite book |doi=10.1002/047084289X.rt259.pub2|chapter=2,4,6-Triisopropylbenzenesulfonylhydrazide|title=कार्बनिक संश्लेषण के लिए अभिकर्मकों का विश्वकोश|year=2008|last1=Chamberlin|first1=A. Richard|last2=Sheppeck|first2=James E.|last3=Somoza|first3=Alvaro|isbn=978-0471936237}}</ref> | आजकल, डायमाइड 2,4,6-ट्राइसोप्रोपाइलबेनजेनसल्फोनीलहाइड्राजाइड के थर्मल अपघटन द्वारा उत्पन्न होता है।<ref>{{cite book |doi=10.1002/047084289X.rt259.pub2|chapter=2,4,6-Triisopropylbenzenesulfonylhydrazide|title=कार्बनिक संश्लेषण के लिए अभिकर्मकों का विश्वकोश|year=2008|last1=Chamberlin|first1=A. Richard|last2=Sheppeck|first2=James E.|last3=Somoza|first3=Alvaro|isbn=978-0471936237}}</ref> | ||
इसकी अस्थिरता के कारण डायमाइड उत्पन्न होता है और इन-सीटू में उपयोग किया जाता है। सीआईएस (जेड-) और ट्रांस (ई-) आइसोमर्स दोनों का मिश्रण तैयार किया जाता है। दोनों आइसोमर्स अस्थिर हैं और वे धीमी गति से अंतर्संबंध से | इसकी अस्थिरता के कारण डायमाइड उत्पन्न होता है और इन-सीटू में उपयोग किया जाता है। सीआईएस (जेड-) और ट्रांस (ई-) आइसोमर्स दोनों का मिश्रण तैयार किया जाता है। दोनों आइसोमर्स अस्थिर हैं और वे धीमी गति से अंतर्संबंध से निकलते हैं। ट्रांस आइसोमर अधिक स्थिर है, किंतु सिस आइसोमर वह है जो असंतृप्त सबस्ट्रेट्स के साथ प्रतिक्रिया करता है इसलिए उनके बीच संतुलन ले चेटेलियर के सिद्धांत के कारण सिस आइसोमर की ओर शिफ्ट हो जाता है। कुछ प्रक्रियाएं कार्बोक्जिलिक अम्ल को जोड़ने के लिए बुलाती हैं जो सिस-ट्रांस आइसोमेराइजेशन को उत्प्रेरित करती हैं।<ref name="Pasto">{{cite encyclopedia | first = D. J. | last = Pasto | title = डायमाइड| encyclopedia = Encyclopedia of Reagents for Organic Synthesis | year = 2001 | publisher = John Wiley & Sons | doi = 10.1002/047084289X.rd235 | isbn = 0471936235 }}</ref> डायमाइड आसानी से विघटित हो जाता है। कम तापमान पर भी अधिक स्थिर ट्रांस आइसोमर तेजी से विभिन्न अनुपातहीनता प्रतिक्रियाओं से गुजरता है मुख्य रूप से हाइड्राज़ीन और [[नाइट्रोजन गैस]] बनाता है:<ref>{{cite book |title= अकार्बनिक रसायन शास्त्र|year= 2001 | publisher= Academic Press |isbn= 978-0123526519 | editor1-first= Nils |editor1-last= Wiberg |editor2-first= A. F. |editor2-last= Holleman |editor3-first= Egon |editor3-last= Wiberg |section= 1.2.7 Diimine N<sub>2</sub>H<sub>2</sub> [1.13.17] |pages= 628–632}}</ref> | ||
:{{chem2|2 HN\dNH → H2N\sNH2 + N2}} | :{{chem2|2 HN\dNH → H2N\sNH2 + N2}} | ||
इस प्रतिस्पर्धात्मक अपघटन प्रतिक्रिया के कारण डायमाइड के साथ कमी के लिए सामान्यत: अग्रगामी अभिकर्मक की एक बड़ी मात्रा की आवश्यकता होती है। | इस प्रतिस्पर्धात्मक अपघटन प्रतिक्रिया के कारण डायमाइड के साथ कमी के लिए सामान्यत: अग्रगामी अभिकर्मक की एक बड़ी मात्रा की आवश्यकता होती है। | ||
== कार्बनिक संश्लेषण के लिए अनुप्रयोग == | == कार्बनिक संश्लेषण के लिए अनुप्रयोग == | ||
{{Main|डायमाइड के साथ कमी}} | {{Main|डायमाइड के साथ कमी}} | ||
| Line 63: | Line 63: | ||
=== चयनात्मकता === | === चयनात्मकता === | ||
डायमाइड लाभान्वित है क्योंकि यह चुनिंदा रूप से अल्केन्स और अल्केन्स को कम करता है और कई [[कार्यात्मक समूह]] के प्रति प्रतिक्रिया नहीं करता है जो सामान्य [[उत्प्रेरक हाइड्रोजनीकरण]] में हस्तक्षेप करेगा। इस प्रकार, [[पेरोक्साइड]], [[ अल्काइल हलाइड |अल्काइल हैलाइड्स]] और थिओल्स को डायमाइड द्वारा सहन किया जाता है, किंतु इन समान समूहों को सामान्यत: धातु उत्प्रेरक द्वारा अवक्रमित किया जाएगा। अभिकर्मक अधिमानतः एल्केनीज़ और अनहेल्डेड या स्ट्रेंडेड एल्केन्स को संबंधित अल्केन्स और अल्केन्स में कम कर देता है।<ref name=OS/><ref name=Pasto/> | डायमाइड लाभान्वित है क्योंकि यह चुनिंदा रूप से अल्केन्स और अल्केन्स को कम करता है और कई [[कार्यात्मक समूह]] के प्रति प्रतिक्रिया नहीं करता है जो सामान्य [[उत्प्रेरक हाइड्रोजनीकरण]] में हस्तक्षेप करेगा। इस प्रकार, [[पेरोक्साइड]], [[ अल्काइल हलाइड |अल्काइल हैलाइड्स]] और थिओल्स को डायमाइड द्वारा सहन किया जाता है, किंतु इन समान समूहों को सामान्यत: धातु उत्प्रेरक द्वारा अवक्रमित किया जाएगा। अभिकर्मक अधिमानतः एल्केनीज़ और अनहेल्डेड या स्ट्रेंडेड एल्केन्स को संबंधित अल्केन्स और अल्केन्स में कम कर देता है।<ref name=OS/><ref name=Pasto/> | ||
== संबंधित == | |||
== संबंधित | |||
दीक्षा रूप, {{chem2|H\sN+\tN+\sH}} (डायज़ाइनेडियम, डिप्रोटोनेटेड डाइनाइट्रोजन), की गणना सबसे दृढ़ ज्ञात रासायनिक बंधन के लिए की जाती है। इस आयन को दोगुने प्रोटोनेटेड नाइट्रोजन अणु के रूप में माना जा सकता है। [[सापेक्ष बंधन शक्ति क्रम]] (आरबीएसओ) 3.38 है।<ref name=kal13>{{cite journal|last1=Kalescky|first1=Robert|last2=Kraka|first2=Elfi|last3=Cremer|first3=Dieter|title=रसायन विज्ञान में सबसे मजबूत बांड की पहचान|journal=The Journal of Physical Chemistry A|date=12 September 2013|volume=117|issue=36|pages=8981–8995|doi=10.1021/jp406200w|pmid=23927609|bibcode=2013JPCA..117.8981K|s2cid=11884042 }}</ref> डाइनाइट्रोजन मोनोफ्लोराइड {{chem2|F\sN+\tN+\sH}} (फ्लोरोडियाज़ाइनेडियम आयन) और डाइनाइट्रोजन डिफ़्लुओराइड|{{chem2|F\sN+\tN+\sF}} (डिफलुओरोडियाज़िनेडियम आयन) में थोड़ी कम दृढ़ वाले बॉन्ड होते हैं।<ref name=kal13/> | दीक्षा रूप, {{chem2|H\sN+\tN+\sH}} (डायज़ाइनेडियम, डिप्रोटोनेटेड डाइनाइट्रोजन), की गणना सबसे दृढ़ ज्ञात रासायनिक बंधन के लिए की जाती है। इस आयन को दोगुने प्रोटोनेटेड नाइट्रोजन अणु के रूप में माना जा सकता है। [[सापेक्ष बंधन शक्ति क्रम]] (आरबीएसओ) 3.38 है।<ref name=kal13>{{cite journal|last1=Kalescky|first1=Robert|last2=Kraka|first2=Elfi|last3=Cremer|first3=Dieter|title=रसायन विज्ञान में सबसे मजबूत बांड की पहचान|journal=The Journal of Physical Chemistry A|date=12 September 2013|volume=117|issue=36|pages=8981–8995|doi=10.1021/jp406200w|pmid=23927609|bibcode=2013JPCA..117.8981K|s2cid=11884042 }}</ref> डाइनाइट्रोजन मोनोफ्लोराइड {{chem2|F\sN+\tN+\sH}} (फ्लोरोडियाज़ाइनेडियम आयन) और डाइनाइट्रोजन डिफ़्लुओराइड|{{chem2|F\sN+\tN+\sF}} (डिफलुओरोडियाज़िनेडियम आयन) में थोड़ी कम दृढ़ वाले बॉन्ड होते हैं।<ref name=kal13/> | ||
==संदर्भ== | ==संदर्भ== | ||
| Line 72: | Line 69: | ||
{{Hydrides by group}} | {{Hydrides by group}} | ||
[[Category: | [[Category:Articles containing unverified chemical infoboxes]] | ||
[[Category:Articles with hatnote templates targeting a nonexistent page]] | |||
[[Category:Chemical articles with multiple CAS registry numbers|C]] | |||
[[Category:Chemical articles with multiple compound IDs|C]] | |||
[[Category:Collapse templates]] | |||
[[Category:Created On 23/05/2023]] | [[Category:Created On 23/05/2023]] | ||
[[Category:ECHA InfoCard ID from Wikidata]] | |||
[[Category:E number from Wikidata]] | |||
[[Category:Lua-based templates]] | |||
[[Category:Machine Translated Page]] | |||
[[Category:Multiple chemicals in an infobox that need indexing]] | |||
[[Category:Navigational boxes| ]] | |||
[[Category:Navigational boxes without horizontal lists]] | |||
[[Category:Pages using collapsible list with both background and text-align in titlestyle|background:transparent;font-weight:normal;text-align:left ]] | |||
[[Category:Pages with script errors]] | |||
[[Category:Sidebars with styles needing conversion]] | |||
[[Category:Template documentation pages|Documentation/doc]] | |||
[[Category:Templates Vigyan Ready]] | |||
[[Category:Templates generating microformats]] | |||
[[Category:Templates that add a tracking category]] | |||
[[Category:Templates that are not mobile friendly]] | |||
[[Category:Templates that generate short descriptions]] | |||
[[Category:Templates using TemplateData]] | |||
[[Category:Wikipedia metatemplates]] | |||
[[Category:अपचायक कारक]] | |||
[[Category:एज़ो यौगिक]] | |||
[[Category:नाइट्रोजन हाइड्राइड्स]] | |||
[[Category:रंग के साथ गैसें]] | |||
Latest revision as of 12:09, 14 July 2023
| |||
| |||
| Names | |||
|---|---|---|---|
| IUPAC name
Diazene
| |||
| Other names
Diimide
Diimine | |||
| Identifiers | |||
| |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| KEGG | |||
| MeSH | Diazene | ||
PubChem CID
|
|||
| UNII | |||
| |||
| |||
| Properties | |||
| HN=NH | |||
| Molar mass | 30.030 g·mol−1 | ||
| Appearance | Yellow gas | ||
| Melting point | −80 °C (−112 °F; 193 K) | ||
| Related compounds | |||
Other anions
|
diphosphene dinitrogen difluoride | ||
Other cations
|
azo compounds | ||
Related Binary azanes
|
|||
Related compounds
|
|||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |||
डायमाइड जिसे डायजेन या डाईमाइन भी कहा जाता है, एक यौगिक है जिसका सूत्र HN=NH है। यह दो ज्यामितीय आइसोमर्स, ई (ट्रांस) और जेड (सिस) के रूप में उपस्थित है। डाइमाइड के कार्बनिक डेरिवेटिव के लिए डायजेन शब्द अधिक सामान्य है। इस प्रकार, एज़ोबेंज़ीन एक कार्बनिक डायज़ीन का एक उदाहरण है।
संश्लेषण
डायमाइड के लिए एक पारंपरिक मार्ग में हाइड्रोजन पेरोक्साइड या हवा के साथ हाइड्राज़ीन का ऑक्सीकरण सम्मिलित है।[1] वैकल्पिक रूप से डायथाइल एज़ोडीकार्बोक्सिलेट या एजोडाइकार्बोनामाइड के हाइड्रोलिसिस डायमाइड प्रदान करता है:[2]
- HO−C(=O)−N=N−C(=O)−OH → HN=NH + 2 CO2
आजकल, डायमाइड 2,4,6-ट्राइसोप्रोपाइलबेनजेनसल्फोनीलहाइड्राजाइड के थर्मल अपघटन द्वारा उत्पन्न होता है।[3]
इसकी अस्थिरता के कारण डायमाइड उत्पन्न होता है और इन-सीटू में उपयोग किया जाता है। सीआईएस (जेड-) और ट्रांस (ई-) आइसोमर्स दोनों का मिश्रण तैयार किया जाता है। दोनों आइसोमर्स अस्थिर हैं और वे धीमी गति से अंतर्संबंध से निकलते हैं। ट्रांस आइसोमर अधिक स्थिर है, किंतु सिस आइसोमर वह है जो असंतृप्त सबस्ट्रेट्स के साथ प्रतिक्रिया करता है इसलिए उनके बीच संतुलन ले चेटेलियर के सिद्धांत के कारण सिस आइसोमर की ओर शिफ्ट हो जाता है। कुछ प्रक्रियाएं कार्बोक्जिलिक अम्ल को जोड़ने के लिए बुलाती हैं जो सिस-ट्रांस आइसोमेराइजेशन को उत्प्रेरित करती हैं।[4] डायमाइड आसानी से विघटित हो जाता है। कम तापमान पर भी अधिक स्थिर ट्रांस आइसोमर तेजी से विभिन्न अनुपातहीनता प्रतिक्रियाओं से गुजरता है मुख्य रूप से हाइड्राज़ीन और नाइट्रोजन गैस बनाता है:[5]
- 2 HN=NH → H2N−NH2 + N2
इस प्रतिस्पर्धात्मक अपघटन प्रतिक्रिया के कारण डायमाइड के साथ कमी के लिए सामान्यत: अग्रगामी अभिकर्मक की एक बड़ी मात्रा की आवश्यकता होती है।
कार्बनिक संश्लेषण के लिए अनुप्रयोग
डायमाइड कभी-कभी जैविक संश्लेषण में एक अभिकर्मक के रूप में उपयोगी होता है।[4] यह सब्सट्रेट के एक चेहरे से हाइड्रोजन के चयनात्मक वितरण के साथ अल्केन्स और एल्काइन्स को हाइड्रोजनीकृत करता है, जिसके परिणामस्वरूप H2 के धातु-उत्प्रेरित सिंक जोड़ के समान स्टीरियोसेलेक्टिविटी होती है। प्रचलित किया गया एकमात्र उत्पाद नाइट्रोजन गैस है। चूँकि विधि जटिल है, डायमाइड का उपयोग उच्च दबाव या हाइड्रोजन गैस और धातु उत्प्रेरक की आवश्यकता से बचा जाता है, जो मूल्यवान हो सकता है।[6] हाइड्रोजनीकरण तंत्र में छह-सदस्यीय C2H2N2 संक्रमण अवस्था सम्मिलित है:
चयनात्मकता
डायमाइड लाभान्वित है क्योंकि यह चुनिंदा रूप से अल्केन्स और अल्केन्स को कम करता है और कई कार्यात्मक समूह के प्रति प्रतिक्रिया नहीं करता है जो सामान्य उत्प्रेरक हाइड्रोजनीकरण में हस्तक्षेप करेगा। इस प्रकार, पेरोक्साइड, अल्काइल हैलाइड्स और थिओल्स को डायमाइड द्वारा सहन किया जाता है, किंतु इन समान समूहों को सामान्यत: धातु उत्प्रेरक द्वारा अवक्रमित किया जाएगा। अभिकर्मक अधिमानतः एल्केनीज़ और अनहेल्डेड या स्ट्रेंडेड एल्केन्स को संबंधित अल्केन्स और अल्केन्स में कम कर देता है।[1][4]
संबंधित
दीक्षा रूप, H−N+≡N+−H (डायज़ाइनेडियम, डिप्रोटोनेटेड डाइनाइट्रोजन), की गणना सबसे दृढ़ ज्ञात रासायनिक बंधन के लिए की जाती है। इस आयन को दोगुने प्रोटोनेटेड नाइट्रोजन अणु के रूप में माना जा सकता है। सापेक्ष बंधन शक्ति क्रम (आरबीएसओ) 3.38 है।[7] डाइनाइट्रोजन मोनोफ्लोराइड F−N+≡N+−H (फ्लोरोडियाज़ाइनेडियम आयन) और डाइनाइट्रोजन डिफ़्लुओराइड|F−N+≡N+−F (डिफलुओरोडियाज़िनेडियम आयन) में थोड़ी कम दृढ़ वाले बॉन्ड होते हैं।[7]
संदर्भ
- ↑ 1.0 1.1 Ohno, M.; Okamoto, M. (1973). "cis-Cyclododecene". Organic Syntheses.; Collective Volume, vol. 5, p. 281
- ↑ Wiberg, E.; Holleman, A. F. (2001). "1.2.7: Diimine, N2H2". अकार्बनिक रसायन शास्त्र. Elsevier. p. 628. ISBN 9780123526519.
- ↑ Chamberlin, A. Richard; Sheppeck, James E.; Somoza, Alvaro (2008). "2,4,6-Triisopropylbenzenesulfonylhydrazide". कार्बनिक संश्लेषण के लिए अभिकर्मकों का विश्वकोश. doi:10.1002/047084289X.rt259.pub2. ISBN 978-0471936237.
- ↑ 4.0 4.1 4.2 Pasto, D. J. (2001). "डायमाइड". Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. doi:10.1002/047084289X.rd235. ISBN 0471936235.
- ↑ Wiberg, Nils; Holleman, A. F.; Wiberg, Egon, eds. (2001). "1.2.7 Diimine N2H2 [1.13.17]". अकार्बनिक रसायन शास्त्र. Academic Press. pp. 628–632. ISBN 978-0123526519.
- ↑ Miller, C. E. (1965). "Diimide के साथ हाइड्रोजनीकरण". Journal of Chemical Education. 42 (5): 254–259. Bibcode:1965JChEd..42..254M. doi:10.1021/ed042p254.
- ↑ 7.0 7.1 Kalescky, Robert; Kraka, Elfi; Cremer, Dieter (12 September 2013). "रसायन विज्ञान में सबसे मजबूत बांड की पहचान". The Journal of Physical Chemistry A. 117 (36): 8981–8995. Bibcode:2013JPCA..117.8981K. doi:10.1021/jp406200w. PMID 23927609. S2CID 11884042.