हाइड्रोजन बंध: Difference between revisions
No edit summary |
No edit summary |
||
| Line 137: | Line 137: | ||
प्रोटीन की द्वितीयक संरचना में, बैकबोन ऑक्सीजेन और एमाइड हाइड्रोजन के बीच हाइड्रोजन बॉन्ड बनते हैं। जब हाइड्रोजन बॉन्ड में भाग लेने वाले अमीनो एसिड के अवशेषों का स्थान i और i + 4 के बीच नियमित रूप से होता है, तो एक अल्फा हेलिक्स बनता है। जब स्थान i और i + 3 के बीच कम होता है, तो एक 310 हेलिक्स बनता है। जब दो स्ट्रैंड्स हाइड्रोजन बॉन्ड से जुड़ते हैं, जिसमें प्रत्येक भाग लेने वाले स्ट्रैंड पर वैकल्पिक अवशेष सम्मलित होते हैं, तो एक बीटा शीट बनती है। हाइड्रोजन बांड आर-समूहों की बातचीत के माध्यम से प्रोटीन की तृतीयक संरचना बनाने में भी भूमिका निभाते हैं। | प्रोटीन की द्वितीयक संरचना में, बैकबोन ऑक्सीजेन और एमाइड हाइड्रोजन के बीच हाइड्रोजन बॉन्ड बनते हैं। जब हाइड्रोजन बॉन्ड में भाग लेने वाले अमीनो एसिड के अवशेषों का स्थान i और i + 4 के बीच नियमित रूप से होता है, तो एक अल्फा हेलिक्स बनता है। जब स्थान i और i + 3 के बीच कम होता है, तो एक 310 हेलिक्स बनता है। जब दो स्ट्रैंड्स हाइड्रोजन बॉन्ड से जुड़ते हैं, जिसमें प्रत्येक भाग लेने वाले स्ट्रैंड पर वैकल्पिक अवशेष सम्मलित होते हैं, तो एक बीटा शीट बनती है। हाइड्रोजन बांड आर-समूहों की बातचीत के माध्यम से प्रोटीन की तृतीयक संरचना बनाने में भी भूमिका निभाते हैं। | ||
द्विभाजित H-बॉन्ड सिस्टम अल्फा-हेलिकल ट्रांसमेम्ब्रेन प्रोटीन में बैकबोन एमाइड {{chem2|C\dO}} के बीच H-बॉन्ड स्वीकर्ता के रूप में साधारण हैं और अवशेष {{nowrap|''i'' + 4}}: से 2 एच-बॉन्ड डोनर: {{chem2|N\sH}} और एक साइड के बीच बैकबोन -चेन हाइड्रॉक्सिल या थिओल {{chem2|H+}}. द्विभाजित H-बॉन्ड हाइड्रॉक्सिल या थियोल सिस्टम की ऊर्जा वरीयता क्रमशः -3.4 kcal/mol या -2.6 kcal/mol है। इस प्रकार का द्विभाजित H-बॉन्ड हाइड्रोफोबिक झिल्ली वातावरण के अन्दर ध्रुवीय साइड-चेन, जैसे सेरीन, थ्रेओनीन और सिस्टीन के लिए एक इंट्राहेलिकल H-बॉन्डिंग पार्टनर प्रदान करता है। | द्विभाजित H-बॉन्ड सिस्टम अल्फा-हेलिकल ट्रांसमेम्ब्रेन प्रोटीन में बैकबोन एमाइड {{chem2|C\dO}} के बीच H-बॉन्ड स्वीकर्ता के रूप में साधारण हैं और अवशेष {{nowrap|''i'' + 4}}: से 2 एच-बॉन्ड डोनर: {{chem2|N\sH}} और एक साइड के बीच बैकबोन -चेन हाइड्रॉक्सिल या थिओल {{chem2|H+}}. द्विभाजित H-बॉन्ड हाइड्रॉक्सिल या थियोल सिस्टम की ऊर्जा वरीयता क्रमशः -3.4 kcal/mol या -2.6 kcal/mol है। इस प्रकार का द्विभाजित H-बॉन्ड हाइड्रोफोबिक झिल्ली वातावरण के अन्दर ध्रुवीय साइड-चेन, जैसे सेरीन, थ्रेओनीन और सिस्टीन के लिए एक इंट्राहेलिकल H-बॉन्डिंग पार्टनर प्रदान करता है। | ||
प्रोटीन फोल्डिंग में हाइड्रोजन बॉन्ड की भूमिका को ऑस्मोलिट-प्रेरित प्रोटीन स्थिरीकरण से भी जोड़ा गया है। ट्रेहलोज और सोर्बिटोल जैसे सुरक्षात्मक ऑस्मोलिट्स, एकाग्रता पर निर्भर नियम से प्रोटीन फोल्डिंग संतुलन को तह स्थिति की ओर ले जाते हैं। जबकि ऑस्मोलाइट क्रिया के लिए प्रचलित स्पष्टीकरण बहिष्कृत वॉल्यूम प्रभावों पर निर्भर करता है जो प्रकृति में एन्ट्रॉपीय तरंग हैं, वृत्तीय द्विवर्णता (CD) प्रयोगों ने ऑस्मोलाइट को एक एन्थैल्पिक प्रभाव के माध्यम से कार्य करने के लिए दिखाया है।<ref>{{cite journal|last=Politi|first=Regina|author2=Harries, Daniel|title=सुरक्षात्मक ऑस्मोलाइट्स द्वारा उत्साही रूप से संचालित पेप्टाइड स्थिरीकरण|journal=ChemComm|year=2010|volume=46|pages=6449–6451|doi=10.1039/C0CC01763A|pmid=20657920|issue=35}}</ref> प्रोटीन स्थिरीकरण में उनकी भूमिका के लिए आणविक तंत्र अभी भी अच्छी तरह से स्थापित नहीं है, चूंकि कई तंत्र प्रस्तावित किए गए हैं। कंप्यूटर आणविक गतिशीलता अनुरूपण सुझाव देते हैं कि प्रोटीन हाइड्रेशन परत में हाइड्रोजन बॉन्ड को संशोधित करके ऑस्मोलाइट्स प्रोटीन को स्थिर करते हैं। [<ref>{{cite journal|last=Gilman-Politi|first=Regina|author2=Harries, Daniel|title=पॉलीओल ऑस्मोलाइट्स द्वारा एन्थैल्पी ड्रिवेन पेप्टाइड फोल्डिंग के आणविक तंत्र को खोलना|journal=Journal of Chemical Theory and Computation|year=2011|volume=7|issue=11|pages=3816–3828|doi=10.1021/ct200455n|pmid=26598272}}</ref> | प्रोटीन फोल्डिंग में हाइड्रोजन बॉन्ड की भूमिका को ऑस्मोलिट-प्रेरित प्रोटीन स्थिरीकरण से भी जोड़ा गया है। ट्रेहलोज और सोर्बिटोल जैसे सुरक्षात्मक ऑस्मोलिट्स, एकाग्रता पर निर्भर नियम से प्रोटीन फोल्डिंग संतुलन को तह स्थिति की ओर ले जाते हैं। जबकि ऑस्मोलाइट क्रिया के लिए प्रचलित स्पष्टीकरण बहिष्कृत वॉल्यूम प्रभावों पर निर्भर करता है जो प्रकृति में एन्ट्रॉपीय तरंग हैं, वृत्तीय द्विवर्णता (CD) प्रयोगों ने ऑस्मोलाइट को एक एन्थैल्पिक प्रभाव के माध्यम से कार्य करने के लिए दिखाया है।<ref>{{cite journal|last=Politi|first=Regina|author2=Harries, Daniel|title=सुरक्षात्मक ऑस्मोलाइट्स द्वारा उत्साही रूप से संचालित पेप्टाइड स्थिरीकरण|journal=ChemComm|year=2010|volume=46|pages=6449–6451|doi=10.1039/C0CC01763A|pmid=20657920|issue=35}}</ref> प्रोटीन स्थिरीकरण में उनकी भूमिका के लिए आणविक तंत्र अभी भी अच्छी तरह से स्थापित नहीं है, चूंकि कई तंत्र प्रस्तावित किए गए हैं। कंप्यूटर आणविक गतिशीलता अनुरूपण सुझाव देते हैं कि प्रोटीन हाइड्रेशन परत में हाइड्रोजन बॉन्ड को संशोधित करके ऑस्मोलाइट्स प्रोटीन को स्थिर करते हैं। [<ref>{{cite journal|last=Gilman-Politi|first=Regina|author2=Harries, Daniel|title=पॉलीओल ऑस्मोलाइट्स द्वारा एन्थैल्पी ड्रिवेन पेप्टाइड फोल्डिंग के आणविक तंत्र को खोलना|journal=Journal of Chemical Theory and Computation|year=2011|volume=7|issue=11|pages=3816–3828|doi=10.1021/ct200455n|pmid=26598272}}</ref> | ||
| Line 191: | Line 191: | ||
{{Authority control}} | {{Authority control}} | ||
{{DEFAULTSORT:Hydrogen Bonds}} | {{DEFAULTSORT:Hydrogen Bonds}} | ||
[[Category:All pages needing factual verification|Hydrogen Bonds]] | |||
[[Category: | [[Category:Articles with invalid date parameter in template|Hydrogen Bonds]] | ||
[[Category:Created On 03/11/2022]] | [[Category:Collapse templates|Hydrogen Bonds]] | ||
[[Category:Created On 03/11/2022|Hydrogen Bonds]] | |||
[[Category:Machine Translated Page|Hydrogen Bonds]] | |||
[[Category:Navigational boxes| ]] | |||
[[Category:Navigational boxes without horizontal lists|Hydrogen Bonds]] | |||
[[Category:Pages with reference errors]] | |||
[[Category:Pages with script errors|Hydrogen Bonds]] | |||
[[Category:Short description with empty Wikidata description|Hydrogen Bonds]] | |||
Revision as of 18:39, 8 June 2023
रसायन विज्ञान में, एक हाइड्रोजन बांड परमाणु के बीच मुख्य रूप से इलेक्ट्रोस्टैटिक आकर्षण का बल होता है जो एक अधिक इलेक्ट्रोनगेटिव "डोनर" परमाणु या समूह (DN) के लिए सहसंयोजक रूप से बाध्य होता है, और एक अन्य इलेक्ट्रोनगेटिव परमाणु प्रभाव पडता है। इलेक्ट्रॉनों की अकेली जोड़ी-हाइड्रोजन बांड स्वीकर्ता (AC)। इस तरह की परस्पर क्रिया करने वाली प्रणाली को सामान्यतः Dn−H···Ac कहा जाता है, जहां ठोस रेखा एक ध्रुवीय सहसंयोजक बांड को दर्शाती है, और बिंदुकित या डैटामेशन रेखा हाइड्रोजन बांड को इंगित करती है।[5] जिसमे निरन्तर और स्वीकर्ता परमाणु अवधि तत्व नाइट्रोजन (N), ऑक्सीजन (O), और फ्लोरीन (F) होते हैं।
हाइड्रोजन बांड इंटरमॉलिक्युलर या इंट्रामोल्युलर हो सकते हैं। ISBN 0343171600[6][7][8] हाइड्रोजन बांड की ऊर्जा ज्यामिति, पर्यावरण और विशिष्ट डोनर और स्वीकर्ता परमाणुओं की प्रकृति पर निर्भर करती है और 1 और 40 किलो कैलोरी के बीच भिन्न हो सकती है।[9] यह उन्हें वान्डरवाल्स बल से कुछ हद तक ठोस बनाता है, और पूरी तरह से सहसंयोजक बांड या आयनिक बांड से असमर्थ होता है। इस प्रकार का बांड पानी जैसे अकार्बनिक अणुओं और DNA और प्रोटीन जैसे कार्बनिक अणुओं में हो सकता है। हाइड्रोजन बांड कागज और ऊन जैसी सामग्री को एक साथ रखने के लिए और कागज की अलग-अलग शीट को गीला होने और बाद में सूखने के बाद आपस में चिपकाने के लिए उत्तरदायी होता हैं।
हाइड्रोजन बांड N, O, और F के यौगिकों के कई भौतिक और रासायनिक गुणों के लिए उत्तरदायी है जो अन्य समान संरचनाओं की तुलना में असामान्य लगते हैं। विशेष रूप से, इंटरमॉलिक्यूलर हाइड्रोजन बॉन्डिंग अन्य समूह -16 हाइड्राइड्स की तुलना में पानी के उच्च क्वथनांक (100 °C) के लिए उत्तरदायी है, जिसमें बहुत दुर्बल हाइड्रोजन बॉन्ड होते हैं।[10] इंट्रामोल्युलर हाइड्रोजन बॉन्डिंग प्रोटीन और न्यूक्लिक एसिड की द्वितीयक और तृतीयक संरचनाओं के लिए आंशिक रूप से उत्तरदायी होते है। यह अवास्तविक और प्राकृतिक दोनों तरह के पॉलिमर की संरचना में भी महत्वपूर्ण भूमिका निभाता है।
बांड

परिभाषाएं और सामान्य विशेषताएं
हाइड्रोजन बांड में, हाइड्रोजन से सहसंयोजक रूप से जुड़े इलेक्ट्रोनगेटिव परमाणु को प्रोटॉन स्वीकर्ता का नाम दिया जाता है, जबकि हाइड्रोजन से जुड़े सहसंयोजक को प्रोटॉन डोनर का नाम दिया जाता है। IUPAC द्वारा इस नामकरण की अनुशंसा की गई है।[5] डोनर का हाइड्रोजन प्रोटिक है और इसलिए लुईस एसिड के रूप में कार्य करता है और स्वीकर्ता लुईस बेस है। हाइड्रोजन बॉन्ड को H···Y सिस्टम के रूप में दर्शाया जाता है, जहां डॉट्स हाइड्रोजन बॉन्ड का प्रतिनिधित्व करते हैं। तरल पदार्थ जो हाइड्रोजन बॉन्डिंग प्रदर्शित करते हैं, संबंधित तरल पदार्थ कहलाते हैं।
हाइड्रोजन बॉन्ड इलेक्ट्रोस्टैटिक्स, सहसंयोजकता, और विस्तारों के संयोजन से उत्पन्न होते हैं। [5]
असमर्थ हाइड्रोजन बांडों में,[12] हाइड्रोजन परमाणु सल्फर (S) या क्लोरीन (Cl) जैसे तत्वों से बंधते हैं; यहां तक कि कार्बन (C) भी एक डोनर के रूप में काम कर सकता है, विशेषतः जब कार्बन या उसके सहवासीयों में से एक इलेक्ट्रोनगेटिव हो।[13][14] धीरे-धीरे, यह पहचाना गया कि असमर्थ हाइड्रोजन बॉन्डिंग के कई उदाहरण हैं जिनमें N, O, या F या स्वीकर्ता AC के अतिरिक्त अन्य डोनर सम्मलित हैं, जिनकी इलेक्ट्रोनगेटिविटी हाइड्रोजन के करीब पहुंच रही है। चूंकि (≈1 kcal/mol), "गैर-पारंपरिक" हाइड्रोजन बॉन्डिंग अन्तःक्रिया सर्वव्यापी हैं और कई प्रकार की सामग्रियों की संरचनाओं को प्रभावित करते हैं।
इन असमर्थ आकर्षक अंतःक्रियाओं को सम्मलित करने के लिए हाइड्रोजन बॉन्डिंग की परिभाषा समय के साथ धीरे-धीरे विस्तृत हुई है। 2011 में, एक IUPAC टास्क ग्रुप ने हाइड्रोजन बॉन्डिंग की आधुनिक साक्ष्य-आधारित परिभाषा की अनुशंसा की, जो IUPAC जर्नल प्योर एंड एप्लाइड के मिस्ट्री में प्रकाशित हुई थी। यह परिभाषा निर्दिष्ट करती है:
हाइड्रोजन बॉन्ड एक अणु या एक आणविक खंड X-H से हाइड्रोजन परमाणु के बीच एक आकर्षक संपर्क है जिसमें X, H की तुलना में अधिक विद्युतीय है, और एक परमाणु या एक ही या दूसरे अणु में परमाणुओं का एक समूह है, जिसमें यह प्रमाण है बांड गठन का।[15]
बांड की क्षमता
हाइड्रोजन बांड (1-2 kJ/mol) से दृढ़ (161.5 kJ/mol bifluoride आयन, HF) में भिन्न हो सकते हैं.[16][17] जो वाष्प में विशिष्ट ऊष्मा में सम्मलित हैं:[18]
- F−H···:F (161.5 kJ/mol या 38.6 kcal/mol), HF−2 द्वारा विशिष्ट रूप से सचित्र किया गया है।
- O−H···:N (29 kJ/mol या 6.9 kcal/mol), सचित्र जल-अमोनिया है।
- O−H···:O (21 kJ/mol या 5.0 kcal/mol), सचित्र जलापूर्ति, अल्कोहल होता है।
- N−H···:N (13 kJ/mol या 3.1 kcal/mol), अमोनिया द्वारा चित्रित है।
- N−H···:O (8 kJ/mol या 1.9 kcal/mol), सचित्र जलापूर्ति-एमाइड होता है।
- OH+3···:OH2 (18 kJ/mol[19] या 4.3 kcal/mol) है।
इंटरमॉलिक्युलर हाइड्रोजन बॉन्ड की गुण का मूल्यांकन अधिकांशतः डोनर और स्वीकर्ता इकाइयों वाले अणुओं के बीच संतुलन के मापन द्वारा किया जाता है, जो अधिकांशतः समाधान में होता है।[20] इंट्रामोल्युलर हाइड्रोजन बॉन्ड की गुण का अध्ययन हाइड्रोजन बांड के साथ और बिना कन्फर्मर्स के बीच संतुलन के साथ किया जा सकता है। जटिल अणुओं में भी हाइड्रोजन बांड की पहचान के लिए सबसे महत्वपूर्ण नियम क्रिस्टलोग्राफी है, कभी-कभी NMR-स्पेक्ट्रोस्कोपी भी है। संरचनात्मक विवरण, विशेष रूप से डोनर और स्वीकर्ता के बीच की दूरी वाल्स रेडी के योग से कम है, जीससे हाइड्रोजन बॉन्ड शक्ति के संकेत के रूप में लिया जा सकता है।
एक योजना निम्नलिखित कुछ मनमाना वर्गीकरण देती है: जो 15 से 40 kcal/mol, 5 से 15 kcal/mol, और > 0 से 5 kcal/mol हैं, उन्हें क्रमशः दृढ़, मध्यम और दुर्बल माना जाता है।
रेजोनेंस असिस्टेड हाइड्रोजन बॉन्ड
अनुनाद सहायता प्राप्त हाइड्रोजन बॉन्ड एक दृढ़ प्रकार का हाइड्रोजन बॉन्ड है। यह π- विस्थापन द्वारा विशेषता है जिसमें हाइड्रोजन सम्मलित है और अकेले इलेक्ट्रोस्टैटिक मॉडल द्वारा ठीक से वर्णित नहीं किया जा सकता है। हाइड्रोजन बॉन्ड का यह विवरण सामान्यतः O=C−OH··· या ···O=C−C=C−OH के बीच असामान्य रूप से कम दूरी का वर्णन करने के लिए प्रस्तावित किया गया है।[21]
संरचनात्मक विवरण
X−H दूरी सामान्यतः ≈110 pm होती है, जबकि H···Y दूरी ≈160 से 200 pm है। पानी में हाइड्रोजन बॉन्ड की विशिष्ट लंबाई 197 pm होती है। आदर्श आबंध कोण हाइड्रोजन आबंध डोनर की प्रकृति पर निर्भर करता है। हाइड्रोफ्लोरोइक एसिड डोनर और विभिन्न स्वीकारकर्ताओं के बीच निम्नलिखित हाइड्रोजन बॉन्ड कोण प्रयोगात्मक रूप से निर्धारित किए गए हैं:[22]
| ऐक्सेप्टर··· डोनर | VSEPR जीआमिट्री | ऐंगअल (°) |
|---|---|---|
| HCN···HF | लिनीअर | 180 |
| H2CO···HF | ट्रिगनल प्लेनर | 120 |
| H2O···HF | पिरैमिडल | 46 |
| H2S···HF | पिरैमिडल | 89 |
| SO2···HF[verification needed] | ट्रिगनल | 142 |
स्पेक्ट्रोस्कोपी
1H NMR वर्णक्रम में डाउनफील्ड शिफ्ट द्वारा ठोस हाइड्रोजन बॉन्ड का पता चलता है। उदाहरण के लिए, एसिटाइलसिटोन के एनोल टॉटोमर में अम्लीय प्रोटॉन प्रकट होता है 15.5,जो एक पारंपरिक अल्कोहल का लगभग 10 PPM डाउनफ़ील्ड है।[23]
IR स्पेक्ट्रम में, हाइड्रोजन बॉन्ड X−H की आवृत्ति को कम ऊर्जा में स्थानांतरित करता है। यह बदलाव X−H बांड के असमर्थ होने को दर्शाता है। कुछ हाइड्रोजन बॉन्ड - अनुचित हाइड्रोजन बॉन्ड X−H विस्तारण आवृति की नीले रंग में परिवर्तन और बॉन्ड की लंबाई में कमी दिखाते हैं।[24] H-बॉन्ड को स्वीकर्ता के IR कंपन मोड आवृति द्वारा भी मापा जा सकता है। जब वे साइड-चेन हाइड्रॉक्सिल समूहों के साथ H-बॉन्ड बनाते हैं, तो α-हेलीसेस में बैकबोन कार्बोनिल्स का एमाइड मोड कम आवृत्तियों में बदल जाता है। पानी में हाइड्रोजन बांड संरचनाओं की गतिशीलता की जांच इस OH तनन कंपन द्वारा की जा सकती है। Cite error: Invalid <ref> tag; invalid names, e.g. too many प्रकाशी जैव आयनिक प्लास्टिक क्रिस्टल (POIPCs) में हाइड्रोजन बॉन्डिंग नेटवर्क में, जो पिघलने से पहले ठोस चरण संक्रमणों को प्रदर्शित करने वाली एक प्रकार की चरण परिवर्तन सामग्री है, चर-तापमान अवरक्त स्पेक्ट्रोस्कोपी हाइड्रोजन बांड की तापमान निर्भरता और गतिशीलता को प्रकट कर सकती है। ऋणायन और धनायन दोनों। [28] ठोस चरण संक्रमण के अतिरिक्त हाइड्रोजन बॉन्डों का अचानक सुगठित होना आयनों के पूर्वी या घूर्णी विकार की आरंभ के साथ जुड़ा हुआ प्रतीत होता है।
सैद्धांतिक विचार
हाइड्रोजन बॉन्डिंग लगातार सैद्धांतिक प्रवृत्ति का है।[25] एक आधुनिक विवरण के अनुसार O:H−O इंटरमॉलिक्युलर O:H लोन पेयर ":" नॉनबॉन्ड और इंट्रामोल्युलर H−O पोलर-कोवैलेंट बॉन्ड दोनों को एकीकृत करता है, जो O−O रिपलसिव कपलिंग से जुड़ा है।[26]
प्रासंगिक इंटररेसिड्यू संभावित स्थिरांक की क्वांटम रासायनिक गणना से पता चला है की[how?] एक ही प्रकार के व्यक्तिगत H बांड के बीच बड़े अंतर है। उदाहरण के लिए, गुआनिन और साइटोसिन के बीच केंद्रीय अंतःअवशेष N−H··N हाइड्रोजन बॉन्ड एडेनिन-थाइमिन जोड़ी के बीच N-H··N बॉन्ड की तुलना में बहुत सुगठित है।[27]
सैद्धांतिक रूप से, हाइड्रोजन बॉन्ड की बॉन्ड गुण का मूल्यांकन NCI सूचकांक, गैर-सहसंयोजक अन्तःक्रिया सूचकांक का उपयोग करके किया जा सकता है, जो इन गैर-सहसंयोजक अन्तःक्रिया के दृश्यकरण की अनुमति देता है, जैसा कि इसके नाम से संकेत मिलता है, सिस्टम के इलेक्ट्रॉन घनत्व का उपयोग करते है।
साधारण बर्फ के कॉम्पटन प्रोफाइल में विषम दैशिकता की व्याख्या से कि हाइड्रोजन बॉन्ड आंशिक रूप से सहसंयोजक है।[28] [29]
सामान्यतः, हाइड्रोजन बॉन्ड को दो या दो से अधिक इंटरमॉलिक्युलर बॉन्ड के बीच मापीय-निर्भर स्थिर वैद्युत् स्केलर फ़ील्ड के रूप में देखा जा सकता है। यह अंतःअणुक अवरूध्द स्टेट्स से थोड़ा अलग है, उदाहरण के लिए, सहसंयोजक या आयनिक बांड; चूंकि, हाइड्रोजन बॉन्डिंग सामान्यतः अभी भी एक बाध्य अवस्था की घटना है, चूंकि अंतःक्रियात्मक ऊर्जा का शुद्ध नकारात्मक योग होता है। लिनस पॉलिंग द्वारा प्रस्तावित हाइड्रोजन बॉन्डिंग के प्रारंभिक सिद्धांत ने सुझाव दिया कि हाइड्रोजन बॉन्ड में आंशिक सहसंयोजक प्रकृति होती है। यह व्याख्या तब तक विवादास्पद रही जब तक NMR तकनीकों ने हाइड्रोजन-बंधित नाभिकों के बीच सूचना हस्तांतरण का प्रदर्शन नहीं किया, यह एक ऐसी उपलब्धि थी जो केवल तभी संभव होगी जब हाइड्रोजन बॉन्ड में कुछ सहसंयोजक लक्षण होते है।[30]
इतिहास
हाइड्रोजन बॉन्ड की अवधारणा एक बार चुनौतीपूर्ण थी।[31] लिनस पॉलिंग ने 1912 में हाइड्रोजन बॉन्ड के पहले उल्लेख के साथ T.S. मूर और T.F. विनमिल को श्रेय दिया है। [32][33] मूर और विनमिल ने हाइड्रोजन बॉन्ड का उपयोग इस तथ्य के लिए किया कि ट्राइमेथिलअमोनियम हाइड्रॉक्साइड टेट्रामेथिलअमोनियम हाइड्रॉक्साइड की तुलना में अशक्त आधार है। इसकी बेहतर समायोजन, पानी में हाइड्रोजन बॉन्डिंग का वर्णन कुछ साल बाद, 1920 में लैटिमर और रोडबुश से आया था।[34] उस पत्र में, लैटीमर और रोडेबश ने अपनी प्रयोगशाला में एक साथी वैज्ञानिक मौरिस लॉयल हगिंस के काम का संकेत देते हुए कहा, "इस प्रयोगशाला के मिस्टर हगिन्स ने अभी तक अप्रकाशित कुछ काम में, दो परमाणुओं के बीच आयोजित हाइड्रोजन कर्नेल के विचार का उपयोग किया है कुछ कार्बनिक यौगिकों के संबंध में एक सिद्धांत है।
छोटे अणुओं में हाइड्रोजन बांड
पानी
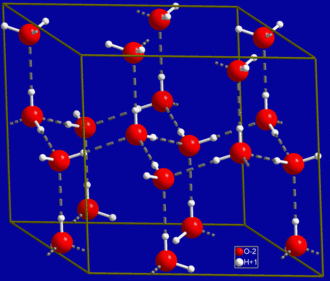
जल के अणुओं के बीच हाइड्रोजन बांड का एक सर्वव्यापी उदाहरण पाया जाता है। असतत पानी के अणु में दो हाइड्रोजन परमाणु और एक ऑक्सीजन परमाणु होते हैं। सबसे सरल स्थिति पानी के अणुओं की एक युग्म है, जिनके बीच एक हाइड्रोजन बांड होता है, जिसे पानी का डिमर कहा जाता है और इसे अधिकांशतः एक मॉडल प्रणाली के रूप में उपयोग किया जाता है। जब अधिक अणु सम्मलित होते हैं, जैसा कि तरल पानी के स्थिति में होता है, तो अधिक बांड संभव होते हैं चूंकि पानी के एक अणु के ऑक्सीजन में इलेक्ट्रॉनों के दो अकेले युग्म होते हैं, जिनमें से प्रत्येक दूसरे पानी के अणु पर हाइड्रोजन के साथ हाइड्रोजन बांड बना सकता है। यह ऐसा दोहरा सकता है कि प्रत्येक पानी का अणु चार अन्य अणुओं के साथ H-बंधित होता है, जैसा कि चित्र में दिखाया गया है। हाइड्रोजन बांड बर्फ की क्रिस्टल संरचना को दृढ़ता से प्रभावित करता है, जिससे खुले हेक्सागोनल जाली बनाने में मदद मिलती है। बर्फ का घनत्व उसी तापमान पर पानी के घनत्व से कम होता है; इस प्रकार, अधिकांश अन्य पदार्थों के विपरीत, पानी का ठोस चरण तरल पर तैरता है।
तरल पानी का उच्च क्वथनांक हाइड्रोजन बॉन्ड की उच्च संख्या के कारण होता है, जो प्रत्येक अणु अपने कम आणविक द्रव्यमान के सापेक्ष बना सकता है। इन बांडों को तोड़ने में कठिनाई के कारण, पानी में बहुत अधिक क्वथनांक, गलनांक और चिपचिपापन होता है, अन्यथा समान तरल पदार्थों की तुलना में जो हाइड्रोजन बांडों से नहीं जुड़े होते हैं। पानी अद्वितीय है चूंकि इसके ऑक्सीजन परमाणु में दो एकाकी युग्म और दो हाइड्रोजन परमाणु होते हैं, जिसका अर्थ है कि पानी के अणु के बांडों की कुल संख्या चार तक होती है।
तरल पानी के एक अणु द्वारा गठित हाइड्रोजन बंधों की संख्या समय और तापमान के साथ बदलती रहती है।[35] 25 डिग्री सेल्सियस पर TIP4P तरल जल सिमुलेशन से, यह अनुमान लगाया गया था कि प्रत्येक पानी का अणु औसतन 3.59 हाइड्रोजन बांड में भाग लेता है। 100 डिग्री सेल्सियस पर, आणविक गति में वृद्धि और घनत्व में कमी के कारण यह संख्या घटकर 3.24 हो जाती है, जबकि 0 डिग्री सेल्सियस पर, हाइड्रोजन बंधों की औसत संख्या बढ़कर 3.69 हो जाती है।[35] एक अन्य अध्ययन में हाइड्रोजन बंधों की संख्या बहुत कम पाई गई: 2.357 25 डिग्री सेल्सियस पर।[36] चूंकि हाइड्रोजन बॉन्ड को परिभाषित करना और गिनना सीधा नहीं है।
चूंकि पानी विलेय प्रोटॉन डोनरों और स्वीकर्ता के साथ हाइड्रोजन बांड बना सकता है, यह विलेय इंटरमॉलिक्युलर या इंट्रामोल्युलर हाइड्रोजन बांड के गठन को प्रतिस्पर्धात्मक रूप से रोक सकता है। नतीजतन, पानी में घुले विलेय अणुओं के बीच या अन्दर हाइड्रोजन बांड पानी और उन विलेय पर हाइड्रोजन बांड के लिए डोनरों और स्वीकारकर्ताओं के बीच हाइड्रोजन बांड के सापेक्ष लगभग हमेशा प्रतिकूल होते हैं।[37] पानी के अणुओं के बीच हाइड्रोजन बॉन्ड का औसत जीवनकाल 10−11 सेकंड या 10 पिकोसेकंड होता है।[38]
पानी में द्विभाजित और अति-समन्वित हाइड्रोजन बांड
एक एकल हाइड्रोजन परमाणु एक के अतिरिक्त दो हाइड्रोजन बांडों में भाग ले सकता है। इस प्रकार के संबंध को "द्विभाजित" कहा जाता है। उदाहरण के लिए, यह जटिल प्राकृतिक या सिंथेटिक कार्बनिक अणुओं में सम्मलित हो सकता है।[39] यह सुझाव दिया गया है कि द्विभाजित हाइड्रोजन परमाणु जल पुनर्संरचना में एक आवश्यक कदम है।[40]
स्वीकारकर्ता-प्ररूप हाइड्रोजन बॉन्ड्स में एक ही ऑक्सीजन के हाइड्रोजन्स पर प्रारंभ होने वाले डोनर-प्ररूप हाइड्रोजन बॉन्ड्स की तुलना में द्विभाजन बनाने की अधिक संभावना होती है[41]
अन्य तरल पदार्थ
उदाहरण के लिए, हाइड्रोजन फ्लोराइड—जिसके F परमाणु पर तीन एकाकी युग्म हैं लेकिन केवल एक H परमाणु—केवल दो बांड बना सकता है; (अमोनिया में विपरीत समस्या है: तीन हाइड्रोजन परमाणु लेकिन केवल एक अकेला युग्म) होता है।
- H-F***H-F****H-F
विलायक हाइड्रोजन बांड की और अभिव्यक्तियाँ
- कई यौगिकों के गलनांक, क्वथनांक, विलेयता और श्यानता में वृद्धि को हाइड्रोजन बांड की अवधारणा द्वारा समझाया जा सकता है।
- HF और पानी के मिश्रण की नकारात्मक स्थिरक्वाथी है।
- तथ्य यह है कि बर्फ तरल पानी की तुलना में कम घना है, हाइड्रोजन बॉन्ड द्वारा स्थिर क्रिस्टल संरचना के कारण है।
- NH3, H2O, और HF के भारी समकक्षों PH3, H2S, और HCl की तुलना में नाटकीय रूप से उच्च क्वथनांक, जहाँ हाइड्रोजन-बॉन्डिंग अनुपस्थित है।
- निर्जल फॉस्फोरिक एसिड और ग्लिसरॉल की चिपचिपाहट होती है।
- कार्बोक्जिलिक एसिड में डिमर गठन और हाइड्रोजन फ्लोराइड में हेक्सामर गठन, जो गैस चरण में भी होता है, जिसके परिणामस्वरूप आदर्श गैस कानून से सकल विचलन होता है।
- एपोलर सॉल्वैंट्स में पानी और अल्कोहल का पेंटामर गठन होता है।
पॉलिमर में हाइड्रोजन बांड
हाइड्रोजन बांड त्रि-आयामी संरचनाओं और कई सिंथेटिक और प्राकृतिक प्रोटीनों द्वारा अपनाए गए गुणों को निर्धारित करने में महत्वपूर्ण भूमिका निभाता है। C−C, C−O, तथा C−N बॉन्ड की तुलना में जिनमें अधिकांश पॉलिमर सम्मलित हैं, हाइड्रोजन बांड बहुत कमजोर हैं शायद 5%। इस प्रकार, बहुलक रीढ़ की मूल संरचना को बनाए रखते हुए हाइड्रोजन बांड को रासायनिक या यांत्रिक नियमोॆ से तोड़ा जा सकता है। बांड की ताकत का यह पदानुक्रम कई सामग्रियों के गुणों में प्रासंगिक है।[42]
DNA
इन मैक्रोमोलेक्यूल्स में, एक ही मैक्रोमोलेक्यूल के कुछ हिस्सों के बीच संबंध इसे एक विशिष्ट आकार में मोड़ने का कारण बनता है, जो अणु की शारीरिक या जैव रासायनिक भूमिका को निर्धारित करने में मदद करता है। उदाहरण के लिए, DNA की दोहरी पेचदार संरचना मुख्य रूप से इसके बेस युग्म के बीच हाइड्रोजन बॉन्डिंग के कारण होती है, जो एक पूरक स्ट्रैंड को दूसरे से जोड़ती है और प्रतिकृति को सक्षम करती है।
प्रोटीन
प्रोटीन की द्वितीयक संरचना में, बैकबोन ऑक्सीजेन और एमाइड हाइड्रोजन के बीच हाइड्रोजन बॉन्ड बनते हैं। जब हाइड्रोजन बॉन्ड में भाग लेने वाले अमीनो एसिड के अवशेषों का स्थान i और i + 4 के बीच नियमित रूप से होता है, तो एक अल्फा हेलिक्स बनता है। जब स्थान i और i + 3 के बीच कम होता है, तो एक 310 हेलिक्स बनता है। जब दो स्ट्रैंड्स हाइड्रोजन बॉन्ड से जुड़ते हैं, जिसमें प्रत्येक भाग लेने वाले स्ट्रैंड पर वैकल्पिक अवशेष सम्मलित होते हैं, तो एक बीटा शीट बनती है। हाइड्रोजन बांड आर-समूहों की बातचीत के माध्यम से प्रोटीन की तृतीयक संरचना बनाने में भी भूमिका निभाते हैं।
द्विभाजित H-बॉन्ड सिस्टम अल्फा-हेलिकल ट्रांसमेम्ब्रेन प्रोटीन में बैकबोन एमाइड C=O के बीच H-बॉन्ड स्वीकर्ता के रूप में साधारण हैं और अवशेष i + 4: से 2 एच-बॉन्ड डोनर: N−H और एक साइड के बीच बैकबोन -चेन हाइड्रॉक्सिल या थिओल H+. द्विभाजित H-बॉन्ड हाइड्रॉक्सिल या थियोल सिस्टम की ऊर्जा वरीयता क्रमशः -3.4 kcal/mol या -2.6 kcal/mol है। इस प्रकार का द्विभाजित H-बॉन्ड हाइड्रोफोबिक झिल्ली वातावरण के अन्दर ध्रुवीय साइड-चेन, जैसे सेरीन, थ्रेओनीन और सिस्टीन के लिए एक इंट्राहेलिकल H-बॉन्डिंग पार्टनर प्रदान करता है।
प्रोटीन फोल्डिंग में हाइड्रोजन बॉन्ड की भूमिका को ऑस्मोलिट-प्रेरित प्रोटीन स्थिरीकरण से भी जोड़ा गया है। ट्रेहलोज और सोर्बिटोल जैसे सुरक्षात्मक ऑस्मोलिट्स, एकाग्रता पर निर्भर नियम से प्रोटीन फोल्डिंग संतुलन को तह स्थिति की ओर ले जाते हैं। जबकि ऑस्मोलाइट क्रिया के लिए प्रचलित स्पष्टीकरण बहिष्कृत वॉल्यूम प्रभावों पर निर्भर करता है जो प्रकृति में एन्ट्रॉपीय तरंग हैं, वृत्तीय द्विवर्णता (CD) प्रयोगों ने ऑस्मोलाइट को एक एन्थैल्पिक प्रभाव के माध्यम से कार्य करने के लिए दिखाया है।[43] प्रोटीन स्थिरीकरण में उनकी भूमिका के लिए आणविक तंत्र अभी भी अच्छी तरह से स्थापित नहीं है, चूंकि कई तंत्र प्रस्तावित किए गए हैं। कंप्यूटर आणविक गतिशीलता अनुरूपण सुझाव देते हैं कि प्रोटीन हाइड्रेशन परत में हाइड्रोजन बॉन्ड को संशोधित करके ऑस्मोलाइट्स प्रोटीन को स्थिर करते हैं। [[44]
कई अध्ययनों से पता चला है कि बहुतयी प्रोटीन में सबयूनिट्स के बीच स्थिरता के लिए हाइड्रोजन बॉन्ड महत्वपूर्ण भूमिका निभाते हैं। उदाहरण के लिए, सोर्बिटोल डिहाइड्रोजनेज के एक अध्ययन ने एक महत्वपूर्ण हाइड्रोजन बॉन्डिंग नेटवर्क प्रदर्शित किया जो स्तनधारी सोर्बिटोल डिहाइड्रोजनेज प्रोटीन परिवार के अन्दर टेट्रामेरिक चतुर्धातुक संरचना को स्थिर करता है।[45]
पानी के आवेग से पूरी तरह से परिरक्षित एक प्रोटीन बैकबोन हाइड्रोजन बॉन्ड एक डिहाइड्रॉन है। डिहाइड्रॉन्स प्रोटीन या लिगैंड बाइंडिंग के माध्यम से पानी को हटाने को बढ़ावा देते हैं। बहिःप्रेरित निर्जलीकरण एमाइड और कार्बोनिल समूहों के बीच उनके आंशिक आवेशों को d- वर्ण करके स्थिर वैद्युत भंडारण अन्तःक्रिया को बढ़ाता है। इसके अतिरिक्त, निर्जलीकरण निर्जलित पृथक आवेशों से युक्त गैर-बंधित अवस्था को अस्थिर करके हाइड्रोजन बांड को स्थिर करता है।[46]
ऊन, एक प्रोटीन फाइबर होने के नाते, हाइड्रोजन बॉन्डों द्वारा एक साथ रखा जाता है, जिससे ऊन खिंचने पर पीछे हट जाता है। चूंकि, उच्च तापमान हाइड्रोजन बांड स्थायी रूप से समाप्त हो सकते हैं और एक परिधान स्थायी रूप से अपना आकार खो सकता है।
सेल्यूलोज
कपास और सन जैसे सेलूलोज़ और व्युत्पन्न फाइबर की संरचना में हाइड्रोजन बॉन्ड महत्वपूर्ण हैं।
सिंथेटिक पॉलिमर
कई सिंथेटिक पॉलिमर के गुण जंजीरों के अन्दर और बीच के हाइड्रोजन बांड से प्रभावित होते हैं। नायलॉन में, एमाइड रिपीट यूनिट में कार्बोनिल और एमाइन समूहों के बीच हाइड्रोजन बॉन्ड सम्मलित होते हैं। वे आसन्न जंजीरों को प्रभावी ढंग से जोड़ते हैं, जो सामग्री को सुदृढ़ करते हैं। हाइड्रोजन बॉन्ड्स अरिमिड फाइबर को भी प्रभावित करते हैं, जहां हाइड्रोजन बॉन्ड रैखिक श्रृंखलाओं को बाद में स्थिर करते हैं। चेन कुल्हाड़ियों को फाइबर अक्ष के साथ संरेखित किया जाता है, जिससे फाइबर बेहद कठोर और मजबूत हो जाते हैं।
हाइड्रोजन-बॉन्ड नेटवर्क वातावरण में नमी के स्तर के प्रति संवेदनशील दोनों प्राकृतिक और सिंथेटिक पॉलिमर बनाते हैं चूंकि पानी के अणु सतह में फैल सकते हैं और नेटवर्क को बाधित कर सकते हैं। कुछ पॉलिमर दूसरों की तुलना में अधिक संवेदनशील होते हैं। इस प्रकार नाइलॉन अरामिड से अधिक संवेदनशील होते हैं, और नायलॉन 6 नायलॉन-11 से अधिक संवेदनशील होते हैं।
सममित हाइड्रोजन बांड
एक सममित हाइड्रोजन बांड एक विशेष प्रकार का हाइड्रोजन बांड होता है जिसमें प्रोटॉन दो समान परमाणुओं के बीच बिल्कुल आधे रास्ते में होता है। उनमें से प्रत्येक परमाणु के बांड की ताकत बराबर है। यह तीन-केंद्र चार-इलेक्ट्रॉन बांड का एक उदाहरण है। इस प्रकार का बांड "सामान्य" हाइड्रोजन बांड से काफी सुदृढ़ होता है। प्रभावी बांड क्रम 0.5 है, इसलिए इसकी ताकत एक सहसंयोजक बांड के बराबर है। यह उच्च दबाव पर बर्फ में और उच्च दबाव पर हाइड्रोफ्लोरिक एसिड और फॉर्मिक एसिड जैसे कई निर्जल एसिड के ठोस चरण में भी देखा जाता है। यह बाइफ्लोराइड आयन [F···H··F]- में भी देखा जाता है। गंभीर स्टेरिक बांड के कारण, प्रोटॉन स्पंज (1,8-BIS (डाइमिथाइलैमिनो) नेफ़थलीन) के प्रोटोनेटेड रूप और इसके डेरिवेटिव में सममित हाइड्रोजन बॉन्ड ([N···H···N]+)भी होते हैं,[47] चूंकि प्रोटोनेटेड प्रोटॉन स्पंज के स्थिति में, समुच्चय से जुड़ी हुई है।[48]
डायहाइड्रोजन बांड
हाइड्रोजन बांड की समानता दृढ़तः से संबंधित डायहाइड्रोजन बांड से की जा सकती है, जो हाइड्रोजन परमाणुओं से जुड़े एक इंटरमॉलिक्यूलर बांड पारस्परिक प्रभाव भी है। इन संरचनाओं को कुछ समय के लिए जाना जाता है, और क्रिस्टलोग्राफी द्वारा अच्छी तरह से जाना जाता है;[49] चूंकि, पारंपरिक हाइड्रोजन बांड, आयनिक बांड और सहसंयोजक बांड के साथ उनके संबंधों की समझ अस्पष्ट बनी हुई है। सामान्यतः, हाइड्रोजन बॉन्ड को एक प्रोटॉन स्वीकर्ता द्वारा चित्रित किया जाता है जो कि गैर-धात्विक परमाणुओं में इलेक्ट्रॉनों की एक अकेली युग्म है। कुछ स्थिति में, ये प्रोटॉन स्वीकर्ता P-बॉन्ड या मेटल जटिल संघ हो सकते हैं। डाइहाइड्रोजन बांड में, चूंकि, एक धातु हाइड्राइड एक प्रोटॉन स्वीकर्ता के रूप में कार्य करता है, इस प्रकार हाइड्रोजन अन्तःक्रिया का निर्माण होता है। न्यूट्रॉन विवर्तन ने दिखाया है कि इन परिसरों की आणविक ज्यामिति हाइड्रोजन बांड के समान है, जिसमें बांड की लंबाई धातु परिसर/हाइड्रोजन डोनर प्रणाली के लिए बहुत अनुकूल है।[49]
औषधियों के लिए आवेदन
ड्रग डिज़ाइन के लिए हाइड्रोजन बॉन्डिंग एक प्रासंगिक है। लिपिंस्की के पाँच के नियम के अनुसार अधिकांश मौखिक रूप से सक्रिय दवाओं में पाँच से अधिक हाइड्रोजन बॉन्ड डोनर और दस से कम हाइड्रोजन बॉन्ड स्वीकार करने वाले नहीं होते हैं। ये अन्योन्य क्रियाएं नाइट्रोजन-हाइड्रोजन और ऑक्सीजन-हाइड्रोजन केंद्रों के बीच सम्मलित हैं।[50] चूंकि, कई दवाएं इन "नियमों" का पालन नहीं करती हैं।
रेफरी>o′Hagan, Steve; Swainston, Neil; Handl, Julia; Kell, Douglas B. (2015). "अनुमोदित फार्मास्युटिकल दवाओं के मेटाबोलाइट-समानता के लिए '0.5 का नियम'". Metabolomics. 11 (2): 323–339. doi:10.1007/s11306-014-0733-z. PMC 4342520. PMID 25750602.</ref>
संदर्भ
- ↑ Sweetman, A. M.; Jarvis, S. P.; Sang, Hongqian; Lekkas, I.; Rahe, P.; Wang, Yu; Wang, Jianbo; Champness, N.R.; Kantorovich, L.; Moriarty, P. (2014). "हाइड्रोजन-बंधुआ असेंबली के बल क्षेत्र का मानचित्रण". Nature Communications. 5: 3931. Bibcode:2014NatCo...5.3931S. doi:10.1038/ncomms4931. PMC 4050271. PMID 24875276.
- ↑ Hapala, Prokop; Kichin, Georgy; Wagner, Christian; Tautz, F. Stefan; Temirov, Ruslan; Jelínek, Pavel (2014-08-19). "कार्यात्मक युक्तियों के साथ उच्च-रिज़ॉल्यूशन एसटीएम/एएफएम इमेजिंग का तंत्र". Physical Review B. 90 (8): 085421. arXiv:1406.3562. Bibcode:2014PhRvB..90h5421H. doi:10.1103/PhysRevB.90.085421. S2CID 53610973.
- ↑ De Luca, S.; Chen, F.; Seal, P.; Stenzel, M. H.; Smith, S. C. (2017). "पॉलिमरिक कैरियर और प्रोटीन ड्रग के बीच बंधन और रिलीज: कूलम्ब फोर्सेज, हाइड्रोजन बॉन्डिंग, वैन डेर वाल्स इंटरेक्शन, और एंट्रॉपी के पीएच-मध्यस्थ इंटरप्ले". Biomacromolecules. 18: 3665–3677. doi:10.1021/acs.biomac.7b00657. PMID 28880549.
- ↑ Hämäläinen, Sampsa K.; van der Heijden, Nadine; van der Lit, Joost; den Hartog, Stephan; Liljeroth, Peter; Swart, Ingmar (2014-10-31). "इंटरमॉलिक्युलर बॉन्ड के बिना परमाणु बल माइक्रोस्कोपी छवियों में इंटरमॉलिक्युलर कंट्रास्ट". Physical Review Letters. 113 (18): 186102. arXiv:1410.1933. Bibcode:2014PhRvL.113r6102H. doi:10.1103/PhysRevLett.113.186102. hdl:1874/307996. PMID 25396382. S2CID 8309018. Archived from the original on 2018-01-20. Retrieved 2017-08-30.
- ↑ 5.0 5.1 5.2 Arunan, Elangannan; Desiraju, Gautam R.; Klein, Roger A.; Sadlej, Joanna; Scheiner, Steve; Alkorta, Ibon; Clary, David C.; Crabtree, Robert H.; Dannenberg, Joseph J. (2011-07-08). "हाइड्रोजन बांड की परिभाषा (आईयूपीएसी अनुशंसाएं 2011)". Pure and Applied Chemistry. 83 (8): 1637–1641. doi:10.1351/PAC-REC-10-01-02. ISSN 1365-3075. S2CID 97688573.
- ↑ Jeffrey, G. A.; An introduction to hydrogen bonding; Oxford university press New York, 1997. ISBN 0195095499
- ↑ Jeffrey, G. A.; Saenger, W. Hydrogen bonding in biological structures; Springer: Berlin, 1994, 2012 Springer; ISBN 3540579036
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "hydrogen bond". doi:10.1351/goldbook.H02899
- ↑ Steiner, Thomas (2002). "ठोस अवस्था में हाइड्रोजन बांड". Angew. Chem. Int. Ed. 41 (1): 48–76. doi:10.1002/1521-3773(20020104)41:1<48::AID-ANIE48>3.0.CO;2-U. PMID 12491444.
- ↑ Sabin, John R. (1971). "सल्फर युक्त हाइड्रोजन बांड। I. हाइड्रोजन सल्फाइड डिमर". J. Am. Chem. Soc. 93 (15): 3613–3620. doi:10.1021/ja00744a012.
- ↑ Beijer, Felix H.; Kooijman, Huub; Spek, Anthony L.; Sijbesma, Rint P.; Meijer, E. W. (1998). "चौगुनी हाइड्रोजन बॉन्डिंग के माध्यम से प्राप्त स्व-पूरकता". Angew. Chem. Int. Ed. 37 (1–2): 75–78. doi:10.1002/(SICI)1521-3773(19980202)37:1/2<75::AID-ANIE75>3.0.CO;2-R.
- ↑ Desiraju, G. R. and Steiner, T. The Weak Hydrogen Bond: In Structural Chemistry and Biology, International Union of Crystallography;2001, ISBN 0198509707
- ↑ Nishio, M.; Hirota, M.; Umezawa, Y. The CH–π Interactions; Wiley-VCH, New York, 1998. • Wiley-VCH; 1998) ISBN 0471252905
- ↑ Nishio, M (2011). "रसायन शास्त्र में सीएच/[छोटा पीआई] हाइड्रोजन बंधन। "शीर्षक". Phys. Chem. Chem. Phys. 13 (31): 13873–13900. doi:10.1039/c1cp20404a. PMID 21611676.
- ↑ Arunan, Elangannan; Desiraju, Gautam R.; Klein, Roger A.; Sadlej, Joanna; Scheiner, Steve; Alkorta, Ibon; Clary, David C.; Crabtree, Robert H.; Dannenberg, Joseph J.; Hobza, Pavel; Kjaergaard, Henrik G.; Legon, Anthony C.; Mennucci, Benedetta; Nesbitt, David J. (2011). "Definition of the hydrogen bond". Pure Appl. Chem. 83 (8): 1637–1641. doi:10.1351/PAC-REC-10-01-02. S2CID 97688573.
- ↑ Larson, J. W.; McMahon, T. B. (1984). "गैस-चरण बिहैलाइड और स्यूडोबिहैलाइड आयन। XHY- स्पीशीज़ (X, Y = F, Cl, Br, CN) में हाइड्रोजन बॉन्ड ऊर्जाओं का आयन साइक्लोट्रॉन अनुनाद निर्धारण". Inorganic Chemistry. 23 (14): 2029–2033. doi:10.1021/ic00182a010.
- ↑ Emsley, J. (1980). "बहुत मजबूत हाइड्रोजन बांड". Chemical Society Reviews. 9 (1): 91–124. doi:10.1039/cs9800900091.
- ↑ V. David, N. Grinberg, S. C. Moldoveanu in Advances in Chromatography Volume 54 (Eds.: E. Grushka, N. Grinberg), CRC Press, Boca Raton, 2018, chapter 3.
- ↑ Data obtained using molecular dynamics as detailed in the reference and should be compared to 7.9 kJ/mol for bulk water, obtained using the same calculation.Markovitch, Omer; Agmon, Noam (2007). "Structure and energetics of the hydronium hydration shells" (PDF). J. Phys. Chem. A. 111 (12): 2253–2256. Bibcode:2007JPCA..111.2253M. CiteSeerX 10.1.1.76.9448. doi:10.1021/jp068960g. PMID 17388314. Archived from the original (PDF) on 2014-08-13. Retrieved 2017-10-25.
- ↑ Biedermann F, Schneider HJ (May 2016). "सुपरमॉलेक्यूलर कॉम्प्लेक्स में प्रायोगिक बाध्यकारी ऊर्जा". Chemical Reviews. 116 (9): 5216–300. doi:10.1021/acs.chemrev.5b00583. PMID 27136957.
- ↑ Lin, Xuhui; Zhang, Huaiyu; Jiang, Xiaoyu; Wu, Wei; Mo, Yirong (2017). "रेजोनेंस-असिस्टेड हाइड्रोजन बॉन्ड सिस्टम में नॉन-एडिटिविटी की उत्पत्ति". The Journal of Physical Chemistry A. 121 (44): 8535–8541. Bibcode:2017JPCA..121.8535L. doi:10.1021/acs.jpca.7b09425. PMID 29048895.
- ↑ Legon, A. C.; Millen, D. J. (1987). "कोणीय ज्यामिति और हाइड्रोजन-बंधुआ डिमर के अन्य गुण: इलेक्ट्रॉन-जोड़ी मॉडल की सफलता की एक सरल इलेक्ट्रोस्टैटिक व्याख्या". Chemical Society Reviews. 16: 467. doi:10.1039/CS9871600467.
- ↑ Friebolin, H., "Basic One- and Two- Dimensional NMR Spectroscopy, 4th ed.," VCH: Weinheim, 2008. ISBN 978-3-527-31233-7
- ↑ Hobza P, Havlas Z (2000). "ब्लू-शिफ्टिंग हाइड्रोजन बांड". Chem. Rev. 100 (11): 4253–4264. doi:10.1021/cr990050q. PMID 11749346.
- ↑ Weinhold, Frank; Klein, Roger A. (2014). "हाइड्रोजन बांड क्या है? सुपरमॉलेक्यूलर डोमेन में अनुनाद सहसंयोजकता". Chemistry Education Research and Practice. 15 (3): 276–285. doi:10.1039/c4rp00030g.
- ↑ Sun, C. Q.; Sun, Yi (2016). पानी की विशेषता: एकल धारणा, कई मिथक. ISBN 978-981-10-0178-9.
- ↑ Grunenberg, Jörg (2004). "सैद्धांतिक अनुपालन स्थिरांक का उपयोग करते हुए वाटसन-क्रिक बेस पेयर में अंतर-अवशेष बलों का प्रत्यक्ष आकलन". Journal of the American Chemical Society. 126 (50): 16310–1. doi:10.1021/ja046282a. PMID 15600318.
- ↑ Isaacs, E.D.; et al. (1999). "बर्फ में हाइड्रोजन बांड की सहसंयोजकता: एक प्रत्यक्ष एक्स-रे मापन". Physical Review Letters. 82 (3): 600–603. Bibcode:1999PhRvL..82..600I. doi:10.1103/PhysRevLett.82.600.
- ↑ Ghanty, Tapan K.; Staroverov, Viktor N.; Koren, Patrick R.; Davidson, Ernest R. (2000-02-01). "वाटर डिमर और आइस सहसंयोजक में हाइड्रोजन बॉन्ड है?". Journal of the American Chemical Society. 122 (6): 1210–1214. doi:10.1021/ja9937019. ISSN 0002-7863.
- ↑ Cordier, F; Rogowski, M; Grzesiek, S; Bax, A (1999). "एक विकृत प्रोटीन में थ्रू-हाइड्रोजन-बॉन्ड (2h)J(HC') का अवलोकन". J Magn Reson. 140 (2): 510–2. Bibcode:1999JMagR.140..510C. doi:10.1006/jmre.1999.1899. PMID 10497060. S2CID 121429.
- ↑ Needham, Paul (2013). "हाइड्रोजन बॉन्डिंग: एक ट्रिकी केमिकल कॉन्सेप्ट पर घर आना". Studies in History and Philosophy of Science Part A. 44 (1): 51–65. Bibcode:2013SHPSA..44...51N. doi:10.1016/j.shpsa.2012.04.001.
- ↑ Pauling, L. (1960). रासायनिक बंधन की प्रकृति और अणुओं और क्रिस्टल की संरचना; आधुनिक संरचनात्मक रसायन विज्ञान का परिचय (3rd ed.). Ithaca (NY): Cornell University Press. p. 450. ISBN 978-0-8014-0333-0.
- ↑ Moore, T. S.; Winmill, T. F. (1912). "जलीय विलयन में ऐमीन की अवस्था". J. Chem. Soc. 101: 1635. doi:10.1039/CT9120101635.
- ↑ Latimer, Wendell M.; Rodebush, Worth H. (1920). "वैलेंस के लुईस सिद्धांत के दृष्टिकोण से ध्रुवीयता और आयनीकरण". Journal of the American Chemical Society. 42 (7): 1419–1433. doi:10.1021/ja01452a015.
- ↑ 35.0 35.1 Jorgensen, W. L.; Madura, J. D. (1985). "TIP4P पानी के मोंटे कार्लो सिमुलेशन के लिए तापमान और आकार पर निर्भरता". Mol. Phys. 56 (6): 1381. Bibcode:1985MolPh..56.1381J. doi:10.1080/00268978500103111.
- ↑ Zielkiewicz, Jan (2005). "पानी के संरचनात्मक गुण: पानी के SPC, SPCE, TIP4P और TIP5P मॉडल की तुलना". J. Chem. Phys. 123 (10): 104501. Bibcode:2005JChPh.123j4501Z. doi:10.1063/1.2018637. PMID 16178604.
- ↑ Jencks, William; Jencks, William P. (1986). "जलीय घोल में विलेय के बीच हाइड्रोजन बंधन". J. Am. Chem. Soc. 108 (14): 4196. doi:10.1021/ja00274a058.
- ↑ Dillon, P. F. (2012). बायोफिज़िक्स: एक शारीरिक दृष्टिकोण. Cambridge University Press. p. 37. ISBN 978-1-139-50462-1.
- ↑ Baron, Michel; Giorgi-Renault, Sylviane; Renault, Jean; Mailliet, Patrick; Carré, Daniel; Etienne, Jean (1984). "क्विनोन कार्यात्मक हेट्रोसायकल। वी। 1,2-डायमिनो एंथ्राक्विनोन के साथ ब्यूटेनडियोन की असामान्य प्रतिक्रिया; नैफ्थो की क्रिस्टल संरचना [2,3-f] क्विनोक्सालिंडियोन-7,12 प्राप्त हुई". Can. J. Chem. 62 (3): 526–530. doi:10.1139/v84-087.
- ↑ Laage, Damien; Hynes, James T. (2006). "जल पुनर्रचना के लिए एक आण्विक कूद तंत्र". Science. 311 (5762): 832–5. Bibcode:2006Sci...311..832L. doi:10.1126/science.1122154. PMID 16439623. S2CID 6707413.
- ↑ Markovitch, Omer; Agmon, Noam (2008). "थोक तरल पानी में स्वीकर्ता और दाता हाइड्रोजन-बांड का वितरण". Molecular Physics. 106 (2): 485. Bibcode:2008MolPh.106..485M. doi:10.1080/00268970701877921. S2CID 17648714.
- ↑ Shiao-Wei Kuo (2018). पॉलिमर सामग्री में हाइड्रोजन बॉन्डिंग. Wiley-VCH.
- ↑ Politi, Regina; Harries, Daniel (2010). "सुरक्षात्मक ऑस्मोलाइट्स द्वारा उत्साही रूप से संचालित पेप्टाइड स्थिरीकरण". ChemComm. 46 (35): 6449–6451. doi:10.1039/C0CC01763A. PMID 20657920.
- ↑ Gilman-Politi, Regina; Harries, Daniel (2011). "पॉलीओल ऑस्मोलाइट्स द्वारा एन्थैल्पी ड्रिवेन पेप्टाइड फोल्डिंग के आणविक तंत्र को खोलना". Journal of Chemical Theory and Computation. 7 (11): 3816–3828. doi:10.1021/ct200455n. PMID 26598272.
- ↑ Hellgren, M.; Kaiser, C.; de Haij, S.; Norberg, A.; Höög, J. O. (December 2007). "स्तनधारी सोर्बिटोल डिहाइड्रोजनेज में एक हाइड्रोजन-बंधन नेटवर्क टेट्रामेरिक अवस्था को स्थिर करता है और उत्प्रेरक शक्ति के लिए आवश्यक है". Cellular and Molecular Life Sciences. 64 (23): 3129–38. doi:10.1007/s00018-007-7318-1. PMID 17952367. S2CID 22090973.
- ↑ Fernández, A.; Rogale K.; Scott Ridgway; Scheraga H. A. (June 2004). "एचआईवी -1 प्रोटीन में पैकिंग दोषों को लपेटकर अवरोधक डिजाइन". Proceedings of the National Academy of Sciences. 101 (32): 11640–5. Bibcode:2004PNAS..10111640F. doi:10.1073/pnas.0404641101. PMC 511032. PMID 15289598.
- ↑ Khashayar Rajabimoghadam Yousef Darwish Umyeena Bashir Dylan Pitman Sidney Eichelberger Maxime A. Siegler Marcel Swart Isaac Garcia-Bosch Aerobic Oxidation of Alcohols by Copper Complexes Bearing Redox-Active Ligands with Tunable H-Bonding https://doi.org/10.1021/jacs.8b08748
- ↑ Ozeryanskii, Valery A.; Pozharskii, Alexander F.; Bieńko, Agnieszka J.; Sawka-Dobrowolska, Wanda; Sobczyk, Lucjan (2005-03-01). "[NHN]+ प्रोटोनेटेड 1,8-बीआइएस (डाइमिथाइलैमिनो)-2,7-डाइमेथोक्सीनाफ्थेलीन में हाइड्रोजन बॉन्डिंग। एक्स-रे विवर्तन, इन्फ्रारेड, और सैद्धांतिक अब इनिटियो और डीएफटी अध्ययन". The Journal of Physical Chemistry A. 109 (8): 1637–1642. Bibcode:2005JPCA..109.1637O. doi:10.1021/jp040618l. ISSN 1089-5639. PMID 16833488.
- ↑ 49.0 49.1 Crabtree, Robert H.; Siegbahn, Per E. M.; Eisenstein, Odile; Rheingold, Arnold L.; Koetzle, Thomas F. (1996). "एक नया इंटरमॉलिक्युलर इंटरेक्शन: प्रोटॉन स्वीकर्ता के रूप में एलिमेंट-हाइड्राइड बॉन्ड के साथ अपरंपरागत हाइड्रोजन बॉन्ड". Acc. Chem. Res. 29 (7): 348–354. doi:10.1021/ar950150s. PMID 19904922.
- ↑ Lipinski CA (December 2004). "लेड- और ड्रग जैसे यौगिक: पांच क्रांति का नियम". Drug Discovery Today: Technologies. 1 (4): 337–341. doi:10.1016/j.ddtec.2004.11.007. PMID 24981612.
अग्रिम पठन
- George A. Jeffrey. An Introduction to Hydrogen Bonding (Topics in Physical Chemistry). Oxford University Press, USA (March 13, 1997). ISBN 0-19-509549-9
इस पृष्ठ में अनुपलब्ध आंतरिक कड़ियों की सूची
बाहरी संबंध
- The Bubble Wall (Audio slideshow from the National High Magnetic Field Laboratory explaining cohesion, surface tension and hydrogen bonds)
- isotopic effect on bond dynamics