केटालेज़: Difference between revisions
No edit summary |
No edit summary |
||
| (11 intermediate revisions by 3 users not shown) | |||
| Line 27: | Line 27: | ||
| caption = | | caption = | ||
}} | }} | ||
कैटालेस एक सामान्य [[एंजाइम]] है जो लगभग सभी जीवित जीवों में पाया जाता है जो [[ऑक्सीजन]] (जैसे [[ जीवाणु ]], पौधों और जानवरों) के संपर्क में आते हैं जो [[Index.php?title=जल|जल]] और ऑक्सीजन के लिए [[हाइड्रोजन पेरोक्साइड]] के अपघटन को उत्प्रेरित करते हैं।<ref name="pmid14745498">{{cite journal | vauthors = Chelikani P, Fita I, Loewen PC | title = उत्प्रेरकों के बीच संरचनाओं और गुणों की विविधता| journal = Cellular and Molecular Life Sciences | volume = 61 | issue = 2 | pages = 192–208 | date = January 2004 | pmid = 14745498 | doi = 10.1007/s00018-003-3206-5 | hdl-access = free | s2cid = 4411482 | hdl = 10261/111097 }}</ref> [[Index.php?title=अभिक्रियाशील ऑक्सीजन प्रजातियों|अभिक्रियाशील ऑक्सीजन प्रजातियों]] (ROS) द्वारा कोशिका को [[ऑक्सीडेटिव तनाव]] से बचाने में यह एक बहुत ही महत्वपूर्ण एंजाइम है। कैटालेस में सभी एंजाइमों की उच्चतम आवर्त संख्या है; एक कैटालेज अणु लाखों हाइड्रोजन पेरोक्साइड अणुओं को प्रति सेकंड | कैटालेस एक सामान्य [[एंजाइम]] है जो लगभग सभी जीवित जीवों में पाया जाता है जो [[ऑक्सीजन]] (जैसे [[ जीवाणु ]], पौधों और जानवरों) के संपर्क में आते हैं जो [[Index.php?title=जल|जल]] और ऑक्सीजन के लिए [[हाइड्रोजन पेरोक्साइड]] के अपघटन को उत्प्रेरित करते हैं।<ref name="pmid14745498">{{cite journal | vauthors = Chelikani P, Fita I, Loewen PC | title = उत्प्रेरकों के बीच संरचनाओं और गुणों की विविधता| journal = Cellular and Molecular Life Sciences | volume = 61 | issue = 2 | pages = 192–208 | date = January 2004 | pmid = 14745498 | doi = 10.1007/s00018-003-3206-5 | hdl-access = free | s2cid = 4411482 | hdl = 10261/111097 }}</ref> [[Index.php?title=अभिक्रियाशील ऑक्सीजन प्रजातियों|अभिक्रियाशील ऑक्सीजन प्रजातियों]] (ROS) द्वारा कोशिका को [[ऑक्सीडेटिव तनाव]] से बचाने में यह एक बहुत ही महत्वपूर्ण एंजाइम है। कैटालेस में सभी एंजाइमों की उच्चतम आवर्त संख्या है; एक कैटालेज अणु लाखों हाइड्रोजन पेरोक्साइड अणुओं को प्रति सेकंड जल और ऑक्सीजन में परिवर्तित कर सकता है।<ref>{{cite web | title = केटालेज़| author = Goodsell DS | work = Molecule of the Month | publisher = RCSB Protein Data Bank | url = http://pdb101.rcsb.org/motm/57 | date = 2004-09-01 | access-date = 2016-08-23}}</ref> | ||
कैटालेस चार पॉलीपेप्टाइड श्रृंखलाओं का एक [[टेट्रामेरिक प्रोटीन]] है, प्रत्येक में 500 से अधिक [[Index.php?title=एमिनो अम्ल|एमिनो अम्ल]] होते हैं।<ref name="Boon_a"><nowiki>{{cite web |vauthors=Boon EM, Downs A, Marcey D |title = कैटालेज़: एच<उप>2</उप>ओ<उप>2</उप>: एच<उप>2</उप>ओ<उप>2</उप> ऑक्सीडोरडक्टेस| work = Catalase Structural Tutorial Text | url = </nowiki>http://biology.kenyon.edu/BMB/Chime/catalase/frames/cattx.htm | access-date = 2007-02-11}</ref> इसमें चार आयरन युक्त हीम समूह होते हैं जो एंजाइम को हाइड्रोजन पेरोक्साइड के साथ अभिक्रिया करने की अनुमति देते हैं। मानव उत्प्रेरक के लिए इष्टतम [[पीएच]] लगभग 7 है,<ref name="Maehly_1954"><nowiki>{{cite book | vauthors = Maehly AC, Chance B | chapter = The assay of catalases and peroxidases | volume = 1 | pages = 357–424 | year = 1954 | pmid = 13193536 | doi = 10.1002/9780470110171.ch14 | isbn = 978-0-470-11017-1 | series = जैव रासायनिक विश्लेषण के तरीके| title = जैव रासायनिक विश्लेषण के तरीके}</रेफ> और काफी व्यापक अधिकतम है: प्रतिक्रिया की दर पीएच 6.8 और 7.5 के बीच उल्लेखनीय रूप से नहीं बदलती है। रेफरी नाम= pmid6727660 >{{cite book | vauthors = Aebi H | title = इन विट्रो में कैटालेस| volume = 105 | pages = </nowiki>[https://archive.org/details/oxygenradicalsin0000unse/page/121 121–6] | year = 1984 | pmid = 6727660 | doi = 10.1016/S0076-6879(84)05016-3 | isbn = 978-0-12-182005-3 | series = Methods in Enzymology | url = https://archive.org/details/oxygenradicalsin0000unse/page/121 }</ref> : अभिक्रिया की दर पीएच 6.8 और 7.5 के बीच पर्याप्त रूप से नहीं बदलती है।प्रजातियों के आधार पर अन्य उत्प्रेरकों के लिए पीएच इष्टतम 4 और 11 के बीच भिन्न होता है।इष्टतम तापमान भी प्रजातियों द्वारा भिन्न होता है | कैटालेस चार पॉलीपेप्टाइड श्रृंखलाओं का एक [[टेट्रामेरिक प्रोटीन]] है, प्रत्येक में 500 से अधिक [[Index.php?title=एमिनो अम्ल|एमिनो अम्ल]] होते हैं।<ref name="Boon_a"><nowiki>{{cite web |vauthors=Boon EM, Downs A, Marcey D |title = कैटालेज़: एच<उप>2</उप>ओ<उप>2</उप>: एच<उप>2</उप>ओ<उप>2</उप> ऑक्सीडोरडक्टेस| work = Catalase Structural Tutorial Text | url = </nowiki>http://biology.kenyon.edu/BMB/Chime/catalase/frames/cattx.htm | access-date = 2007-02-11}</ref> इसमें चार आयरन युक्त हीम समूह होते हैं जो एंजाइम को हाइड्रोजन पेरोक्साइड के साथ अभिक्रिया करने की अनुमति देते हैं। मानव उत्प्रेरक के लिए इष्टतम [[पीएच]] लगभग 7 है,<ref name="Maehly_1954"><nowiki>{{cite book | vauthors = Maehly AC, Chance B | chapter = The assay of catalases and peroxidases | volume = 1 | pages = 357–424 | year = 1954 | pmid = 13193536 | doi = 10.1002/9780470110171.ch14 | isbn = 978-0-470-11017-1 | series = जैव रासायनिक विश्लेषण के तरीके| title = जैव रासायनिक विश्लेषण के तरीके}</रेफ> और काफी व्यापक अधिकतम है: प्रतिक्रिया की दर पीएच 6.8 और 7.5 के बीच उल्लेखनीय रूप से नहीं बदलती है। रेफरी नाम= pmid6727660 >{{cite book | vauthors = Aebi H | title = इन विट्रो में कैटालेस| volume = 105 | pages = </nowiki>[https://archive.org/details/oxygenradicalsin0000unse/page/121 121–6] | year = 1984 | pmid = 6727660 | doi = 10.1016/S0076-6879(84)05016-3 | isbn = 978-0-12-182005-3 | series = Methods in Enzymology | url = https://archive.org/details/oxygenradicalsin0000unse/page/121 }</ref> : अभिक्रिया की दर पीएच 6.8 और 7.5 के बीच पर्याप्त रूप से नहीं बदलती है।प्रजातियों के आधार पर अन्य उत्प्रेरकों के लिए पीएच इष्टतम 4 और 11 के बीच भिन्न होता है।इष्टतम तापमान भी प्रजातियों द्वारा भिन्न होता है | ||
| Line 47: | Line 47: | ||
:: H<sub>2</sub>O<sub>2</sub> + O=Fe(IV)-E(.+) → H<sub>2</sub>O + Fe(III)-E + O<sub>2</sub><ref name="Boon_b">{{cite web |vauthors=Boon EM, Downs A, Marcey D | title = कैटालेस का प्रस्तावित तंत्र| work = Catalase: H<sub>2</sub>O<sub>2</sub>: H<sub>2</sub>O<sub>2</sub> Oxidoreductase: Catalase Structural Tutorial | url = http://biology.kenyon.edu/BMB/Chime/catalase/frames/cattx.htm#Proposed%20Mechanism%20of%20Catalase | access-date = 2007-02-11}}</ref> | :: H<sub>2</sub>O<sub>2</sub> + O=Fe(IV)-E(.+) → H<sub>2</sub>O + Fe(III)-E + O<sub>2</sub><ref name="Boon_b">{{cite web |vauthors=Boon EM, Downs A, Marcey D | title = कैटालेस का प्रस्तावित तंत्र| work = Catalase: H<sub>2</sub>O<sub>2</sub>: H<sub>2</sub>O<sub>2</sub> Oxidoreductase: Catalase Structural Tutorial | url = http://biology.kenyon.edu/BMB/Chime/catalase/frames/cattx.htm#Proposed%20Mechanism%20of%20Catalase | access-date = 2007-02-11}}</ref> | ||
यहाँ Fe()-E एंजाइम से जुड़े हीम समूह के लौह केंद्र का प्रतिनिधित्व करता है। Fe(IV)-E(.+) Fe(V)-E का एक मेसोमेरिक रूप है, जिसका अर्थ है कि आयरन पूरी तरह से +V में ऑक्सीकृत नहीं होता है, लेकिन हेम लिगैंड से कुछ स्थिर इलेक्ट्रॉन घनत्व प्राप्त करता है, जिसे बाद में एक के रूप में दिखाया जाता है। | यहाँ Fe()-E एंजाइम से जुड़े हीम समूह के लौह केंद्र का प्रतिनिधित्व करता है। Fe(IV)-E(.+) , Fe(V)-E का एक मेसोमेरिक रूप है, जिसका अर्थ है कि आयरन पूरी तरह से +V में ऑक्सीकृत नहीं होता है, लेकिन हेम लिगैंड से कुछ स्थिर इलेक्ट्रॉन घनत्व प्राप्त करता है, जिसे बाद में एक रैडिकल धनायन (.+) के रूप में दिखाया जाता है। | ||
जैसे ही हाइड्रोजन पेरोक्साइड [[सक्रिय साइट]] में प्रवेश करता है, यह अमीनो अम्ल Asn148 (148 स्थिति पर [[Index.php?title=एस्पेराजीन|एस्पेराजीन]]) और His75 के साथ संपर्क नहीं करता है, जिससे एक [[प्रोटॉन]] (हाइड्रोजन [[आयन]]) ऑक्सीजन परमाणुओं के बीच स्थानांतरित हो जाता है। मुक्त ऑक्सीजन परमाणु समन्वय करता है, नवगठित जल के अणु और Fe(IV)=O को मुक्त करता है। Fe(IV)=O Fe(III)-E में सुधार करने के लिए दूसरे हाइड्रोजन पेरोक्साइड अणु के साथ अभिक्रिया करता है और जल और ऑक्सीजन का उत्पादन करता है।<ref name="Boon_b" />पांचवें समन्वय की स्थिति में [[ टायरोसिन | टायरोसिन]] के फेनोलेट [[लिगेंड]] की उपस्थिति से लौह केंद्र की अभिक्रियाशीलता में सुधार किया जा सकता है, जो Fe (III) से Fe (IV) के [[ऑक्सीकरण]] में सहायता कर सकता है। [[प्रतिक्रिया मध्यवर्ती|अभिक्रिया मध्यवर्ती]] के साथ His75 और Asn148 की पारस्परिक क्रिया से अभिक्रिया की दक्षता में भी सुधार हो सकता है।<ref name="Boon_b" /> उत्प्रेरक द्वारा हाइड्रोजन पेरोक्साइड का अपघटन प्रथम-क्रम गतिकी के अनुसार आगे बढ़ता है, दर हाइड्रोजन पेरोक्साइड सान्द्रता के समानुपाती होती है।<ref>{{cite journal | vauthors = Aebi H | title = इन विट्रो में कैटालेस| journal = Methods in Enzymology | volume = 105 | pages = 121–126 | date = 1984 | pmid = 6727660 | doi = 10.1016/S0076-6879(84)05016-3 }}</ref> | |||
कैटालेज़ विभिन्न मेटाबोलाइट्स और विषाक्त पदार्थों के हाइड्रोजन पेरोक्साइड द्वारा | कैटालेज़ विभिन्न मेटाबोलाइट्स और विषाक्त पदार्थों के हाइड्रोजन पेरोक्साइड द्वारा ऑक्सीकरण को भी उत्प्रेरित कर सकता है, जिसमें [[Index.php?title=फॉर्मोल्डिहाइड|फॉर्मोल्डिहाइड]], [[Index.php?title=फॉर्मिक अम्ल|फॉर्मिक अम्ल]] , [[फिनोल]], [[एसीटैल्डिहाइड]] और [[अल्कोहल]] सम्मिलित हैं। यह निम्नलिखित अभिक्रिया के अनुसार ऐसा करता है: | ||
H<sub>2</sub>O<sub>2</sub> + H<sub>2</sub>R → 2H<sub>2</sub>O + R | |||
इस | इस अभिक्रिया का सटीक तंत्र ज्ञात नहीं है। | ||
कोई भी भारी धातु आयन (जैसे कि कॉपर (II) सल्फेट में कॉपर | कोई भी भारी धातु आयन (जैसे कि कॉपर (II) सल्फेट में कॉपर धनायन) कैटालेज के [[गैर-प्रतिस्पर्धी अवरोधक]] के रूप में कार्य कर सकता है। तथापि, तांबे की कमी से हृदय और यकृत जैसे ऊतकों में उत्प्रेरित गतिविधि में कमी आ सकती है।<ref>{{cite journal | vauthors = Hordyjewska A, Popiołek Ł, Kocot J | title = चिकित्सा और उपचार में तांबे के कई "चेहरे"| journal = Biometals | volume = 27 | issue = 4 | pages = 611–621 | date = August 2014 | pmid = 24748564 | pmc = 4113679 | doi = 10.1007/s10534-014-9736-5 }}</ref> इसके अतिरिक्त, ज़हर [[साइनाइड]] हाइड्रोजन पेरोक्साइड की उच्च सांद्रता पर कैटालेज़ का एक गैर-प्रतिस्पर्धी अवरोधक है<ref>Nonstationary Inhibition of Enzyme Action. The Cyanide Inhibition of Catalase</ref> <ref>{{cite journal | vauthors = Ogura Y, Yamazaki I | title = साइनाइड की उपस्थिति में उत्प्रेरित प्रतिक्रिया की स्थिर-अवस्था कैनेटीक्स| journal = Journal of Biochemistry | volume = 94 | issue = 2 | pages = 403–408 | date = August 1983 | pmid = 6630165 | doi = 10.1093/oxfordjournals.jbchem.a134369 }}</ref> | ||
[[आर्सेनेट]] एक [[एंजाइम उत्प्रेरक]] के रूप में कार्य करता है।<ref>{{cite journal | vauthors = Kertulis-Tartar GM, Rathinasabapathi B, Ma LQ | title = ग्लूटाथियोन रिडक्टेस की विशेषता और आर्सेनिक के संपर्क में आने पर दो टेरिस फ़र्न के मोर्चों में उत्प्रेरित| journal = Plant Physiology and Biochemistry | volume = 47 | issue = 10 | pages = 960–965 | date = October 2009 | pmid = 19574057 | doi = 10.1016/j.plaphy.2009.05.009 }}</ref> पेरोक्सीडेटेड कैटालेज | |||
[[आर्सेनेट]] एक [[एंजाइम उत्प्रेरक]] के रूप में कार्य करता है।<ref>{{cite journal | vauthors = Kertulis-Tartar GM, Rathinasabapathi B, Ma LQ | title = ग्लूटाथियोन रिडक्टेस की विशेषता और आर्सेनिक के संपर्क में आने पर दो टेरिस फ़र्न के मोर्चों में उत्प्रेरित| journal = Plant Physiology and Biochemistry | volume = 47 | issue = 10 | pages = 960–965 | date = October 2009 | pmid = 19574057 | doi = 10.1016/j.plaphy.2009.05.009 }}</ref> पेरोक्सीडेटेड कैटालेज मध्यवर्ती की त्रि-आयामी [[प्रोटीन संरचना]]एं [[प्रोटीन डाटा बैंक]] में उपलब्ध हैं। | |||
=== सेलुलर भूमिका === | === सेलुलर भूमिका === | ||
हाइड्रोजन पेरोक्साइड कई सामान्य चयापचय प्रक्रियाओं का एक हानिकारक उपोत्पाद है; कोशिकाओं और ऊतकों को नुकसान से बचाने के लिए, इसे जल्दी से अन्य कम खतरनाक पदार्थों में परिवर्तित किया जाना चाहिए। यह अंत करने के लिए, कम | हाइड्रोजन पेरोक्साइड कई सामान्य चयापचय प्रक्रियाओं का एक हानिकारक उपोत्पाद है; कोशिकाओं और ऊतकों को नुकसान से बचाने के लिए, इसे जल्दी से अन्य कम खतरनाक पदार्थों में परिवर्तित किया जाना चाहिए। यह अंत करने के लिए, कम अभिक्रियाशील [[Index.php?title=गैसीय|गैसीय]] ऑक्सीजन और जल के अणुओं में हाइड्रोजन पेरोक्साइड के [[रासायनिक अपघटन]] को तेजी से उत्प्रेरित करने के लिए कोशिकाओं द्वारा प्राय: कैटालेज का उपयोग किया जाता है।<ref name=Gaetani_1996>{{cite journal | vauthors = Gaetani GF, Ferraris AM, Rolfo M, Mangerini R, Arena S, Kirkman HN | title = मानव एरिथ्रोसाइट्स के भीतर हाइड्रोजन पेरोक्साइड के निपटान में उत्प्रेरक की प्रमुख भूमिका| journal = Blood | volume = 87 | issue = 4 | pages = 1595–1599 | date = February 1996 | pmid = 8608252 | doi = 10.1182/blood.V87.4.1595.bloodjournal8741595 | doi-access = free }}</ref> | ||
चूहे आनुवंशिक रूप से उत्प्रेरक की कमी के लिए | चूहे आनुवंशिक रूप से उत्प्रेरक की कमी के लिए अभियंत्रित बनाते हैं, जो शुरू में फेनोटाइपिक रूप से सामान्य होते हैं। यद्यपि, चूहों में कैटालेज की कमी से मोटापा, वसीय यकृत और टाइप 2 मधुमेह होने की संभावना बढ़ सकती है। कुछ मनुष्यों में कैटालेज़ (एकेटेलसिया) का स्तर बहुत कम होता है, फिर भी कुछ दुष्प्रभाव करते हैं। | ||
बढ़े हुए ऑक्सीडेटिव तनाव | चूहों मेंआयुबढ़ने के साथ होने वाले बढ़े हुए ऑक्सीडेटिव तनाव को उत्प्रेरित की अधिक अभिव्यक्ति से कम किया जाता है। .<ref name="pmid27575890">{{cite journal | vauthors = Selvaratnam J, Robaire B | title = Overexpression of catalase in mice reduces age-related oxidative stress and maintains sperm production | journal = Experimental Gerontology | volume = 84 | pages = 12–20 | date = November 2016 | pmid = 27575890 | doi = 10.1016/j.exger.2016.08.012 | s2cid = 2416413 }}</ref> अति-व्यक्त करने वाले चूहे [[जंगली प्रकार]] के चूहों में देखे जाने वाले [[शुक्राणु]]जन, अंडकोष रोगाणु कोशिका और [[सर्टोली कोशिका]]ओं कीआयु से संबंधित हानि को प्रदर्शित नहीं करते हैं। जंगली प्रकार के चूहों में ऑक्सीडेटिव तनाव सामान्य रूप से आयु बढ़ने के साथ शुक्राणु में ऑक्सीडेटिव [[Index.php?title=डीएनए क्षति|डीएनए क्षति]] ( 8-ऑक्सोडजी के रूप में मापा जाता है) को प्रेरित करता है, लेकिन इन नुकसानों को वृद्ध उत्प्रेरित अति-व्यक्त करने वाले चूहों में काफी कम किया जाता है। .<ref name="pmid27575890" /> इसके अतिरिक्त, ये अति-व्यक्त करने वाले चूहे प्रति एक साथ पैदा हुए बच्चों की आयु-निर्भर संख्या में कोई कमी नहीं दिखाते हैं। माइटोकॉन्ड्रिया को लक्षित उत्प्रेरित की अधिकता चूहों के जीवनकाल का विस्तार करती है।<ref name="pmid15879174">{{cite journal | vauthors = Schriner SE, Linford NJ, Martin GM, Treuting P, Ogburn CE, Emond M, Coskun PE, Ladiges W, Wolf N, Van Remmen H, Wallace DC, Rabinovitch PS | display-authors = 6 | title = माइटोकॉन्ड्रिया को लक्षित कैटालेज के अतिअभिव्यक्ति द्वारा मरीन जीवन काल का विस्तार| journal = Science | volume = 308 | issue = 5730 | pages = 1909–1911 | date = June 2005 | pmid = 15879174 | doi = 10.1126/science.1106653 | s2cid = 38568666 | bibcode = 2005Sci...308.1909S }}</ref> | ||
[[यूकेरियोट]] में, उत्प्रेरक सामान्यतः एक सेलुलर [[Index.php?title=कोशिकांग|कोशिकांग]] में स्थित होता है जिसे [[पेरोक्सीसोम]] कहा जाता है।<ref name="MBOC">{{cite book |vauthors=Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P | title = कोशिका का आणविक जीवविज्ञान| edition = 4th | publisher = Garland Science | location = New York | year = 2002 | chapter = Peroxisomes | chapter-url = https://www.ncbi.nlm.nih.gov/books/NBK26858/ | isbn = 978-0-8153-3218-3 }}</ref> पादप कोशिकाओं में पेरोक्सीसोम प्रकाश श्वसन (ऑक्सीजन का उपयोग और कार्बन डाइऑक्साइड का उत्पादन) और सहजीवी [[नाइट्रोजन]] स्थिरीकरण (अभिक्रियाशील नाइट्रोजन परमाणुओं के लिए द्विपरमाण्विक नाइट्रोजन (N<sub>2</sub>) को तोड़ना)। हाइड्रोजन पेरोक्साइड का उपयोग एक शक्तिशाली रोगाणुरोधी एजेंट के रूप में किया जाता है जब कोशिकाएं एक रोगज़नक़ से संक्रमित होती हैं। [[माइकोबैक्टेरियम ट्यूबरक्यूलोसिस]], [[लेगियोनेला न्यूमोफिला]] और [[कैंपाइलोबैक्टर जेजुनी]] जैसे कैटालेज-सकारात्मक रोगजनक पेरोक्साइड रेडिकल्स को निष्क्रिय करने के लिए कैटालेज बनाते हैं, इस प्रकार उन्हें [[Index.php?title=मेजबान|मेजबान]] के भीतर अहानिकर रुप से जीवित रहने की अनुमति मिलती है।<ref name="pmid12949187">{{cite journal | vauthors = Srinivasa Rao PS, Yamada Y, Leung KY | title = A major catalase (KatB) that is required for resistance to H2O2 and phagocyte-mediated killing in Edwardsiella tarda | journal = Microbiology | volume = 149 | issue = Pt 9 | pages = 2635–2644 | date = September 2003 | pmid = 12949187 | doi = 10.1099/mic.0.26478-0 }}</ref> | |||
[[शराब डिहाइड्रोजनेज]] की तरह, कैटालेज़ इथेनॉल को एसीटैल्डिहाइड में परिवर्तित करता है, लेकिन यह संभावना नहीं है कि यह अभिक्रिया शारीरिक रूप से महत्वपूर्ण है।<ref name="lieb97">{{cite journal | vauthors = Lieber CS | title = इथेनॉल चयापचय, सिरोसिस और शराब| journal = Clinica Chimica Acta; International Journal of Clinical Chemistry | volume = 257 | issue = 1 | pages = 59–84 | date = January 1997 | pmid = 9028626 | doi = 10.1016/S0009-8981(96)06434-0 }}</ref> | |||
== जीवों के बीच वितरण == | == जीवों के बीच वितरण == | ||
स्तनधारियों में [[जिगर]] में होने वाली विशेष रूप से उच्च सांद्रता के साथ, अधिकांश ज्ञात जीव हर [[अंग | स्तनधारियों में [[जिगर]] में होने वाली विशेष रूप से उच्च सांद्रता के साथ, अधिकांश ज्ञात जीव हर [[Index.php?title=अंग|अंग]] में कैटालेज का उपयोग करते हैं।<ref>{{cite journal| vauthors = Ilyukha VA | journal=Journal of Evolutionary Biochemistry and Physiology | title = विभिन्न इकोजेनेसिस के स्तनधारियों के अंगों में सुपरऑक्साइड डिसम्यूटेस और कैटालेज़|date=2001|volume=37|issue=3|pages=241–245|doi=10.1023/A:1012663105999| s2cid=38916410 }}</ref> कैटालेस मुख्य रूप से पेरोक्सीसोम और [[एरिथ्रोसाइट]] के [[साइटोसोल]] (और कभी-कभी [[माइटोकॉन्ड्रिया]] में) में पाया जाता है<ref name="pmid11351128">{{cite journal | vauthors = Bai J, Cederbaum AI | title = माइटोकॉन्ड्रियल कैटालेज और ऑक्सीडेटिव चोट| journal = Biological Signals and Receptors | volume = 10 | issue = 3–4 | pages = 189–199 | year = 2001 | pmid = 11351128 | doi = 10.1159/000046887 | s2cid = 33795198 }}</ref> | ||
लगभग सभी [[एरोबिक सूक्ष्मजीव]] कैटलस का उपयोग करते हैं। यह कुछ [[अवायवीय जीव]] [[सूक्ष्मजीवों]] में भी | लगभग सभी [[एरोबिक सूक्ष्मजीव]] कैटलस का उपयोग करते हैं। यह कुछ [[अवायवीय जीव]] [[सूक्ष्मजीवों]] में भी उपस्थित है, जैसे कि [[मेथानोसारसीना बरकेरी]]।<ref name="pmid16735730">{{cite journal | vauthors = Brioukhanov AL, Netrusov AI, Eggen RI | title = कैटालेज और सुपरऑक्साइड डिसम्यूटेज जीन कड़ाई से अवायवीय पुरातन मेथनोसारसीना बारकेरी में ऑक्सीडेटिव तनाव पर ट्रांसक्रिप्शनल रूप से अप-विनियमित होते हैं।| journal = Microbiology | volume = 152 | issue = Pt 6 | pages = 1671–1677 | date = June 2006 | pmid = 16735730 | doi = 10.1099/mic.0.28542-0 | doi-access = free }}</ref> कैटालेस भी पौधों के बीच सार्वभौमिक है और अधिकांश [[कवक]] में होता है।<ref>{{cite journal | vauthors = Hansberg W, Salas-Lizana R, Domínguez L | title = Fungal catalases: function, phylogenetic origin and structure | journal = Archives of Biochemistry and Biophysics | volume = 525 | issue = 2 | pages = 170–180 | date = September 2012 | pmid = 22698962 | doi = 10.1016/j.abb.2012.05.014 }}</ref> | ||
[[ | [[Index.php?title= प्रक्षेपी भृंग|प्रक्षेपी भृंग]] में उत्प्रेरित का एक अनूठा उपयोग होता है। इस भृंग में तरल के दो सेट होते हैं जो दो युग्मित ग्रंथियों में अलग-अलग जमा होते हैं। जोड़ी के बड़े, भंडारण कक्ष या संग्रह में [[Index.php?title= हाड्रोक्विनोन|उदकुनैन]] और हाइड्रोजन [[पेरोक्सीडेज]] होते हैं, जबकि छोटे, अभिक्रिया कक्ष में उत्प्रेरक और पेरोक्साइड होते हैं। हानिकारक स्प्रे को सक्रिय करने के लिए, भृंग दो डिब्बों की सामग्री को मिला देता है, जिससे हाइड्रोजन पेरोक्साइड से ऑक्सीजन मुक्त हो जाती है। ऑक्सीजन हाइड्रोक्विनोन का ऑक्सीकरण करता है और प्रणोदक के रूप में भी कार्य करता है।<ref name="pmid10449758">{{cite journal | vauthors = Eisner T, Aneshansley DJ | title = Spray aiming in the bombardier beetle: photographic evidence | journal = Proceedings of the National Academy of Sciences of the United States of America | volume = 96 | issue = 17 | pages = 9705–9709 | date = August 1999 | pmid = 10449758 | pmc = 22274 | doi = 10.1073/pnas.96.17.9705 | bibcode = 1999PNAS...96.9705E | doi-access = free }}</ref> ऑक्सीकरण अभिक्रियाबहुत [[Index.php?title=ऊष्माक्षेपी:|ऊष्माक्षेपी]] (ΔH = -202.8 kJ/mol) है और तेजी से मिश्रण को क्वथनांक तक गर्म करती है।<ref name="Beheshti_2006">{{cite journal|vauthors=Beheshti N, McIntosh AC|year=2006|title=बॉम्बार्डियर बीटल के विस्फोटक डिस्चार्ज का बायोमिमेटिक अध्ययन|url=http://www.heveliusforum.org/Artykuly/Biomimetics.pdf|url-status=dead|journal=Int. Journal of Design & Nature|volume=1|issue=1|pages=1–9|archive-url=https://web.archive.org/web/20110726145856/http://www.heveliusforum.org/Artykuly/Biomimetics.pdf|archive-date=2011-07-26}}</ref> | ||
लंबे समय तक रहने वाली [[दीमक]] की रानियों [[Index.php?title=रेटिकुलिटर्मस स्पेरेटस|रेटिकुलिटर्मस स्पेरेटस]] में गैर-प्रजनन विशिष्ट (श्रमिकों और सैनिकों) की तुलना में काफी कम [[डीएनए ऑक्सीकरण]] होता है।रानियों में श्रमिकों की तुलना में दो गुना अधिक कैटालेज गतिविधि और कैटालेज जीन RsCAT1 की अभिव्यक्ति का स्तर सात गुना अधिक है।<ref name="pmid28076409">{{cite journal | vauthors = Tasaki E, Kobayashi K, Matsuura K, Iuchi Y | title = An Efficient Antioxidant System in a Long-Lived Termite Queen | journal = PLOS ONE | volume = 12 | issue = 1 | pages = e0167412 | date = 2017 | pmid = 28076409 | pmc = 5226355 | doi = 10.1371/journal.pone.0167412 | doi-access = free | bibcode = 2017PLoSO..1267412T }}</ref> <ref name="pmid28076409" /> ऐसा प्रतीत होता है कि दीमक रानियों की कुशल [[एंटीऑक्सिडेंट]] क्षमता आंशिक रूप से यह बता सकती है कि वे कैसे लंबा जीवन प्राप्त करती हैं। | |||
विभिन्न प्रजातियों के कैटालेस एंजाइमों में इष्टतम तापमान काफी भिन्न होता है। [[बहुतापी]] जानवरों में सामान्यतः 15-25 डिग्री सेल्सियस की सीमा में इष्टतम तापमान के साथ उत्प्रेरक होते हैं, जबकि स्तनधारी या एवियन उत्प्रेरकों का इष्टतम तापमान 35 डिग्री सेल्सियस से ऊपर हो सकता है,<ref name="mits56" /><ref name="imm03">{{cite journal| vauthors = Çetinus ŞA, Öztop HN |title=रासायनिक रूप से क्रॉसलिंक्ड चिटोसन मोतियों में उत्प्रेरित का स्थिरीकरण|journal=Enzyme and Microbial Technology|date=June 2003|volume=32|issue=7|pages=889–894|doi=10.1016/S0141-0229(03)00065-6}}</ref> और पौधों से उत्प्रेरक उनके विकास की आदत के आधार पर भिन्न होते हैं।<ref name="mits56">{{cite journal| vauthors = Mitsuda H |title=कैटालसे पर अध्ययन|journal=Bulletin of the Institute for Chemical Research, Kyoto University|date=1956-07-31|volume=34|issue=4|pages=165–192|url=https://repository.kulib.kyoto-u.ac.jp/dspace/bitstream/2433/75561/1/chd034_4_165.pdf |archive-url=https://ghostarchive.org/archive/20221009/https://repository.kulib.kyoto-u.ac.jp/dspace/bitstream/2433/75561/1/chd034_4_165.pdf |archive-date=2022-10-09 |url-status=live|access-date=27 September 2017}}</ref> इसके विपरीत, [[Index.php?title=हाइपरथर्मोफाइल|हाइपरथर्मोफाइल]] [[Index.php?title=आद्यकल्प|आद्यकल्प]] [[Index.php?title=पाइरोबाकुलम कैलिडिफोंटिस|पाइरोबाकुलम कैलिडिफोंटिस]] से अलग किए गए कैटालेज का तापमान इष्टतम 90 °C होता है।<ref name="pmid12029047">{{cite journal | vauthors = Amo T, Atomi H, Imanaka T | title = हाइपरथर्मोफिलिक आर्कियन, पायरोबाकुलम कैलिडिफोंटिस VA1 में मैंगनीज कैटालेज की अद्वितीय उपस्थिति| journal = Journal of Bacteriology | volume = 184 | issue = 12 | pages = 3305–3312 | date = June 2002 | pmid = 12029047 | pmc = 135111 | doi = 10.1128/JB.184.12.3305-3312.2002 }}</ref> | |||
== | == रोगलक्षण महत्व और अनुप्रयोग == | ||
[[Image:Wasserstoffperoxid.svg|left|thumb|हाइड्रोजन पेरोक्साइड]][[पनीर]] उत्पादन से पहले [[दूध]] से हाइड्रोजन पेरोक्साइड को हटाने के लिए कैटलस का उपयोग खाद्य उद्योग में किया जाता है।<ref name="urlकेटालेज़- Worthington Enzyme Manual">{{cite web | url = http://www.worthington-biochem.com/CTL/default.html | title = केटालेज़| work = Worthington Enzyme Manual | publisher = Worthington Biochemical Corporation | access-date = 2009-03-01}}</ref> एक और उपयोग खाद्य | [[Image:Wasserstoffperoxid.svg|left|thumb|हाइड्रोजन पेरोक्साइड]][[पनीर]] उत्पादन से पहले [[दूध]] से हाइड्रोजन पेरोक्साइड को हटाने के लिए कैटलस का उपयोग खाद्य उद्योग में किया जाता है।<ref name="urlकेटालेज़- Worthington Enzyme Manual">{{cite web | url = http://www.worthington-biochem.com/CTL/default.html | title = केटालेज़| work = Worthington Enzyme Manual | publisher = Worthington Biochemical Corporation | access-date = 2009-03-01}}</ref> एक और उपयोग खाद्य लपेटने का कागज में होता है, जहां यह भोजन को ऑक्सीकरण से रोकता है।<ref name= urlRe: उद्योग में कैटालेस का उपयोग कैसे किया जाता है? >{{cite web | url = http://madsci.org/posts/archives/mar99/921636249.Gb.r.html | title = पुन: उद्योग में कैटलस का उपयोग कैसे किया जाता है?| author = Hengge A | date = 1999-03-16 | work = General Biology | publisher = MadSci Network | access-date = 2009-03-01}</ref> [[कपड़ा]] उद्योग में कैटालेज का भी उपयोग किया जाता है, यह सुनिश्चित करने के लिए कि सामग्री पेरोक्साइड मुक्त है, कपड़ों से हाइड्रोजन पेरोक्साइड को हटा दिया जाता है। | ||
[[संपर्क लेंस]] स्वच्छता में एक अल्प उपयोग है - कुछ लेंस-सफाई उत्पाद हाइड्रोजन पेरोक्साइड समाधान का उपयोग करके लेंस को कीटाणुरहित करते हैं; इसके बाद लेंस को फिर से उपयोग करने से पहले कैटालेज युक्त घोल का उपयोग हाइड्रोजन पेरोक्साइड को विघटित करने के लिए किया जाता है। | |||
=== जीवाण्विक पहचान (उत्प्रेरक परीक्षण) === | |||
[[Image:Catalase reaction.jpg|300px|thumb|सकारात्मक उत्प्रेरक अभिक्रिया]]बैक्टीरिया की प्रजातियों की पहचान करने के लिए माइक्रोबायोलॉजिस्ट द्वारा उपयोग किए जाने वाले तीन मुख्य परीक्षणों में से एक कैटालेज टेस्ट है। यदि बैक्टीरिया में कैटालेज होता है (अर्थात, कैटालेज- सकारात्मक होते हैं), जब हाइड्रोजन पेरोक्साइड में थोड़ी मात्रा में जीवाण्विक [[Index.php?title=पृथक कारक|पृथक कारक]] मिलाया जाता है, तो ऑक्सीजन के बुलबुले देखे जाते हैं। एक सूक्ष्मदर्शी स्लाइड पर हाइड्रोजन पेरोक्साइड की एक बूंद रखकर उत्प्रेरित परीक्षण किया जाता है। एक प्रलेपक छड़ी को कॉलोनी से छुआ जाता है, और फिर अग्रभाग को हाइड्रोजन पेरोक्साइड बूँद पर आलेपित किया जाता है। | |||
* यदि मिश्रण बुलबुले या झाग पैदा करता है, तो जीव को 'उत्प्रेरक-सकारात्मक' कहा जाता है। [[Index.php?title=स्टैफ़ीलोकोक्क्स|स्टैफ़ीलोकोक्क्स]]<ref name="urlBSCI 424 Pathogenic Microbiology -- Bacterial Pathogen List">{{cite web | url = http://www.life.umd.edu/classroom/bsci424/pathogendescriptions/PathogenList.htm | title = बैक्टीरियल रोगज़नक़ सूची| author = Rollins DM | date = 2000-08-01 | work = BSCI 424 Pathogenic Microbiology | publisher = University of Maryland | access-date = 2009-03-01}}</ref> और [[माइक्रोकोकस]]<ref name="urlBiochemical Tests">{{cite web | url = http://www.mc.maricopa.edu/~johnson/labtools/Dbiochem/cat.html | title = कैटालेस उत्पादन| author = Johnson M | work = Biochemical Tests | publisher = Mesa Community College | access-date = 2009-03-01 | url-status = dead | archive-url = https://web.archive.org/web/20081211073437/http://www.mc.maricopa.edu/~johnson/labtools/Dbiochem/cat.html | archive-date = 2008-12-11 }}</ref> उत्प्रेरित-सकारात्मक हैं। अन्य उत्प्रेरक-सकारात्मक जीवों में [[लिस्टेरिया]], [[कॉरीनेबैक्टीरियम डिप्थीरिया]], [[बर्कहोल्डरिया सेपसिया]], [[नोकार्डिया]], [[Index.php?title= एंटेरोबैक्टीरियेसी|एंटेरोबैक्टीरियेसी]] परिवार ([[Index.php?title=सिट्रोबैक्टर|सिट्रोबैक्टर]], ई. कोलाई.[[एंटरोबैक्टर]], [[क्लेबसिएला]], [[शिगेला]], [[Index.php?title=यरसिनिया|यरसिनिया]], प्रोटीस (जीवाणु), [[साल्मोनेला]], [[सेराटिया]]), [[स्यूडोमोनास]], माइकोबैक्टीरियम ट्यूबरकुलोसिस, [[ एस्परजिलस ]], क्रिप्टोकोकस (कवक), और [[रोडोकॉकस इक्वि]] सम्मिलित हैं। | |||
* यदि नहीं, तो जीव 'उत्प्रेरक-नकारात्मक' है। [[स्ट्रैपटोकोकस]]<ref name="urlStreptococcus pneumoniae and Staphylococci">{{cite web | url = http://pathmicro.med.sc.edu/fox/strep-staph.htm | title = स्ट्रेप्टोकोकस न्यूमोनिया और स्टेफिलोकोसी| author = Fox A | publisher = University of South Carolina | access-date = 2009-03-01}}</ref> और [[उदर गुहा]] एसपीपी उत्प्रेरित-नकारात्मक हैं। | |||
जबकि अकेले केटेलेस परीक्षण किसी विशेष जीव की पहचान नहीं कर सकता है, यह एंटीबायोटिक प्रतिरोध जैसे अन्य परीक्षणों के साथ संयुक्त होने पर पहचान में सहायता कर सकता है। जीवाण्विक कोशिकाओं में कैटालेज की उपस्थिति विकास की स्थिति और कोशिकाओं को विकसित करने के लिए उपयोग किए जाने वाले माध्यम दोनों पर निर्भर करती है। | |||
केश नली का भी उपयोग किया जा सकता है। झूठी नकारात्मक परिणामों से बचने के लिए, नली को अवरुद्ध किए बिना, केशिका नली के अंत में बैक्टीरिया का एक छोटा सा नमूना एकत्र किया जाता है। विपरीत छोर को फिर हाइड्रोजन पेरोक्साइड में डुबोया जाता है, जिसे केशिका क्रिया के माध्यम से नली में खींचा जाता है, और उल्टा कर दिया जाता है, ताकि बैक्टीरिया का नमूना नीचे की ओर हो। फिर नली को पकड़ने वाले भुजा को बेंच पर थपथपाया जाता है, हाइड्रोजन पेरोक्साइड को तब तक नीचे ले जाया जाता है जब तक कि वह बैक्टीरिया को छू न ले। यदि बुलबुले संपर्क पर बनते हैं, तो यह एक सकारात्मक उत्प्रेरित परिणाम दर्शाता है। यह परीक्षण लगभग 10<sup>5</sup> cells/mL से ऊपर की सांद्रता पर उत्प्रेरित-सकारात्मक बैक्टीरिया का पता लगा सकता है,<ref>{{Cite book|url=https://books.google.com/books?id=_orkBwAAQBAJ&pg=PA35|title=Fisheries Processing: Biotechnological applications| vauthors = Martin AM |date=2012-12-06|publisher=Springer Science & Business Media|isbn=9781461553038|language=en}}</ref> और उपयोग में आसान है। | |||
=== जीवाण्विक विषाणु === | |||
बैक्टीरिया को मारने के लिए [[ न्युट्रोफिल | न्युट्रोफिल]] और अन्य [[फ़ैगोसाइट]] पेरोक्साइड का उपयोग करते हैं। एंजाइम [[एनएडीपीएच ऑक्सीडेज]] [[फेगोसोम]] के भीतर [[सुपरऑक्साइड]] उत्पन्न करता है, जो हाइड्रोजन पेरोक्साइड के माध्यम से [[Index.php?title=हाइपोक्लोरस अम्ल|हाइपोक्लोरस अम्ल]] जैसे अन्य ऑक्सीकारक पदार्थों में परिवर्तित हो जाता है जो [[फैगोसाइटोसयुक्त]] रोगजनकों को मारते हैं।<ref>{{cite journal | vauthors = Winterbourn CC, Kettle AJ, Hampton MB | title = प्रतिक्रियाशील ऑक्सीजन प्रजातियां और न्यूट्रोफिल फ़ंक्शन| journal = Annual Review of Biochemistry | volume = 85 | issue = 1 | pages = 765–792 | date = June 2016 | pmid = 27050287 | doi = 10.1146/annurev-biochem-060815-014442 }}</ref> [[Index.php?title= जीर्ण कणिकागुल्मीय रोग|जीर्ण कणिकागुल्मीय रोग]] (सीजीडी) वाले व्यक्तियों में, दोषपूर्ण एनएडीपीएच ऑक्सीडेज सिस्टम के कारण फागोसाइटिक पेरोक्साइड उत्पादन बिगड़ा हुआ है। सामान्य सेलुलर चयापचय अभी भी थोड़ी मात्रा में पेरोक्साइड का उत्पादन करेगा और इस पेरोक्साइड का उपयोग बैक्टीरिया के संक्रमण को खत्म करने के लिए हाइपोक्लोरस अम्ल का उत्पादन करने के लिए किया जा सकता है। तथापि, यदि सीजीडी वाले व्यक्ति कैटालेज-सकारात्मक बैक्टीरिया से संक्रमित हैं, तो जीवाण्विक कैटालेज अतिरिक्त पेरोक्साइड को नष्ट कर सकता है, इससे पहले कि इसका उपयोग अन्य ऑक्सीकरण पदार्थों का उत्पादन करने के लिए किया जा सके। इन व्यक्तियों में रोगज़नक़ जीवित रहता है और एक जीर्ण संक्रमण बन जाता है। यह पुराना संक्रमण सामान्यतः संक्रमण को अलग करने के प्रयास में मैक्रोफेज से घिरा होता है। रोगज़नक़ के आसपास मैक्रोफेज की इस दीवार को [[ ग्रेन्युलोमा | ग्रेन्युलोमा]] कहा जाता है। कई जीवाणु उत्प्रेरित सकारात्मक होते हैं, लेकिन कुछ अन्य की तुलना में बेहतर उत्प्रेरित-उत्पादक होते हैं। कुछ उत्प्रेरक-सकारात्मक बैक्टीरिया और कवक में : नोकार्डिया, स्यूडोमोनास, लिस्टेरिया, एस्परगिलस, [[कैनडीडा अल्बिकन्स|कैनडीडा]] कोलाई, स्टैफिलोकोकस, सेराटिया, बी.सेपसिया और एच पाइलोरी सम्मिलित हैं ।<ref>{{Cite book|title=First aid for the USMLE step 1 2017: a student-to-student guide |isbn=978-1-259-83762-3 |edition=27th |location=New York |oclc=986222844| vauthors = Le T, Bhushan V, Sochat M, Kallianos K, Chavda Y, Zureick AH |date = 2017-01-06}}</ref> | |||
=== अकतालसिया === | === अकतालसिया === | ||
कैटलसिया | कैटलसिया CAT में समयुग्मी म्यूटेशन के कारण होने वाली स्थिति है, जिसके परिणामस्वरूप कैटालेज की कमी होती है। लक्षण हल्के होते हैं और इसमें मुंह के छाले सम्मिलित हैं। एक विषमयुग्मजी CAT म्यूटेशन का परिणाम कम होता है, लेकिन फिर भी उत्प्रेरित होता है।<ref>{{cite web |title=OMIM Entry - # 614097 - ACATALASEMIA |url=http://www.omim.org/entry/614097 |website=www.omim.org |language=en-us}}</ref> | ||
=== सफ़ेद बाल === | |||
मानव बालों के सफेद होने की प्रक्रिया में कैटालेज के निम्न स्तर की भूमिका हो सकती है। हाइड्रोजन पेरोक्साइड स्वाभाविक रूप से शरीर द्वारा निर्मित होता है और कैटालेज द्वारा टूट जाता है। हाइड्रोजन पेरोक्साइड बालों के रोम में जमा हो सकता है और अगर कैटालेज के स्तर में गिरावट आती है, तो यह वृद्धि बालों में ऑक्सीडेटिव तनाव और पक्का होने का कारण बन सकता है।<ref>{{Cite web |title=Gray hair cure? Scientists find root cause of discoloration |url=http://www.nbcnews.com/healthmain/gray-hair-cure-scientists-find-root-cause-discoloration-6C9802771 |access-date=2022-07-31 |website=NBC News |language=en}}</ref> उत्प्रेरित के ये निम्न स्तर वृद्धावस्था से जुड़े हैं। हाइड्रोजन पेरोक्साइड [[मेलेनिन]] के उत्पादन में हस्तक्षेप करता है, वर्णक जो बालों को रंग देता है।<ref name="ScienceDaily_Grey_Hair">{{cite web | url = https://www.sciencedaily.com/releases/2009/02/090223131123.htm | title = क्यों बाल सफेद हो जाते हैं अब एक ग्रे क्षेत्र नहीं है: जैसे-जैसे हम बड़े होते जाते हैं, हमारे बाल खुद-ब-खुद विरंजित हो जाते हैं| date = 2009-02-24 | work = Science News | publisher = ScienceDaily | access-date = 2009-03-01}}</ref><ref name="pmid19237503">{{cite journal | vauthors = Wood JM, Decker H, Hartmann H, Chavan B, Rokos H, Spencer JD, Hasse S, Thornton MJ, Shalbaf M, Paus R, Schallreuter KU | display-authors = 6 | title = Senile hair graying: H2O2-mediated oxidative stress affects human hair color by blunting methionine sulfoxide repair | journal = FASEB Journal | volume = 23 | issue = 7 | pages = 2065–2075 | date = July 2009 | pmid = 19237503 | doi = 10.1096/fj.08-125435 | arxiv = 0706.4406 | s2cid = 16069417 }}</ref> | |||
== पारस्परिक क्रिया == | |||
कैटालेज को [[ABL2]] और ''Abl'' genesके साथ [[Index.php?title=पारस्परिक क्रिया|पारस्परिक क्रिया]] के लिए दिखाया गया है<ref name="pmid12777400">{{cite journal | vauthors = Cao C, Leng Y, Kufe D | title = ऑक्सीडेटिव तनाव प्रतिक्रिया में कैटलस गतिविधि को सी-एबीएल और आर्ग द्वारा नियंत्रित किया जाता है| journal = The Journal of Biological Chemistry | volume = 278 | issue = 32 | pages = 29667–29675 | date = August 2003 | pmid = 12777400 | doi = 10.1074/jbc.M301292200 | doi-access = free }}</ref> ।<ref name=pmid12777400/> [[ मुरीन ल्यूकेमिया वायरस ]] के संक्रमण से चूहों के फेफड़े, हृदय और गुर्दे में उत्प्रेरित गतिविधि कम हो जाती है। इसके विपरीत, आहार मछली के तेल ने चूहों के दिल और गुर्दे में उत्प्रेरित गतिविधि को बढ़ा दिया।<ref>{{cite journal |doi=10.1016/S0271-5317(00)00214-1 |title=मुरीन एड्स के साथ चूहों में ऊतक ग्लूटाथियोन और एंटीऑक्सीडेंट रक्षा एंजाइमों पर आहार मछली के तेल के प्रभाव|journal=Nutrition Research |volume=20 |issue=9 |pages=1287–99 |year=2000 | vauthors = Xi S, Chen LH }}</ref> | |||
== | == उत्प्रेरक गतिविधि निर्धारित करने के तरीके == | ||
1870 में, स्कोएन ने मोलिब्डेट के साथ हाइड्रोजन पेरोक्साइड के संपर्क से पीले रंग के गठन की खोज की; फिर, 20वीं शताब्दी के मध्य से, इस अभिक्रिया का उपयोग उत्प्रेरक गतिविधि परख में अप्राप्य हाइड्रोजन पेरोक्साइड के वर्णमिति निर्धारण के लिए किया जाने लगा।<ref>{{Cite journal| vauthors = Razygraev AV |date=2021|title=A method for measuring catalase activity in mosquitoes by using ammonium molybdate and reaction medium buffered with 3-(N-morpholino)propanesulfonic acid|url=https://elibrary.ru/item.asp?id=46339915|journal=Parazitologiya|language=|volume=55|issue=4|pages=318–336|doi=10.31857/S0031184721040049|s2cid=237702049 |issn=0031-1847}}</ref> कोरोल्युक एट अल (1988)<ref>{{cite journal | vauthors = Koroliuk MA, Ivanova LI, Maĭorova IG, Tokarev VE | title = [A method of determining catalase activity] | journal = Laboratornoe Delo | issue = 1 | pages = 16–19 | date = 1988 | pmid = 2451064 | url = https://pubmed.ncbi.nlm.nih.gov/2451064/ }}</ref> और गोथ (1991)।<ref>{{cite journal | vauthors = Góth L | title = सीरम कैटालेज गतिविधि के निर्धारण और संदर्भ सीमा के संशोधन के लिए एक सरल विधि| journal = Clinica Chimica Acta; International Journal of Clinical Chemistry | volume = 196 | issue = 2–3 | pages = 143–151 | date = February 1991 | pmid = 2029780 | doi = 10.1016/0009-8981(91)90067-m }}</ref> द्वारा प्रकाशनों के बाद अभिक्रिया का व्यापक रूप से उपयोग किया जाने लगा। | |||
बीयर्स एंड साइजरऔर ऐबी के प्रकाशन के बाद हाइड्रोजन पेरोक्साइड की सांद्रता में कमी का प्रत्यक्ष यूवी माप भी व्यापक रूप से उपयोग किया जाता है।<ref>{{cite journal | vauthors = Beers RF, Sizer IW | title = कैटालेज द्वारा हाइड्रोजन पेरोक्साइड के टूटने को मापने के लिए एक स्पेक्ट्रोफोटोमेट्रिक विधि| journal = The Journal of Biological Chemistry | volume = 195 | issue = 1 | pages = 133–140 | date = March 1952 | doi = 10.1016/S0021-9258(19)50881-X | pmid = 14938361 | doi-access = free }}</ref> <ref>{{cite journal | vauthors = Aebi H | title = इन विट्रो में कैटालेस| journal = Methods in Enzymology | volume = 105 | pages = 121–126 | date = 1984-01-01 | pmid = 6727660 | doi = 10.1016/s0076-6879(84)05016-3 | publisher = Academic Press | series = Oxygen Radicals in Biological Systems }}</ref> | |||
बीयर्स एंड | |||
| Line 137: | Line 133: | ||
* {{cite web | url = http://www.rcsb.org/pdb/101/motm.do?momID=57.html | title = Catalase Molecule of the Month | publisher = Protein Data Bank | access-date = 2013-01-08 | url-status = dead | archive-url = https://web.archive.org/web/20130511202517/http://www.rcsb.org/pdb/101/motm.do?momID=57.html | archive-date = 2013-05-11 }} | * {{cite web | url = http://www.rcsb.org/pdb/101/motm.do?momID=57.html | title = Catalase Molecule of the Month | publisher = Protein Data Bank | access-date = 2013-01-08 | url-status = dead | archive-url = https://web.archive.org/web/20130511202517/http://www.rcsb.org/pdb/101/motm.do?momID=57.html | archive-date = 2013-05-11 }} | ||
* {{PDBe-KB2|P04040|Catalase}} | * {{PDBe-KB2|P04040|Catalase}} | ||
[[Category: | [[Category:CS1 English-language sources (en)]] | ||
[[Category:Created On 02/03/2023]] | [[Category:Created On 02/03/2023]] | ||
[[Category:Lua-based templates]] | |||
[[Category:Machine Translated Page]] | |||
[[Category:Pages using infobox enzyme with unknown parameters|IUBMB_EC_numberकेटालेज़]] | |||
[[Category:Pages with reference errors]] | |||
[[Category:Pages with script errors]] | |||
[[Category:Short description with empty Wikidata description]] | |||
[[Category:Template documentation pages|Short description/doc]] | |||
[[Category:Templates Vigyan Ready]] | |||
[[Category:Templates that add a tracking category]] | |||
[[Category:Templates that generate short descriptions]] | |||
[[Category:Templates using TemplateData]] | |||
Latest revision as of 16:54, 3 May 2023
| Catalase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Identifiers | |||||||||
| Symbol | Catalase | ||||||||
| Pfam | PF00199 | ||||||||
| InterPro | IPR011614 | ||||||||
| PROSITE | PDOC00395 | ||||||||
| SCOP2 | 7cat / SCOPe / SUPFAM | ||||||||
| OPM superfamily | 370 | ||||||||
| OPM protein | 3e4w | ||||||||
| CDD | cd00328 | ||||||||
| |||||||||
कैटालेस एक सामान्य एंजाइम है जो लगभग सभी जीवित जीवों में पाया जाता है जो ऑक्सीजन (जैसे जीवाणु , पौधों और जानवरों) के संपर्क में आते हैं जो जल और ऑक्सीजन के लिए हाइड्रोजन पेरोक्साइड के अपघटन को उत्प्रेरित करते हैं।[1] अभिक्रियाशील ऑक्सीजन प्रजातियों (ROS) द्वारा कोशिका को ऑक्सीडेटिव तनाव से बचाने में यह एक बहुत ही महत्वपूर्ण एंजाइम है। कैटालेस में सभी एंजाइमों की उच्चतम आवर्त संख्या है; एक कैटालेज अणु लाखों हाइड्रोजन पेरोक्साइड अणुओं को प्रति सेकंड जल और ऑक्सीजन में परिवर्तित कर सकता है।[2]
कैटालेस चार पॉलीपेप्टाइड श्रृंखलाओं का एक टेट्रामेरिक प्रोटीन है, प्रत्येक में 500 से अधिक एमिनो अम्ल होते हैं।[3] इसमें चार आयरन युक्त हीम समूह होते हैं जो एंजाइम को हाइड्रोजन पेरोक्साइड के साथ अभिक्रिया करने की अनुमति देते हैं। मानव उत्प्रेरक के लिए इष्टतम पीएच लगभग 7 है,[4] : अभिक्रिया की दर पीएच 6.8 और 7.5 के बीच पर्याप्त रूप से नहीं बदलती है।प्रजातियों के आधार पर अन्य उत्प्रेरकों के लिए पीएच इष्टतम 4 और 11 के बीच भिन्न होता है।इष्टतम तापमान भी प्रजातियों द्वारा भिन्न होता है
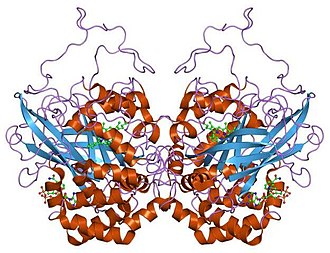
संरचना
मानव उत्प्रेरक चार प्रोटीन उपइकाई से बना एक चतुष्टय बनाता है, जिनमें से प्रत्येक को वैचारिक रूप से चार क्षेत्रों में विभाजित किया जा सकता है।[5] प्रत्येक उपइकाई का व्यापक कोर एक आठ-अवरुद्ध प्रतिसमांतर β-बैरल (β1-8) द्वारा उत्पन्न होता है, जिसमें निकटतम समीप संयोजकता एक तरफ β-बैरल लूप और दूसरी तरफ α9 लूप द्वारा प्रतिबंधित होती है। .[5]β-बैरल के एक फलक पर एक अल्फा हेलिक्स क्षेत्र चार सी-टर्मिनल हेलिक्स (α16, α17, α18, और α19) से बना है और β4 और β5 (α4, α5, α6, और α7) के बीच के अवशेषों से प्राप्त चार हेलिक्स हैं। .[5]वैकल्पिक संयोजन के परिणामस्वरूप विभिन्न प्रोटीन के प्रकार हो सकते हैं।
इतिहास
कैटालेस को पहली बार 1818 में लुइस जैक्स थेनार्ड द्वारा देखा गया था, जिन्होंने हाइड्रोजन पेरोक्साइड (H2O2) की खोज की थी।थेनार्ड ने सुझाव दिया कि इसका विघटन एक अज्ञात पदार्थ के कारण हुआ। 1900 में, ऑस्कर लोव ने सबसे पहले इसे कैटालेस नाम दिया, और इसे कई पौधों और जानवरों में पाया।[6] 1937 में जेम्स बी. सुमेर और अलेक्जेंडर डोंस द्वारा गोमांस के जिगर से कैटालेज को क्रिस्टलीकृत किया गया था[7] और आणविक भार 1938 में मापा गया था।[8]
1969 में गोजातीय कैटालेज का अमीनो अम्ल अनुक्रम निर्धारित किया गया था,[9] और 1981 में त्रि-आयामी संरचना निर्धारित की गई।[10]
कार्य
आणविक तंत्र
जबकि कैटालेज का पूरा तंत्र वर्तमान में ज्ञात नहीं है,[11]माना जाता है कि रासायनिक अभिक्रिया दो चरणों में होती है:
- H2O2 + Fe(III)-E → H2O + O=Fe(IV)-E(.+)
- H2O2 + O=Fe(IV)-E(.+) → H2O + Fe(III)-E + O2[11]
यहाँ Fe()-E एंजाइम से जुड़े हीम समूह के लौह केंद्र का प्रतिनिधित्व करता है। Fe(IV)-E(.+) , Fe(V)-E का एक मेसोमेरिक रूप है, जिसका अर्थ है कि आयरन पूरी तरह से +V में ऑक्सीकृत नहीं होता है, लेकिन हेम लिगैंड से कुछ स्थिर इलेक्ट्रॉन घनत्व प्राप्त करता है, जिसे बाद में एक रैडिकल धनायन (.+) के रूप में दिखाया जाता है।
जैसे ही हाइड्रोजन पेरोक्साइड सक्रिय साइट में प्रवेश करता है, यह अमीनो अम्ल Asn148 (148 स्थिति पर एस्पेराजीन) और His75 के साथ संपर्क नहीं करता है, जिससे एक प्रोटॉन (हाइड्रोजन आयन) ऑक्सीजन परमाणुओं के बीच स्थानांतरित हो जाता है। मुक्त ऑक्सीजन परमाणु समन्वय करता है, नवगठित जल के अणु और Fe(IV)=O को मुक्त करता है। Fe(IV)=O Fe(III)-E में सुधार करने के लिए दूसरे हाइड्रोजन पेरोक्साइड अणु के साथ अभिक्रिया करता है और जल और ऑक्सीजन का उत्पादन करता है।[11]पांचवें समन्वय की स्थिति में टायरोसिन के फेनोलेट लिगेंड की उपस्थिति से लौह केंद्र की अभिक्रियाशीलता में सुधार किया जा सकता है, जो Fe (III) से Fe (IV) के ऑक्सीकरण में सहायता कर सकता है। अभिक्रिया मध्यवर्ती के साथ His75 और Asn148 की पारस्परिक क्रिया से अभिक्रिया की दक्षता में भी सुधार हो सकता है।[11] उत्प्रेरक द्वारा हाइड्रोजन पेरोक्साइड का अपघटन प्रथम-क्रम गतिकी के अनुसार आगे बढ़ता है, दर हाइड्रोजन पेरोक्साइड सान्द्रता के समानुपाती होती है।[12]
कैटालेज़ विभिन्न मेटाबोलाइट्स और विषाक्त पदार्थों के हाइड्रोजन पेरोक्साइड द्वारा ऑक्सीकरण को भी उत्प्रेरित कर सकता है, जिसमें फॉर्मोल्डिहाइड, फॉर्मिक अम्ल , फिनोल, एसीटैल्डिहाइड और अल्कोहल सम्मिलित हैं। यह निम्नलिखित अभिक्रिया के अनुसार ऐसा करता है:
H2O2 + H2R → 2H2O + R
इस अभिक्रिया का सटीक तंत्र ज्ञात नहीं है।
कोई भी भारी धातु आयन (जैसे कि कॉपर (II) सल्फेट में कॉपर धनायन) कैटालेज के गैर-प्रतिस्पर्धी अवरोधक के रूप में कार्य कर सकता है। तथापि, तांबे की कमी से हृदय और यकृत जैसे ऊतकों में उत्प्रेरित गतिविधि में कमी आ सकती है।[13] इसके अतिरिक्त, ज़हर साइनाइड हाइड्रोजन पेरोक्साइड की उच्च सांद्रता पर कैटालेज़ का एक गैर-प्रतिस्पर्धी अवरोधक है[14] [15]
आर्सेनेट एक एंजाइम उत्प्रेरक के रूप में कार्य करता है।[16] पेरोक्सीडेटेड कैटालेज मध्यवर्ती की त्रि-आयामी प्रोटीन संरचनाएं प्रोटीन डाटा बैंक में उपलब्ध हैं।
सेलुलर भूमिका
हाइड्रोजन पेरोक्साइड कई सामान्य चयापचय प्रक्रियाओं का एक हानिकारक उपोत्पाद है; कोशिकाओं और ऊतकों को नुकसान से बचाने के लिए, इसे जल्दी से अन्य कम खतरनाक पदार्थों में परिवर्तित किया जाना चाहिए। यह अंत करने के लिए, कम अभिक्रियाशील गैसीय ऑक्सीजन और जल के अणुओं में हाइड्रोजन पेरोक्साइड के रासायनिक अपघटन को तेजी से उत्प्रेरित करने के लिए कोशिकाओं द्वारा प्राय: कैटालेज का उपयोग किया जाता है।[17]
चूहे आनुवंशिक रूप से उत्प्रेरक की कमी के लिए अभियंत्रित बनाते हैं, जो शुरू में फेनोटाइपिक रूप से सामान्य होते हैं। यद्यपि, चूहों में कैटालेज की कमी से मोटापा, वसीय यकृत और टाइप 2 मधुमेह होने की संभावना बढ़ सकती है। कुछ मनुष्यों में कैटालेज़ (एकेटेलसिया) का स्तर बहुत कम होता है, फिर भी कुछ दुष्प्रभाव करते हैं।
चूहों मेंआयुबढ़ने के साथ होने वाले बढ़े हुए ऑक्सीडेटिव तनाव को उत्प्रेरित की अधिक अभिव्यक्ति से कम किया जाता है। .[18] अति-व्यक्त करने वाले चूहे जंगली प्रकार के चूहों में देखे जाने वाले शुक्राणुजन, अंडकोष रोगाणु कोशिका और सर्टोली कोशिकाओं कीआयु से संबंधित हानि को प्रदर्शित नहीं करते हैं। जंगली प्रकार के चूहों में ऑक्सीडेटिव तनाव सामान्य रूप से आयु बढ़ने के साथ शुक्राणु में ऑक्सीडेटिव डीएनए क्षति ( 8-ऑक्सोडजी के रूप में मापा जाता है) को प्रेरित करता है, लेकिन इन नुकसानों को वृद्ध उत्प्रेरित अति-व्यक्त करने वाले चूहों में काफी कम किया जाता है। .[18] इसके अतिरिक्त, ये अति-व्यक्त करने वाले चूहे प्रति एक साथ पैदा हुए बच्चों की आयु-निर्भर संख्या में कोई कमी नहीं दिखाते हैं। माइटोकॉन्ड्रिया को लक्षित उत्प्रेरित की अधिकता चूहों के जीवनकाल का विस्तार करती है।[19]
यूकेरियोट में, उत्प्रेरक सामान्यतः एक सेलुलर कोशिकांग में स्थित होता है जिसे पेरोक्सीसोम कहा जाता है।[20] पादप कोशिकाओं में पेरोक्सीसोम प्रकाश श्वसन (ऑक्सीजन का उपयोग और कार्बन डाइऑक्साइड का उत्पादन) और सहजीवी नाइट्रोजन स्थिरीकरण (अभिक्रियाशील नाइट्रोजन परमाणुओं के लिए द्विपरमाण्विक नाइट्रोजन (N2) को तोड़ना)। हाइड्रोजन पेरोक्साइड का उपयोग एक शक्तिशाली रोगाणुरोधी एजेंट के रूप में किया जाता है जब कोशिकाएं एक रोगज़नक़ से संक्रमित होती हैं। माइकोबैक्टेरियम ट्यूबरक्यूलोसिस, लेगियोनेला न्यूमोफिला और कैंपाइलोबैक्टर जेजुनी जैसे कैटालेज-सकारात्मक रोगजनक पेरोक्साइड रेडिकल्स को निष्क्रिय करने के लिए कैटालेज बनाते हैं, इस प्रकार उन्हें मेजबान के भीतर अहानिकर रुप से जीवित रहने की अनुमति मिलती है।[21]
शराब डिहाइड्रोजनेज की तरह, कैटालेज़ इथेनॉल को एसीटैल्डिहाइड में परिवर्तित करता है, लेकिन यह संभावना नहीं है कि यह अभिक्रिया शारीरिक रूप से महत्वपूर्ण है।[22]
जीवों के बीच वितरण
स्तनधारियों में जिगर में होने वाली विशेष रूप से उच्च सांद्रता के साथ, अधिकांश ज्ञात जीव हर अंग में कैटालेज का उपयोग करते हैं।[23] कैटालेस मुख्य रूप से पेरोक्सीसोम और एरिथ्रोसाइट के साइटोसोल (और कभी-कभी माइटोकॉन्ड्रिया में) में पाया जाता है[24]
लगभग सभी एरोबिक सूक्ष्मजीव कैटलस का उपयोग करते हैं। यह कुछ अवायवीय जीव सूक्ष्मजीवों में भी उपस्थित है, जैसे कि मेथानोसारसीना बरकेरी।[25] कैटालेस भी पौधों के बीच सार्वभौमिक है और अधिकांश कवक में होता है।[26]
प्रक्षेपी भृंग में उत्प्रेरित का एक अनूठा उपयोग होता है। इस भृंग में तरल के दो सेट होते हैं जो दो युग्मित ग्रंथियों में अलग-अलग जमा होते हैं। जोड़ी के बड़े, भंडारण कक्ष या संग्रह में उदकुनैन और हाइड्रोजन पेरोक्सीडेज होते हैं, जबकि छोटे, अभिक्रिया कक्ष में उत्प्रेरक और पेरोक्साइड होते हैं। हानिकारक स्प्रे को सक्रिय करने के लिए, भृंग दो डिब्बों की सामग्री को मिला देता है, जिससे हाइड्रोजन पेरोक्साइड से ऑक्सीजन मुक्त हो जाती है। ऑक्सीजन हाइड्रोक्विनोन का ऑक्सीकरण करता है और प्रणोदक के रूप में भी कार्य करता है।[27] ऑक्सीकरण अभिक्रियाबहुत ऊष्माक्षेपी (ΔH = -202.8 kJ/mol) है और तेजी से मिश्रण को क्वथनांक तक गर्म करती है।[28]
लंबे समय तक रहने वाली दीमक की रानियों रेटिकुलिटर्मस स्पेरेटस में गैर-प्रजनन विशिष्ट (श्रमिकों और सैनिकों) की तुलना में काफी कम डीएनए ऑक्सीकरण होता है।रानियों में श्रमिकों की तुलना में दो गुना अधिक कैटालेज गतिविधि और कैटालेज जीन RsCAT1 की अभिव्यक्ति का स्तर सात गुना अधिक है।[29] [29] ऐसा प्रतीत होता है कि दीमक रानियों की कुशल एंटीऑक्सिडेंट क्षमता आंशिक रूप से यह बता सकती है कि वे कैसे लंबा जीवन प्राप्त करती हैं।
विभिन्न प्रजातियों के कैटालेस एंजाइमों में इष्टतम तापमान काफी भिन्न होता है। बहुतापी जानवरों में सामान्यतः 15-25 डिग्री सेल्सियस की सीमा में इष्टतम तापमान के साथ उत्प्रेरक होते हैं, जबकि स्तनधारी या एवियन उत्प्रेरकों का इष्टतम तापमान 35 डिग्री सेल्सियस से ऊपर हो सकता है,[30][31] और पौधों से उत्प्रेरक उनके विकास की आदत के आधार पर भिन्न होते हैं।[30] इसके विपरीत, हाइपरथर्मोफाइल आद्यकल्प पाइरोबाकुलम कैलिडिफोंटिस से अलग किए गए कैटालेज का तापमान इष्टतम 90 °C होता है।[32]
रोगलक्षण महत्व और अनुप्रयोग
पनीर उत्पादन से पहले दूध से हाइड्रोजन पेरोक्साइड को हटाने के लिए कैटलस का उपयोग खाद्य उद्योग में किया जाता है।[33] एक और उपयोग खाद्य लपेटने का कागज में होता है, जहां यह भोजन को ऑक्सीकरण से रोकता है।[34] कपड़ा उद्योग में कैटालेज का भी उपयोग किया जाता है, यह सुनिश्चित करने के लिए कि सामग्री पेरोक्साइड मुक्त है, कपड़ों से हाइड्रोजन पेरोक्साइड को हटा दिया जाता है।
संपर्क लेंस स्वच्छता में एक अल्प उपयोग है - कुछ लेंस-सफाई उत्पाद हाइड्रोजन पेरोक्साइड समाधान का उपयोग करके लेंस को कीटाणुरहित करते हैं; इसके बाद लेंस को फिर से उपयोग करने से पहले कैटालेज युक्त घोल का उपयोग हाइड्रोजन पेरोक्साइड को विघटित करने के लिए किया जाता है।
जीवाण्विक पहचान (उत्प्रेरक परीक्षण)
बैक्टीरिया की प्रजातियों की पहचान करने के लिए माइक्रोबायोलॉजिस्ट द्वारा उपयोग किए जाने वाले तीन मुख्य परीक्षणों में से एक कैटालेज टेस्ट है। यदि बैक्टीरिया में कैटालेज होता है (अर्थात, कैटालेज- सकारात्मक होते हैं), जब हाइड्रोजन पेरोक्साइड में थोड़ी मात्रा में जीवाण्विक पृथक कारक मिलाया जाता है, तो ऑक्सीजन के बुलबुले देखे जाते हैं। एक सूक्ष्मदर्शी स्लाइड पर हाइड्रोजन पेरोक्साइड की एक बूंद रखकर उत्प्रेरित परीक्षण किया जाता है। एक प्रलेपक छड़ी को कॉलोनी से छुआ जाता है, और फिर अग्रभाग को हाइड्रोजन पेरोक्साइड बूँद पर आलेपित किया जाता है।
- यदि मिश्रण बुलबुले या झाग पैदा करता है, तो जीव को 'उत्प्रेरक-सकारात्मक' कहा जाता है। स्टैफ़ीलोकोक्क्स[35] और माइक्रोकोकस[36] उत्प्रेरित-सकारात्मक हैं। अन्य उत्प्रेरक-सकारात्मक जीवों में लिस्टेरिया, कॉरीनेबैक्टीरियम डिप्थीरिया, बर्कहोल्डरिया सेपसिया, नोकार्डिया, एंटेरोबैक्टीरियेसी परिवार (सिट्रोबैक्टर, ई. कोलाई.एंटरोबैक्टर, क्लेबसिएला, शिगेला, यरसिनिया, प्रोटीस (जीवाणु), साल्मोनेला, सेराटिया), स्यूडोमोनास, माइकोबैक्टीरियम ट्यूबरकुलोसिस, एस्परजिलस , क्रिप्टोकोकस (कवक), और रोडोकॉकस इक्वि सम्मिलित हैं।
- यदि नहीं, तो जीव 'उत्प्रेरक-नकारात्मक' है। स्ट्रैपटोकोकस[37] और उदर गुहा एसपीपी उत्प्रेरित-नकारात्मक हैं।
जबकि अकेले केटेलेस परीक्षण किसी विशेष जीव की पहचान नहीं कर सकता है, यह एंटीबायोटिक प्रतिरोध जैसे अन्य परीक्षणों के साथ संयुक्त होने पर पहचान में सहायता कर सकता है। जीवाण्विक कोशिकाओं में कैटालेज की उपस्थिति विकास की स्थिति और कोशिकाओं को विकसित करने के लिए उपयोग किए जाने वाले माध्यम दोनों पर निर्भर करती है।
केश नली का भी उपयोग किया जा सकता है। झूठी नकारात्मक परिणामों से बचने के लिए, नली को अवरुद्ध किए बिना, केशिका नली के अंत में बैक्टीरिया का एक छोटा सा नमूना एकत्र किया जाता है। विपरीत छोर को फिर हाइड्रोजन पेरोक्साइड में डुबोया जाता है, जिसे केशिका क्रिया के माध्यम से नली में खींचा जाता है, और उल्टा कर दिया जाता है, ताकि बैक्टीरिया का नमूना नीचे की ओर हो। फिर नली को पकड़ने वाले भुजा को बेंच पर थपथपाया जाता है, हाइड्रोजन पेरोक्साइड को तब तक नीचे ले जाया जाता है जब तक कि वह बैक्टीरिया को छू न ले। यदि बुलबुले संपर्क पर बनते हैं, तो यह एक सकारात्मक उत्प्रेरित परिणाम दर्शाता है। यह परीक्षण लगभग 105 cells/mL से ऊपर की सांद्रता पर उत्प्रेरित-सकारात्मक बैक्टीरिया का पता लगा सकता है,[38] और उपयोग में आसान है।
जीवाण्विक विषाणु
बैक्टीरिया को मारने के लिए न्युट्रोफिल और अन्य फ़ैगोसाइट पेरोक्साइड का उपयोग करते हैं। एंजाइम एनएडीपीएच ऑक्सीडेज फेगोसोम के भीतर सुपरऑक्साइड उत्पन्न करता है, जो हाइड्रोजन पेरोक्साइड के माध्यम से हाइपोक्लोरस अम्ल जैसे अन्य ऑक्सीकारक पदार्थों में परिवर्तित हो जाता है जो फैगोसाइटोसयुक्त रोगजनकों को मारते हैं।[39] जीर्ण कणिकागुल्मीय रोग (सीजीडी) वाले व्यक्तियों में, दोषपूर्ण एनएडीपीएच ऑक्सीडेज सिस्टम के कारण फागोसाइटिक पेरोक्साइड उत्पादन बिगड़ा हुआ है। सामान्य सेलुलर चयापचय अभी भी थोड़ी मात्रा में पेरोक्साइड का उत्पादन करेगा और इस पेरोक्साइड का उपयोग बैक्टीरिया के संक्रमण को खत्म करने के लिए हाइपोक्लोरस अम्ल का उत्पादन करने के लिए किया जा सकता है। तथापि, यदि सीजीडी वाले व्यक्ति कैटालेज-सकारात्मक बैक्टीरिया से संक्रमित हैं, तो जीवाण्विक कैटालेज अतिरिक्त पेरोक्साइड को नष्ट कर सकता है, इससे पहले कि इसका उपयोग अन्य ऑक्सीकरण पदार्थों का उत्पादन करने के लिए किया जा सके। इन व्यक्तियों में रोगज़नक़ जीवित रहता है और एक जीर्ण संक्रमण बन जाता है। यह पुराना संक्रमण सामान्यतः संक्रमण को अलग करने के प्रयास में मैक्रोफेज से घिरा होता है। रोगज़नक़ के आसपास मैक्रोफेज की इस दीवार को ग्रेन्युलोमा कहा जाता है। कई जीवाणु उत्प्रेरित सकारात्मक होते हैं, लेकिन कुछ अन्य की तुलना में बेहतर उत्प्रेरित-उत्पादक होते हैं। कुछ उत्प्रेरक-सकारात्मक बैक्टीरिया और कवक में : नोकार्डिया, स्यूडोमोनास, लिस्टेरिया, एस्परगिलस, कैनडीडा कोलाई, स्टैफिलोकोकस, सेराटिया, बी.सेपसिया और एच पाइलोरी सम्मिलित हैं ।[40]
अकतालसिया
कैटलसिया CAT में समयुग्मी म्यूटेशन के कारण होने वाली स्थिति है, जिसके परिणामस्वरूप कैटालेज की कमी होती है। लक्षण हल्के होते हैं और इसमें मुंह के छाले सम्मिलित हैं। एक विषमयुग्मजी CAT म्यूटेशन का परिणाम कम होता है, लेकिन फिर भी उत्प्रेरित होता है।[41]
सफ़ेद बाल
मानव बालों के सफेद होने की प्रक्रिया में कैटालेज के निम्न स्तर की भूमिका हो सकती है। हाइड्रोजन पेरोक्साइड स्वाभाविक रूप से शरीर द्वारा निर्मित होता है और कैटालेज द्वारा टूट जाता है। हाइड्रोजन पेरोक्साइड बालों के रोम में जमा हो सकता है और अगर कैटालेज के स्तर में गिरावट आती है, तो यह वृद्धि बालों में ऑक्सीडेटिव तनाव और पक्का होने का कारण बन सकता है।[42] उत्प्रेरित के ये निम्न स्तर वृद्धावस्था से जुड़े हैं। हाइड्रोजन पेरोक्साइड मेलेनिन के उत्पादन में हस्तक्षेप करता है, वर्णक जो बालों को रंग देता है।[43][44]
पारस्परिक क्रिया
कैटालेज को ABL2 और Abl genesके साथ पारस्परिक क्रिया के लिए दिखाया गया है[45] ।[45] मुरीन ल्यूकेमिया वायरस के संक्रमण से चूहों के फेफड़े, हृदय और गुर्दे में उत्प्रेरित गतिविधि कम हो जाती है। इसके विपरीत, आहार मछली के तेल ने चूहों के दिल और गुर्दे में उत्प्रेरित गतिविधि को बढ़ा दिया।[46]
उत्प्रेरक गतिविधि निर्धारित करने के तरीके
1870 में, स्कोएन ने मोलिब्डेट के साथ हाइड्रोजन पेरोक्साइड के संपर्क से पीले रंग के गठन की खोज की; फिर, 20वीं शताब्दी के मध्य से, इस अभिक्रिया का उपयोग उत्प्रेरक गतिविधि परख में अप्राप्य हाइड्रोजन पेरोक्साइड के वर्णमिति निर्धारण के लिए किया जाने लगा।[47] कोरोल्युक एट अल (1988)[48] और गोथ (1991)।[49] द्वारा प्रकाशनों के बाद अभिक्रिया का व्यापक रूप से उपयोग किया जाने लगा।
बीयर्स एंड साइजरऔर ऐबी के प्रकाशन के बाद हाइड्रोजन पेरोक्साइड की सांद्रता में कमी का प्रत्यक्ष यूवी माप भी व्यापक रूप से उपयोग किया जाता है।[50] [51]
यह भी देखें
संदर्भ
- ↑ Chelikani P, Fita I, Loewen PC (January 2004). "उत्प्रेरकों के बीच संरचनाओं और गुणों की विविधता". Cellular and Molecular Life Sciences. 61 (2): 192–208. doi:10.1007/s00018-003-3206-5. hdl:10261/111097. PMID 14745498. S2CID 4411482.
- ↑ Goodsell DS (2004-09-01). "केटालेज़". Molecule of the Month. RCSB Protein Data Bank. Retrieved 2016-08-23.
- ↑ {{cite web |vauthors=Boon EM, Downs A, Marcey D |title = कैटालेज़: एच<उप>2</उप>ओ<उप>2</उप>: एच<उप>2</उप>ओ<उप>2</उप> ऑक्सीडोरडक्टेस| work = Catalase Structural Tutorial Text | url = http://biology.kenyon.edu/BMB/Chime/catalase/frames/cattx.htm | access-date = 2007-02-11}
- ↑ {{cite book | vauthors = Maehly AC, Chance B | chapter = The assay of catalases and peroxidases | volume = 1 | pages = 357–424 | year = 1954 | pmid = 13193536 | doi = 10.1002/9780470110171.ch14 | isbn = 978-0-470-11017-1 | series = जैव रासायनिक विश्लेषण के तरीके| title = जैव रासायनिक विश्लेषण के तरीके}</रेफ> और काफी व्यापक अधिकतम है: प्रतिक्रिया की दर पीएच 6.8 और 7.5 के बीच उल्लेखनीय रूप से नहीं बदलती है। रेफरी नाम= pmid6727660 >{{cite book | vauthors = Aebi H | title = इन विट्रो में कैटालेस| volume = 105 | pages = 121–6 | year = 1984 | pmid = 6727660 | doi = 10.1016/S0076-6879(84)05016-3 | isbn = 978-0-12-182005-3 | series = Methods in Enzymology | url = https://archive.org/details/oxygenradicalsin0000unse/page/121 }
- ↑ 5.0 5.1 5.2 {{cite journal | vauthors = Putnam CD, Arvai AS, Bourne Y, Tainer JA | title = सक्रिय और संदमन मानव उत्प्रेरक संरचनाएं: लिगैंड और एनएडीपीएच बाध्यकारी और उत्प्रेरक तंत्र| journal = Journal of Molecular Biology | volume = 296 | issue = 1 | pages = 295–309 | date = February 2000 | pmid = 10656833 | doi = 10.1006/jmbi.1999.3458 }
- ↑ Loew O (May 1900). "जीवों में सामान्य घटना का एक नया एंजाइम". Science. 11 (279): 701–702. Bibcode:1900Sci....11..701L. doi:10.1126/science.11.279.701. JSTOR 1625707. PMID 17751716.
- ↑ Sumner JB, Dounce AL (April 1937). "क्रिस्टलीय कैटालेस". Science. 85 (2206): 366–367. Bibcode:1937Sci....85..366S. doi:10.1126/science.85.2206.366. PMID 17776781.
- ↑ Sumner JB, Gralén N (March 1938). "क्रिस्टलीय कैटालेस का आणविक भार". Science. 87 (2256): 284. Bibcode:1938Sci....87..284S. doi:10.1126/science.87.2256.284. PMID 17831682. S2CID 36931581.
- ↑ Schroeder WA, Shelton JR, Shelton JB, Robberson B, Apell G (May 1969). "The amino acid sequence of bovine liver catalase: a preliminary report". Archives of Biochemistry and Biophysics. 131 (2): 653–655. doi:10.1016/0003-9861(69)90441-X. PMID 4892021.
- ↑ Murthy MR, Reid TJ, Sicignano A, Tanaka N, Rossmann MG (October 1981). "बीफ लीवर कैटलस की संरचना". Journal of Molecular Biology. 152 (2): 465–499. doi:10.1016/0022-2836(81)90254-0. PMID 7328661.
- ↑ 11.0 11.1 11.2 11.3 Boon EM, Downs A, Marcey D. "कैटालेस का प्रस्तावित तंत्र". Catalase: H2O2: H2O2 Oxidoreductase: Catalase Structural Tutorial. Retrieved 2007-02-11.
- ↑ Aebi H (1984). "इन विट्रो में कैटालेस". Methods in Enzymology. 105: 121–126. doi:10.1016/S0076-6879(84)05016-3. PMID 6727660.
- ↑ Hordyjewska A, Popiołek Ł, Kocot J (August 2014). "चिकित्सा और उपचार में तांबे के कई "चेहरे"". Biometals. 27 (4): 611–621. doi:10.1007/s10534-014-9736-5. PMC 4113679. PMID 24748564.
- ↑ Nonstationary Inhibition of Enzyme Action. The Cyanide Inhibition of Catalase
- ↑ Ogura Y, Yamazaki I (August 1983). "साइनाइड की उपस्थिति में उत्प्रेरित प्रतिक्रिया की स्थिर-अवस्था कैनेटीक्स". Journal of Biochemistry. 94 (2): 403–408. doi:10.1093/oxfordjournals.jbchem.a134369. PMID 6630165.
- ↑ Kertulis-Tartar GM, Rathinasabapathi B, Ma LQ (October 2009). "ग्लूटाथियोन रिडक्टेस की विशेषता और आर्सेनिक के संपर्क में आने पर दो टेरिस फ़र्न के मोर्चों में उत्प्रेरित". Plant Physiology and Biochemistry. 47 (10): 960–965. doi:10.1016/j.plaphy.2009.05.009. PMID 19574057.
- ↑ Gaetani GF, Ferraris AM, Rolfo M, Mangerini R, Arena S, Kirkman HN (February 1996). "मानव एरिथ्रोसाइट्स के भीतर हाइड्रोजन पेरोक्साइड के निपटान में उत्प्रेरक की प्रमुख भूमिका". Blood. 87 (4): 1595–1599. doi:10.1182/blood.V87.4.1595.bloodjournal8741595. PMID 8608252.
- ↑ 18.0 18.1 Selvaratnam J, Robaire B (November 2016). "Overexpression of catalase in mice reduces age-related oxidative stress and maintains sperm production". Experimental Gerontology. 84: 12–20. doi:10.1016/j.exger.2016.08.012. PMID 27575890. S2CID 2416413.
- ↑ Schriner SE, Linford NJ, Martin GM, Treuting P, Ogburn CE, Emond M, et al. (June 2005). "माइटोकॉन्ड्रिया को लक्षित कैटालेज के अतिअभिव्यक्ति द्वारा मरीन जीवन काल का विस्तार". Science. 308 (5730): 1909–1911. Bibcode:2005Sci...308.1909S. doi:10.1126/science.1106653. PMID 15879174. S2CID 38568666.
- ↑ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). "Peroxisomes". कोशिका का आणविक जीवविज्ञान (4th ed.). New York: Garland Science. ISBN 978-0-8153-3218-3.
- ↑ Srinivasa Rao PS, Yamada Y, Leung KY (September 2003). "A major catalase (KatB) that is required for resistance to H2O2 and phagocyte-mediated killing in Edwardsiella tarda". Microbiology. 149 (Pt 9): 2635–2644. doi:10.1099/mic.0.26478-0. PMID 12949187.
- ↑ Lieber CS (January 1997). "इथेनॉल चयापचय, सिरोसिस और शराब". Clinica Chimica Acta; International Journal of Clinical Chemistry. 257 (1): 59–84. doi:10.1016/S0009-8981(96)06434-0. PMID 9028626.
- ↑ Ilyukha VA (2001). "विभिन्न इकोजेनेसिस के स्तनधारियों के अंगों में सुपरऑक्साइड डिसम्यूटेस और कैटालेज़". Journal of Evolutionary Biochemistry and Physiology. 37 (3): 241–245. doi:10.1023/A:1012663105999. S2CID 38916410.
- ↑ Bai J, Cederbaum AI (2001). "माइटोकॉन्ड्रियल कैटालेज और ऑक्सीडेटिव चोट". Biological Signals and Receptors. 10 (3–4): 189–199. doi:10.1159/000046887. PMID 11351128. S2CID 33795198.
- ↑ Brioukhanov AL, Netrusov AI, Eggen RI (June 2006). "कैटालेज और सुपरऑक्साइड डिसम्यूटेज जीन कड़ाई से अवायवीय पुरातन मेथनोसारसीना बारकेरी में ऑक्सीडेटिव तनाव पर ट्रांसक्रिप्शनल रूप से अप-विनियमित होते हैं।". Microbiology. 152 (Pt 6): 1671–1677. doi:10.1099/mic.0.28542-0. PMID 16735730.
- ↑ Hansberg W, Salas-Lizana R, Domínguez L (September 2012). "Fungal catalases: function, phylogenetic origin and structure". Archives of Biochemistry and Biophysics. 525 (2): 170–180. doi:10.1016/j.abb.2012.05.014. PMID 22698962.
- ↑ Eisner T, Aneshansley DJ (August 1999). "Spray aiming in the bombardier beetle: photographic evidence". Proceedings of the National Academy of Sciences of the United States of America. 96 (17): 9705–9709. Bibcode:1999PNAS...96.9705E. doi:10.1073/pnas.96.17.9705. PMC 22274. PMID 10449758.
- ↑ Beheshti N, McIntosh AC (2006). "बॉम्बार्डियर बीटल के विस्फोटक डिस्चार्ज का बायोमिमेटिक अध्ययन" (PDF). Int. Journal of Design & Nature. 1 (1): 1–9. Archived from the original (PDF) on 2011-07-26.
- ↑ 29.0 29.1 Tasaki E, Kobayashi K, Matsuura K, Iuchi Y (2017). "An Efficient Antioxidant System in a Long-Lived Termite Queen". PLOS ONE. 12 (1): e0167412. Bibcode:2017PLoSO..1267412T. doi:10.1371/journal.pone.0167412. PMC 5226355. PMID 28076409.
- ↑ 30.0 30.1 Mitsuda H (1956-07-31). "कैटालसे पर अध्ययन" (PDF). Bulletin of the Institute for Chemical Research, Kyoto University. 34 (4): 165–192. Archived (PDF) from the original on 2022-10-09. Retrieved 27 September 2017.
- ↑ Çetinus ŞA, Öztop HN (June 2003). "रासायनिक रूप से क्रॉसलिंक्ड चिटोसन मोतियों में उत्प्रेरित का स्थिरीकरण". Enzyme and Microbial Technology. 32 (7): 889–894. doi:10.1016/S0141-0229(03)00065-6.
- ↑ Amo T, Atomi H, Imanaka T (June 2002). "हाइपरथर्मोफिलिक आर्कियन, पायरोबाकुलम कैलिडिफोंटिस VA1 में मैंगनीज कैटालेज की अद्वितीय उपस्थिति". Journal of Bacteriology. 184 (12): 3305–3312. doi:10.1128/JB.184.12.3305-3312.2002. PMC 135111. PMID 12029047.
- ↑ "केटालेज़". Worthington Enzyme Manual. Worthington Biochemical Corporation. Retrieved 2009-03-01.
- ↑ {{cite web | url = http://madsci.org/posts/archives/mar99/921636249.Gb.r.html | title = पुन: उद्योग में कैटलस का उपयोग कैसे किया जाता है?| author = Hengge A | date = 1999-03-16 | work = General Biology | publisher = MadSci Network | access-date = 2009-03-01}
- ↑ Rollins DM (2000-08-01). "बैक्टीरियल रोगज़नक़ सूची". BSCI 424 Pathogenic Microbiology. University of Maryland. Retrieved 2009-03-01.
- ↑ Johnson M. "कैटालेस उत्पादन". Biochemical Tests. Mesa Community College. Archived from the original on 2008-12-11. Retrieved 2009-03-01.
- ↑ Fox A. "स्ट्रेप्टोकोकस न्यूमोनिया और स्टेफिलोकोसी". University of South Carolina. Retrieved 2009-03-01.
- ↑ Martin AM (2012-12-06). Fisheries Processing: Biotechnological applications (in English). Springer Science & Business Media. ISBN 9781461553038.
- ↑ Winterbourn CC, Kettle AJ, Hampton MB (June 2016). "प्रतिक्रियाशील ऑक्सीजन प्रजातियां और न्यूट्रोफिल फ़ंक्शन". Annual Review of Biochemistry. 85 (1): 765–792. doi:10.1146/annurev-biochem-060815-014442. PMID 27050287.
- ↑ Le T, Bhushan V, Sochat M, Kallianos K, Chavda Y, Zureick AH (2017-01-06). First aid for the USMLE step 1 2017: a student-to-student guide (27th ed.). New York. ISBN 978-1-259-83762-3. OCLC 986222844.
{{cite book}}: CS1 maint: location missing publisher (link) - ↑ "OMIM Entry - # 614097 - ACATALASEMIA". www.omim.org (in English).
- ↑ "Gray hair cure? Scientists find root cause of discoloration". NBC News (in English). Retrieved 2022-07-31.
- ↑ "क्यों बाल सफेद हो जाते हैं अब एक ग्रे क्षेत्र नहीं है: जैसे-जैसे हम बड़े होते जाते हैं, हमारे बाल खुद-ब-खुद विरंजित हो जाते हैं". Science News. ScienceDaily. 2009-02-24. Retrieved 2009-03-01.
- ↑ Wood JM, Decker H, Hartmann H, Chavan B, Rokos H, Spencer JD, et al. (July 2009). "Senile hair graying: H2O2-mediated oxidative stress affects human hair color by blunting methionine sulfoxide repair". FASEB Journal. 23 (7): 2065–2075. arXiv:0706.4406. doi:10.1096/fj.08-125435. PMID 19237503. S2CID 16069417.
- ↑ 45.0 45.1 Cao C, Leng Y, Kufe D (August 2003). "ऑक्सीडेटिव तनाव प्रतिक्रिया में कैटलस गतिविधि को सी-एबीएल और आर्ग द्वारा नियंत्रित किया जाता है". The Journal of Biological Chemistry. 278 (32): 29667–29675. doi:10.1074/jbc.M301292200. PMID 12777400.
- ↑ Xi S, Chen LH (2000). "मुरीन एड्स के साथ चूहों में ऊतक ग्लूटाथियोन और एंटीऑक्सीडेंट रक्षा एंजाइमों पर आहार मछली के तेल के प्रभाव". Nutrition Research. 20 (9): 1287–99. doi:10.1016/S0271-5317(00)00214-1.
- ↑ Razygraev AV (2021). "A method for measuring catalase activity in mosquitoes by using ammonium molybdate and reaction medium buffered with 3-(N-morpholino)propanesulfonic acid". Parazitologiya. 55 (4): 318–336. doi:10.31857/S0031184721040049. ISSN 0031-1847. S2CID 237702049.
- ↑ Koroliuk MA, Ivanova LI, Maĭorova IG, Tokarev VE (1988). "[A method of determining catalase activity]". Laboratornoe Delo (1): 16–19. PMID 2451064.
- ↑ Góth L (February 1991). "सीरम कैटालेज गतिविधि के निर्धारण और संदर्भ सीमा के संशोधन के लिए एक सरल विधि". Clinica Chimica Acta; International Journal of Clinical Chemistry. 196 (2–3): 143–151. doi:10.1016/0009-8981(91)90067-m. PMID 2029780.
- ↑ Beers RF, Sizer IW (March 1952). "कैटालेज द्वारा हाइड्रोजन पेरोक्साइड के टूटने को मापने के लिए एक स्पेक्ट्रोफोटोमेट्रिक विधि". The Journal of Biological Chemistry. 195 (1): 133–140. doi:10.1016/S0021-9258(19)50881-X. PMID 14938361.
- ↑ Aebi H (1984-01-01). "इन विट्रो में कैटालेस". Methods in Enzymology. Oxygen Radicals in Biological Systems. Academic Press. 105: 121–126. doi:10.1016/s0076-6879(84)05016-3. PMID 6727660.
बाहरी संबंध
- "GenAge entry for CAT (Homo sapiens)". Human Ageing Genomic Resources. Retrieved 2009-03-05.
- "Catalase". MadSci FAQ. madsci.org. Retrieved 2009-03-05.
- "Catalase and oxidase test video". Regnvm Prokaryotae. Retrieved 2009-03-05.
- "EC 1.11.1.6 - catalase". Brenda: The Comprehensive Enzyme Information System. Retrieved 2009-03-05.
- "PeroxiBase - The peroxidase database". Swiss Institute of Bioinformatics. Archived from the original on 2008-10-13. Retrieved 2009-03-05.
- "Catalase Procedure". MicrobeID.com. Retrieved 2009-04-22.
- "Catalase Molecule of the Month". Protein Data Bank. Archived from the original on 2013-05-11. Retrieved 2013-01-08.
- Overview of all the structural information available in the PDB for UniProt: P04040 (Catalase) at the PDBe-KB.

