एटैन: Difference between revisions
mNo edit summary |
No edit summary |
||
| Line 1: | Line 1: | ||
{{Short description|Organic compound (H<sub>3</sub>C–CH<sub>3</sub>)}} | {{Short description|Organic compound (H<sub>3</sub>C–CH<sub>3</sub>)}} | ||
{{About| | {{About|रासायनिक यौगिक|आपात सेवा प्रोटोकॉल|ईथेन}} | ||
{{distinguish| | {{distinguish|ईथेन|एथाइन}} | ||
{{Chembox | {{Chembox | ||
| Watchedfields = changed | | Watchedfields = changed | ||
| Line 87: | Line 87: | ||
}} | }} | ||
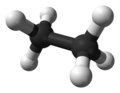
ईथेन | ईथेन [[रासायनिक सूत्र]] {{chem|C|2|H|6}} वाला एक कार्बनिक [[रासायनिक यौगिक]] है, तापमान और दबाव की मानक स्थितियों में, ईथेन एक रंगहीन, गंधहीन [[गैस]] है। कई [[हाइड्रोकार्बन]] की तरह, ईथेन [[प्राकृतिक गैस]] से औद्योगिक पैमाने पर और [[तेल शोधशाला]] के पेट्रो रसायन उपोत्पाद के रूप में [[रसायन विज्ञान में शुद्धिकरण विधियों की सूची|रसायन विज्ञान में शुद्धिकरण विधियों की सूची में अलग किया जाता]] है। इसका मुख्य उपयोग [[ईथीलीन|एथिलीन]] उत्पादन के लिए [[फीडस्टॉक|कच्चा माल]] के रूप में होता है। | ||
संबंधित यौगिकों | संबंधित यौगिकों, हाइड्रोजन परमाणु को दूसरे [[कार्यात्मक समूह]] के साथ बदलकर बनाया जा सकता है; ईथेन अंश को [[एथिल समूह]] कहा जाता है। उदाहरण के लिए, एक [[हाइड्रॉकसिल]] समूह से जुड़ा एक एथिल समूह पेय पदार्थों में ऐल्कोहल, [[इथेनॉल|ईथेनॉल]] पैदा करता है। | ||
== इतिहास == | == इतिहास == | ||
एथेन को पहली बार 1834 में [[माइकल फैराडे]] द्वारा [[पोटेशियम एसीटेट]] विलयन के [[इलेक्ट्रोलीज़|विद्युत अपघटन]] को लागू करके संश्लेषित किया गया था। उन्होंने [[मीथेन]] के लिए इस अभिक्रिया के हाइड्रोकार्बन उत्पाद को मीथेन समझ लिया और आगे इसकी जांच नहीं की।<ref name=Faraday/> | एथेन को पहली बार 1834 में [[माइकल फैराडे]] द्वारा [[पोटेशियम एसीटेट]] विलयन के [[इलेक्ट्रोलीज़|विद्युत अपघटन]] को लागू करके संश्लेषित किया गया था। उन्होंने [[मीथेन]] के लिए इस अभिक्रिया के हाइड्रोकार्बन उत्पाद को मीथेन समझ लिया और आगे इसकी जांच नहीं की।<ref name=Faraday/> | ||
1847-1849 की अवधि के दौरान, [[कार्बनिक रसायन विज्ञान]] के [[कट्टरपंथी सिद्धांत]] को सही साबित करने के प्रयास में, [[हरमन कोल्बे]] और [[एडवर्ड फ्रैंकलैंड]] ने पोटेशियम धातु के साथ प्रोपियोनिट्रिल ([[एथिल साइनाइड]]) और [[एथिल आयोडाइड]]<ref name=Frankland/> की कमी से ईथेन का उत्पादन किया<ref name="Kolbe" /> और फैराडे की तरह, जलीय एसीटेट के इलेक्ट्रोलिसिस | 1847-1849 की अवधि के दौरान, [[कार्बनिक रसायन विज्ञान]] के [[कट्टरपंथी सिद्धांत]] को सही साबित करने के प्रयास में, [[हरमन कोल्बे]] और [[एडवर्ड फ्रैंकलैंड]] ने पोटेशियम धातु के साथ प्रोपियोनिट्रिल ([[एथिल साइनाइड]]) और [[एथिल आयोडाइड]]<ref name=Frankland/> की कमी से ईथेन का उत्पादन किया<ref name="Kolbe" /> और फैराडे की तरह, जलीय एसीटेट के इलेक्ट्रोलिसिस द्वारा ईथेन का उत्पादन किया। उन्होंने मिथाइल रेडिकल ({{Chem2|CH3}}) के लिए इन प्रतिक्रियाओं के उत्पाद को गलत समझा, जिसमें से ईथेन {{Chem2|C2H6}} एक मंदक है। | ||
इस त्रुटि को 1864 में [[ कार्ल शोर्लेमर ]] द्वारा ठीक किया गया, जिन्होंने दिखाया कि इन सभी अभिक्रियाओं का उत्पाद वास्तव में ईथेन था।<ref>{{cite journal|doi=10.1002/jlac.18641320217|title=Ueber die Identität des Aethylwasserstoffs und des Methyls|journal=Annalen der Chemie und Pharmacie|volume=132|issue=2|pages=234–238|year=1864|last1=Schorlemmer|first1=Carl|url=https://zenodo.org/record/1427237}}</ref> 1864 में [[एडमंड रोनाल्ड|एडमंड]] रोनाल्ड्स द्वारा [[पेंसिल्वेनिया]] के हल्के कच्चे तेल में घुले ईथेन की खोज की गई थी।<ref>{{Cite book|title=रसायन विज्ञान पर ग्रंथ|last1=Roscoe|first1=H.E.|last2=Schorlemmer|first2=C.|publisher=Macmillan|year=1881|volume=3|pages=144–145}}</ref><ref>{{Cite book|title=रसायन विज्ञान का शब्दकोश|last=Watts|first=H.|year=1868|volume=4|pages=385}}</ref> | इस त्रुटि को 1864 में [[ कार्ल शोर्लेमर |कार्ल शोर्लेमर]] द्वारा ठीक किया गया, जिन्होंने दिखाया कि इन सभी अभिक्रियाओं का उत्पाद वास्तव में ईथेन था।<ref>{{cite journal|doi=10.1002/jlac.18641320217|title=Ueber die Identität des Aethylwasserstoffs und des Methyls|journal=Annalen der Chemie und Pharmacie|volume=132|issue=2|pages=234–238|year=1864|last1=Schorlemmer|first1=Carl|url=https://zenodo.org/record/1427237}}</ref> 1864 में [[एडमंड रोनाल्ड|एडमंड]] रोनाल्ड्स द्वारा [[पेंसिल्वेनिया]] के हल्के कच्चे तेल में घुले ईथेन की खोज की गई थी।<ref>{{Cite book|title=रसायन विज्ञान पर ग्रंथ|last1=Roscoe|first1=H.E.|last2=Schorlemmer|first2=C.|publisher=Macmillan|year=1881|volume=3|pages=144–145}}</ref><ref>{{Cite book|title=रसायन विज्ञान का शब्दकोश|last=Watts|first=H.|year=1868|volume=4|pages=385}}</ref> | ||
== गुण == | == गुण == | ||
मानक तापमान और दबाव पर, ईथेन एक रंगहीन, गंधहीन गैस है। इसका क्वथनांक {{cvt|-88.5|°C|F}} और का गलनांक {{cvt|-182.8|°C|F}} होता है|ठोस ईथेन कई रूपों(संशोधन) में मौजूद है।<ref name="Nes">{{cite journal |doi= 10.1107/S0567740878007037 |title= ईथेन, एथिलीन और एसिटिलीन की एकल-क्रिस्टल संरचनाएं और इलेक्ट्रॉन घनत्व वितरण। I. ईथेन के दो संशोधनों के सिंगल-क्रिस्टल एक्स-रे संरचना निर्धारण|journal= Acta Crystallographica Section B |volume=34 |issue=6 |page= 1947 |year= 1978 |last1= Van Nes |first1= G.J.H. |last2= Vos |first2= A. |s2cid= 55183235 |url= http://www.rug.nl/research/portal/files/3440910/c3.pdf}}</ref> सामान्य दबाव में ठंडा होने पर, दिखने वाला पहला संशोधन एक [[प्लास्टिक क्रिस्टल|प्लास्टिक स्फटिक]] है, जो क्यूबिक प्रणाली में स्फटिकीकृत होता है। इस रूप में, हाइड्रोजन परमाणुओं की स्थिति निश्चित नहीं होती है; अणु लंबी धुरी के चारों ओर स्वतंत्र रूप से घूम सकते हैं। इस ईथेन को ca के नीचे ठंडा करना। {{convert|89.9|K|C F}} इसे मोनोक्लिनिक मेटास्टेबल ईथेन II ([[अंतरिक्ष समूह]] P 21/n) में बदल देता है।<ref>{{cite web |url= https://log-web.de/chemie/Start.htm?name=ethaneCryst&lang=en |title= ईथेन एक ठोस के रूप में|access-date= 2019-12-10}}</ref> ईथेन जल में बहुत कम घुलनशील है। | मानक तापमान और दबाव पर, ईथेन एक रंगहीन, गंधहीन गैस है। इसका क्वथनांक {{cvt|-88.5|°C|F}} और का गलनांक {{cvt|-182.8|°C|F}} होता है|ठोस ईथेन कई रूपों(संशोधन) में मौजूद है।<ref name="Nes">{{cite journal |doi= 10.1107/S0567740878007037 |title= ईथेन, एथिलीन और एसिटिलीन की एकल-क्रिस्टल संरचनाएं और इलेक्ट्रॉन घनत्व वितरण। I. ईथेन के दो संशोधनों के सिंगल-क्रिस्टल एक्स-रे संरचना निर्धारण|journal= Acta Crystallographica Section B |volume=34 |issue=6 |page= 1947 |year= 1978 |last1= Van Nes |first1= G.J.H. |last2= Vos |first2= A. |s2cid= 55183235 |url= http://www.rug.nl/research/portal/files/3440910/c3.pdf}}</ref> सामान्य दबाव में ठंडा होने पर, दिखने वाला पहला संशोधन एक [[प्लास्टिक क्रिस्टल|प्लास्टिक स्फटिक]] है, जो क्यूबिक प्रणाली में स्फटिकीकृत होता है। इस रूप में, हाइड्रोजन परमाणुओं की स्थिति निश्चित नहीं होती है; अणु लंबी धुरी के चारों ओर स्वतंत्र रूप से घूम सकते हैं। इस ईथेन को ca के नीचे ठंडा करना। {{convert|89.9|K|C F}} इसे मोनोक्लिनिक मेटास्टेबल ईथेन II ([[अंतरिक्ष समूह]] P 21/n) में बदल देता है।<ref>{{cite web |url= https://log-web.de/chemie/Start.htm?name=ethaneCryst&lang=en |title= ईथेन एक ठोस के रूप में|access-date= 2019-12-10}}</ref> ईथेन जल में बहुत कम घुलनशील है। | ||
Revision as of 08:24, 5 April 2023
|
| |||
|
| |||
| Names | |||
|---|---|---|---|
| Preferred IUPAC name
Ethane[1] | |||
| Systematic IUPAC name
Dicarbane (never recommended[2]) | |||
| Identifiers | |||
3D model (JSmol)
|
|||
| 1730716 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| EC Number |
| ||
| 212 | |||
| MeSH | Ethane | ||
PubChem CID
|
|||
| RTECS number |
| ||
| UNII | |||
| UN number | 1035 | ||
| |||
| |||
| Properties | |||
| C2H6 | |||
| Molar mass | 30.070 g·mol−1 | ||
| Appearance | Colorless gas | ||
| Odor | Odorless | ||
| Density |
544.0 kg/m3 (liquid at -88,5 °C) | ||
| Melting point | −182.8 °C; −296.9 °F; 90.4 K | ||
| Boiling point | −88.5 °C; −127.4 °F; 184.6 K | ||
| Critical point (T, P) | 305.32 K (32.17 °C; 89.91 °F) 48.714 bars (4,871.4 kPa) | ||
| 56.8 mg L−1[4] | |||
| Vapor pressure | 3.8453 MPa (at 21.1 °C) | ||
Henry's law
constant (kH) |
19 nmol Pa−1 kg−1 | ||
| Acidity (pKa) | 50 | ||
| Basicity (pKb) | −36 | ||
| Conjugate acid | Ethanium | ||
| -37.37·10−6 cm3/mol | |||
| Thermochemistry | |||
Heat capacity (C)
|
52.49 J K−1 mol−1 | ||
Std enthalpy of
formation (ΔfH⦵298) |
−84 kJ mol−1 | ||
Std enthalpy of
combustion (ΔcH⦵298) |
−1561.0–−1560.4 kJ mol−1 | ||
| Hazards | |||
| GHS labelling: | |||

| |||
| Danger | |||
| H220, H280 | |||
| P210, P410+P403 | |||
| NFPA 704 (fire diamond) | |||
| Flash point | −135 °C (−211 °F; 138 K) | ||
| 472 °C (882 °F; 745 K) | |||
| Explosive limits | 2.9–13% | ||
| Safety data sheet (SDS) | inchem.org | ||
| Related compounds | |||
Related alkanes
|
|||
Related compounds
|
|||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
| |||
ईथेन रासायनिक सूत्र C
2H
6 वाला एक कार्बनिक रासायनिक यौगिक है, तापमान और दबाव की मानक स्थितियों में, ईथेन एक रंगहीन, गंधहीन गैस है। कई हाइड्रोकार्बन की तरह, ईथेन प्राकृतिक गैस से औद्योगिक पैमाने पर और तेल शोधशाला के पेट्रो रसायन उपोत्पाद के रूप में रसायन विज्ञान में शुद्धिकरण विधियों की सूची में अलग किया जाता है। इसका मुख्य उपयोग एथिलीन उत्पादन के लिए कच्चा माल के रूप में होता है।
संबंधित यौगिकों, हाइड्रोजन परमाणु को दूसरे कार्यात्मक समूह के साथ बदलकर बनाया जा सकता है; ईथेन अंश को एथिल समूह कहा जाता है। उदाहरण के लिए, एक हाइड्रॉकसिल समूह से जुड़ा एक एथिल समूह पेय पदार्थों में ऐल्कोहल, ईथेनॉल पैदा करता है।
इतिहास
एथेन को पहली बार 1834 में माइकल फैराडे द्वारा पोटेशियम एसीटेट विलयन के विद्युत अपघटन को लागू करके संश्लेषित किया गया था। उन्होंने मीथेन के लिए इस अभिक्रिया के हाइड्रोकार्बन उत्पाद को मीथेन समझ लिया और आगे इसकी जांच नहीं की।[5]
1847-1849 की अवधि के दौरान, कार्बनिक रसायन विज्ञान के कट्टरपंथी सिद्धांत को सही साबित करने के प्रयास में, हरमन कोल्बे और एडवर्ड फ्रैंकलैंड ने पोटेशियम धातु के साथ प्रोपियोनिट्रिल (एथिल साइनाइड) और एथिल आयोडाइड[6] की कमी से ईथेन का उत्पादन किया[7] और फैराडे की तरह, जलीय एसीटेट के इलेक्ट्रोलिसिस द्वारा ईथेन का उत्पादन किया। उन्होंने मिथाइल रेडिकल (CH3) के लिए इन प्रतिक्रियाओं के उत्पाद को गलत समझा, जिसमें से ईथेन C2H6 एक मंदक है।
इस त्रुटि को 1864 में कार्ल शोर्लेमर द्वारा ठीक किया गया, जिन्होंने दिखाया कि इन सभी अभिक्रियाओं का उत्पाद वास्तव में ईथेन था।[8] 1864 में एडमंड रोनाल्ड्स द्वारा पेंसिल्वेनिया के हल्के कच्चे तेल में घुले ईथेन की खोज की गई थी।[9][10]
गुण
मानक तापमान और दबाव पर, ईथेन एक रंगहीन, गंधहीन गैस है। इसका क्वथनांक −88.5 °C (−127.3 °F) और का गलनांक −182.8 °C (−297.0 °F) होता है|ठोस ईथेन कई रूपों(संशोधन) में मौजूद है।[11] सामान्य दबाव में ठंडा होने पर, दिखने वाला पहला संशोधन एक प्लास्टिक स्फटिक है, जो क्यूबिक प्रणाली में स्फटिकीकृत होता है। इस रूप में, हाइड्रोजन परमाणुओं की स्थिति निश्चित नहीं होती है; अणु लंबी धुरी के चारों ओर स्वतंत्र रूप से घूम सकते हैं। इस ईथेन को ca के नीचे ठंडा करना। 89.9 K (−183.2 °C; −297.8 °F) इसे मोनोक्लिनिक मेटास्टेबल ईथेन II (अंतरिक्ष समूह P 21/n) में बदल देता है।[12] ईथेन जल में बहुत कम घुलनशील है।
माइक्रोवेव(सूक्ष्म तरंग) स्पेक्ट्रमिकी और इलेक्ट्रॉन विवर्तन द्वारा ईथेन के बंधन मापदंडों को उच्च परिशुद्धता के लिए मापा गया है: rC−C = 1.528(3) Å, rC−H = 1.088(5) Å, और ∠CCH = 111.6(5)° माइक्रोवेव(सूक्ष्म तरंग) द्वारा और इलेक्ट्रॉन विवर्तन द्वारा rC−C = 1.524(3) Å, rC−H = 1.089(5) Å, और ∠CCH = 111.9(5)° (कोष्ठकों में संख्याएं अंतिम अंकों में अनिश्चितताओं को दर्शाती हैं)।[13]
वायुमंडलीय और अलौकिक

ईथेन पृथ्वी के वायुमंडल में एक अनुरेखण गैस के रूप में होता है, वर्तमान में समुद्र के स्तर पर 0.5 भागों प्रति बिलियन की एकाग्रता है,[14] यद्यपि इसकी पूर्व-औद्योगिक सांद्रता लगभग 0.25 भाग प्रति बिलियन होने की संभावना है क्योंकि आज के वातावरण में ईथेन का एक महत्वपूर्ण अनुपात जीवाश्म ईंधन के रूप में उत्पन्न हो सकता है। प्राकृतिक गैस क्षेत्र में गैस के भड़कने के कारण वैश्विक ईथेन की मात्रा समय के साथ बदलती रहती है।[15] वैश्विक ईथेन उत्सर्जन दरों में 1984 से 2010 तक गिरावट आई,[15]यद्यपि अमेरिका में बेकन गठन में शेल गैस के उत्पादन में वृद्धि ने गिरावट को आधे से कम कर दिया है।[16]
[17] यद्यपि ईथेन एक ग्रीनहाउस गैस है, यह मीथेन की तुलना में बहुत कम प्रचुर मात्रा में है, एक दशक से अधिक की तुलना में केवल कुछ महीनों का जीवनकाल होता है,[18] और द्रव्यमान के सापेक्ष विकिरण को अवशोषित करने में भी कम कुशल है। वास्तव में, ईथेन की ग्लोबल वार्मिंग(भूमंडलीय ऊष्मीकरण) क्षमता काफी हद तक इसके वातावरण में मीथेन में रूपांतरण का परिणाम है।[19] यह सभी चार विशाल ग्रहों के वातावरण में और शनि के चंद्रमा टाइटन के वातावरण में एक अनुरेखण घटक के रूप में पाया गया है।[20]
मीथेन गैस पर सूर्य की प्रकाश रसायन क्रिया से वायुमंडलीय ईथेन का परिणाम, इन वायुमंडलों में भी मौजूद है: 160 नैनोमीटर से कम तरंग दैर्ध्य के पराबैंगनी फोटोन मीथेन अणु को मिथाइल रेडिकल(कट्टरपंथी) और हाइड्रोजन परमाणु में अलग कर सकते हैं। जब दो मिथाइल मूलक पुनः संयोजित होते हैं, तो परिणाम ईथेन होता है:
- CH4 → CH3• + •H
- CH3• + •CH3 → C2H6
पृथ्वी के वायुमंडल में, हाइड्रॉक्सिल रेडिकल(कट्टरपंथी) ईथेन को लगभग तीन महीने के आधे जीवन के साथ मेथनॉल वाष्प में परिवर्तित करता है।[18]
ऐसा संदेह है कि टाइटन पर इस तरह से उत्पादित ईथेन चंद्रमा की सतह पर वापस बारिश करता है, और समय के साथ चंद्रमा के अधिकांश ध्रुवीय क्षेत्रों को आच्छादन करने वाले हाइड्रोकार्बन समुद्रों में जमा हो गया है। दिसंबर 2007 में कैसिनी जांच में टाइटन के दक्षिणी ध्रुव पर कम से कम एक झील पाई गई, जिसे अब झील ओंटारियो कहा जाता है क्योंकि झील का क्षेत्र पृथ्वी पर ओंटारियो झील(लगभग 20,000 किमी2) के समान है| जुलाई 2008 में प्रस्तुत इन्फ्रारेड स्पेक्ट्रोस्कोपिक डेटा का और विश्लेषण[21] ने ओंटारियो लैकस में द्रव ईथेन की उपस्थिति के लिए अतिरिक्त सबूत प्रदान किए। कैसिनी द्वारा एकत्र किए गए रडार डेटा का उपयोग करते हुए टाइटन के उत्तरी ध्रुव के पास कई महत्वपूर्ण रूप से बड़ी हाइड्रोकार्बन झीलें, लीजिया मारे और क्रैकेन मारे, दो सबसे बड़ी हैं, खोजी गईं। माना जाता है कि ये झीलें मुख्य रूप से द्रव ईथेन और मीथेन के मिश्रण से भरी हुई हैं।
1996 में धूमकेतु हयाकुटके में ईथेन का पता चला था।[22]और इसके बाद से कुछ अन्य धूमकेतुओं में इसका पता चला है। इन दूर के सौर मंडल निकायों में ईथेन का अस्तित्व ईथेन को सौर निहारिका के एक प्राथमिक घटक के रूप में फंसा सकता है जिससे माना जाता है कि सूर्य और ग्रहों का निर्माण हुआ है।
2006 में, नासा/एम्स रिसर्च सेंटर (एक नए क्षितिज सह-अन्वेषक) के डेल क्रुइशांक और उनके सहयोगियों ने प्लूटो की सतह पर ईथेन की स्पेक्ट्रमिकी खोज की घोषणा की।[23]
रसायन विज्ञान
ईथेन को दो मिथाइल समूह के रूप में देखा जा सकता है, जो कि मिथाइल समूहों का एक मंदक (रसायन विज्ञान) है। प्रयोगशाला में, ईथेन को कोल्बे इलेक्ट्रोलिसिस द्वारा आसानी से संश्लेषित किया जा सकता है। इस तकनीक में एसीटेट लवण का जलीय विलयन विद्युत अपघटन होता है। एनोड पर, एसीटेट को कार्बन डाईऑक्साइड और मिथाइल रेडिकल(कट्टरपंथी) का उत्पादन करने के लिए ऑक्सीकरण किया जाता है, और अत्यधिक अभिक्रियाशील मिथाइल रेडिकल(कट्टरपंथी) ईथेन का उत्पादन करने के लिए गठबंधन करते हैं:
- CH3COO− → CH3• + CO2 + e−
- CH3• + •CH3 → C2H6
पेरोक्साइड द्वारा एसिटिक एनहाईड्राइड के ऑक्सीकरण द्वारा संश्लेषण अवधारणात्मक रूप से समान है।
ईथेन के रसायन में मुख्य रूप से मुक्त मूलक अभिक्रियाएँ सम्मलित हैं। ईथेन मुक्त-कट्टरपंथी हलोजन द्वारा हलोजन, विशेष रूप से क्लोरीन और ब्रोमाइन के साथ अभिक्रिया कर सकता है। यह अभिक्रिया एथिल रेडिकल(कट्टरपंथी) के प्रसार के माध्यम से आगे बढ़ती है:
- C2H5• + Cl2 → C2H5Cl + Cl•
- Cl• + C2H6 → C2H5• + HCl
क्योंकि हलोजनयुक्त ईथेन आगे मुक्त रेडिकल(कट्टरपंथी) हैलोजन से गुजर सकता है, इस अभिक्रिया के परिणामस्वरूप कई हलोजनयुक्त उत्पादों का मिश्रण होता है। रासायनिक उद्योग में, किसी विशेष दो-कार्बन हैलोएल्केन के उत्पादन के लिए अधिक चयनात्मक रासायनिक अभिक्रियाओं का उपयोग किया जाता है।
दहन
ईथेन का पूर्ण दहन 1559.7 kJ/mol, या 51.9 kJ/g, ऊष्मा का उत्सर्जन करता है, और रासायनिक समीकरण के अनुसार कार्बन डाइऑक्साइड और जल का उत्पादन करता है:
- 2 C2H6 + 7 O2 → 4 CO2 + 6 H2O + 3120 kJ
दहन ऑक्सीजन की अधिकता के बिना भी हो सकता है, अनाकार कार्बन और कार्बन मोनोआक्साइड का मिश्रण बनता है।
- 2 C2H6 + 3 O2 → 4 C + 6 H2O + ऊर्जा
- 2 C2H6 + 5 O2 → 4 CO + 6 H2O + ऊर्जा
- 2 C2H6 + 4 O2 → 2 C + 2 CO + 6 H2O + ऊर्जा आदि।
दहन मुक्त-कट्टरपंथी अभिक्रियाओं की एक जटिल श्रृंखला द्वारा होता है। ईथेन दहन के रासायनिक गतिकी के कंप्यूटर अनुकरण में सैकड़ों अभिक्रियाएं सम्मलित हैं। ईथेन दहन में अभिक्रिया की एक महत्वपूर्ण श्रृंखला ऑक्सीजन के साथ एथिल रेडिकल(कट्टरपंथी) का संयोजन है, और परिणामस्वरूप पेरोक्साइड एथॉक्सी और हाइड्रॉक्सिल रेडिकल(कट्टरपंथी) में टूट जाता है।
- C2H5• + O2 → C2H5OO•
- C2H5OO• + HR → C2H5OOH + •R
- C2H5OOH → C2H5O• + •OH
अधूरे ईथेन दहन के प्रमुख कार्बन युक्त उत्पाद कार्बन मोनोऑक्साइड और फॉर्मलाडेहाइड जैसे एकल-कार्बन यौगिक हैं। एक महत्वपूर्ण मार्ग जिसके द्वारा ईथेन में कार्बन-कार्बन बंधन टूट जाता है, इन एकल-कार्बन उत्पादों को उत्पन्न करने के लिए, एथॉक्सी रेडिकल(कट्टरपंथी) का मिथाइल रेडिकल(कट्टरपंथी) और फॉर्मलाडेहाइड में अपघटन होता है, जो बदले में आगे ऑक्सीकरण से गुजर सकता है।
- C2H5O• → CH3• + CH2O
ईथेन के अधूरे दहन में कुछ छोटे उत्पादों में एसीटैल्डिहाइड, मीथेन, मेथनॉल और ईथेनॉल सम्मलित हैं। उच्च तापमान पर, विशेष रूप से 600–900 °C (1,112–1,652 °F) की सीमा में, एथिलीन एक महत्वपूर्ण उत्पाद है। यह इस तरह की अभिक्रियाओं से उत्पन्न होता है:
- C2H5• + O2 → C2H4 + •OOH
इसी तरह की अभिक्रियाएं (हाइड्रोजन सार तत्व के रूप में ऑक्सीजन के अलावा अन्य एजेंटों के साथ) भाप का टूटना में ईथेन से एथिलीन के उत्पादन में सम्मलित हैं।
रुकावट

एक मुड़ने योग्य बंधन के बारे में एक आणविक उपसंरचना को घुमाने के लिए समान्यता ऊर्जा की आवश्यकता होती है। 360° बॉन्ड घूर्णन उत्पन्न करने के लिए न्यूनतम ऊर्जा को घूर्णी अवरोध कहा जाता है।
ईथेन इस तरह के घूर्णी अवरोध का एक उत्कृष्ट, सरल उदाहरण देता है, जिसे कभी-कभी ईथेन अवरोध कहा जाता है। इस अवरोध के शुरुआती प्रायोगिक साक्ष्यों में (बाईं ओर आरेख देखें) ईथेन की एन्ट्रॉपी को प्रतिरूपण करके प्राप्त किया गया था।[25] अवरोध को दूर करने के लिए पर्याप्त ऊर्जा प्रदान किए जाने पर प्रत्येक छोर पर तीन हाइड्रोजन केंद्रीय कार्बन-कार्बन बांड के बारे में पिनव्हील करने के लिए स्वतंत्र हैं। अवरोध की भौतिक उत्पत्ति अभी भी पूरी तरह से तय नहीं हुई है,[26] यद्यपि अणु के विपरीत सिरों पर हाइड्रोजन परमाणुओं के बीच ओवरलैप (विनिमय) प्रतिकर्षण[27] शायद सबसे मजबूत उम्मीदवार है, , कंपित रचना पर अतिसंयुग्मन के स्थिरीकरण प्रभाव के साथ घटना में योगदान देता है।[28]अणु के विपरीत सिरों पर हाइड्रोजन परमाणुओं के बीच शायद सबसे मजबूत उम्मीदवार है सैद्धांतिक तरीके जो एक उपयुक्त प्रारंभिक बिंदु (लंबकोणीय कक्षाओं) का उपयोग करते हैं, पाते हैं कि ईथेन घूर्णन अवरोध की उत्पत्ति में अतिसंयुग्मन सबसे महत्वपूर्ण कारक है।[29][30]
1890-1891 तक, रसायनज्ञों ने सुझाव दिया कि ईथेन के अणु कंपित रचना को पसंद करते हैं, अणु के दो सिरे एक-दूसरे से तिरछे होते हैं।[31][32][33][34]
उत्पादन
मीथेन के बाद, ईथेन प्राकृतिक गैस का दूसरा सबसे बड़ा घटक है। विभिन्न गैस क्षेत्रों से प्राकृतिक गैस ईथेन सामग्री में 1% से कम मात्रा में 6% से अधिक भिन्न होती है। 1960 के दशक से पहले, ईथेन और बड़े अणुओं को समान्यता प्राकृतिक गैस के मीथेन घटक से अलग नहीं किया जाता था, लेकिन ईंधन के रूप में मीथेन के साथ ही जला दिया जाता था। आज, ईथेन एक महत्वपूर्ण पेट्रो रसायन कच्चा माल है और अधिकांश विकसित गैस क्षेत्रों में प्राकृतिक गैस के अन्य घटकों से अलग किया जाता है। ईथेन को पेट्रोलियम गैस से भी अलग किया जा सकता है, पेट्रोलियम शोधन के उपोत्पाद के रूप में उत्पादित गैसीय हाइड्रोकार्बन का मिश्रण है।
ईथेन को क्रायोजेनिक तापमान पर द्रवीभूत करके मीथेन से सबसे कुशलता से अलग किया जाता है। विभिन्न प्रशीतन रणनीतियाँ मौजूद हैं: वर्तमान में व्यापक रूप से उपयोग की जाने वाली सबसे किफायती अभिक्रिया एक टर्बो विस्तारक को नियोजित करती है, और प्राकृतिक गैस में 90% से अधिक ईथेन को पुनर्प्राप्त कर सकती है। इस अभिक्रिया में, एक टर्बाइन के माध्यम से ठंडी गैस का विस्तार किया जाता है, जिससे तापमान लगभग−100 °C (−148 °F) तक कम हो जाता है| इस कम तापमान पर, आसवन द्वारा गैसीय मीथेन को द्रवीकृत ईथेन और भारी हाइड्रोकार्बन से अलग किया जा सकता है। इसके बाद आसवन ईथेन को प्रोपेन और भारी हाइड्रोकार्बन से अलग करता है।
उपयोग
ईथेन का मुख्य उपयोग भाप के टूटने से एथिलीन (एथीन) का उत्पादन होता है। जब भाप से पतला किया जाता है और थोड़े समय के लिए बहुत उच्च तापमान (900 °C या अधिक) तक गर्म किया जाता है, तो भारी हाइड्रोकार्बन हल्के हाइड्रोकार्बन में टूट जाते हैं, और संतृप्त हाइड्रोकार्बन असंतृप्त हाइड्रोकार्बन बन जाते हैं। ईथेन को एथिलीन उत्पादन के लिए पसंद किया जाता है क्योंकि ईथेन का वाष्प विखंडन एथिलीन के लिए काफी चयनात्मक होता है, जबकि भारी हाइड्रोकार्बन के वाष्प विखंडन से एथिलीन में कम उत्पाद मिश्रण और प्रोपेन (प्रोपीलीन) और ब्यूटाडीन जैसे भारी एल्केन्स (ओलेफिन) और सुगंधित हाइड्रोकार्बन में समृद्ध होती है।
प्रायोगिक रूप से, ईथेन की अन्य वस्तु रसायनों के लिए कच्चा माल के रूप में जांच की जा रही है। एथेन का ऑक्सीडेटिव क्लोरीनीकरण लंबे समय से एथिलीन क्लोरीनीकरण की तुलना में विनाइल क्लोराइड के लिए संभावित रूप से अधिक किफायती मार्ग प्रतीत होता है। इस अभिक्रिया के उत्पादन के लिए कई अभिक्रियाओं का पेटेंट कराया गया है, लेकिन विनाइल क्लोराइड और संक्षारण अभिक्रिया स्थितियों के लिए खराब चयनात्मकता (विशेष रूप से, 500 डिग्री सेल्सियस से अधिक तापमान पर हाइड्रोक्लोरिक एसिड युक्त एक अभिक्रिया मिश्रण) ने उनमें से अधिकांश के व्यावसायीकरण को हतोत्साहित किया है। वर्तमान में, INEOS जर्मनी में विल्हेमशेवन में 1000 t/a (टन प्रति वर्ष) ईथेन-टू-विनाइल क्लोराइड प्रायोगिक संयंत्र का संचालन करता है।
इसी तरह, सऊदी अरब की फर्म(कंपनी) SABIC ने यानबु में ईथेन ऑक्सीकरण द्वारा एसीटिक अम्ल का उत्पादन करने के लिए 30,000 टन/एक संयंत्र के निर्माण की घोषणा की है। इस अभिक्रिया की आर्थिक व्यवहार्यता सऊदी तेल क्षेत्रों के पास ईथेन की कम लागत पर निर्भर हो सकती है, और यह दुनिया में कहीं और मेथनॉल कार्बोनाइलेशन के साथ प्रतिस्पर्धी नहीं हो सकती है।
ईथेन को क्रायोजेनिक प्रशीतन प्रणाली में शीतल के रूप में इस्तेमाल किया जा सकता है। बहुत छोटे पैमाने पर, वैज्ञानिक अनुसंधान में, द्रव ईथेन का उपयोग क्रायो-इलेक्ट्रॉन माइक्रोस्कोपी के लिए जल-समृद्ध नमूनों को काचित करने के लिए किया जाता है। जल की एक पतली परत -150 डिग्री सेल्सियस पर द्रव ईथेन में जल्दी से डूब जाती है या जल के स्फटिकीकरण के लिए बहुत जल्दी जम जाती है। धीमी हिमीकरण विधियों से घन बर्फ के स्फटिक उत्पन्न हो सकते हैं, जो नमूनों को नुकसान पहुंचाकर नरम सामग्री को बाधित कर सकते हैं और डिटेक्टर(संसूचक) तक पहुंचने से पहले इलेक्ट्रॉन किरण को बिखेर कर छवि गुणवत्ता को कम कर सकते हैं।
स्वास्थ्य और सुरक्षा
कमरे के तापमान पर, ईथेन एक अत्यंत ज्वलनशील गैस है। मात्रा के हिसाब से 3.0%-12.5% पर हवा के साथ मिश्रित होने पर, यह एक विस्फोट मिश्रण बनाता है।
कुछ अतिरिक्त सावधानियां आवश्यक हैं जहां ईथेन को क्रायोजेनिक द्रव के रूप में संग्रहित किया जाता है। द्रव ईथेन के सीधे संपर्क में आने से गंभीर शीतदंश हो सकता है। जब तक वे कमरे के तापमान तक गर्म नहीं हो जाते, द्रव ईथेन से वाष्प हवा की तुलना में भारी होते हैं और निचले स्थानों में एकत्रित होकर फर्श या जमीन के साथ बह सकते हैं; यदि वाष्प एक प्रज्वलन स्रोत का सामना करते हैं, तो रासायनिक अभिक्रिया ईथेन के स्रोत पर वापस आ सकती है जिससे वे वाष्पित हो गए थे।
ईथेन ऑक्सीजन को विस्थापित कर सकता है और श्वासावरोध का खतरा बन सकता है। ईथेन में कोई ज्ञात तीव्र या जीर्ण विष विज्ञान जोखिम नहीं है। यह कैंसरजन नहीं है।[35]
यह भी देखें
- बायोगैस: प्राकृतिक गैस का कार्बन-तटस्थ विकल्प
- बायोरिफाइनिंग
- जैव निम्नीकरणीय प्लास्टिक
- ड्रॉप-इन जैवप्लास्टिक
संदर्भ
- ↑ International Union of Pure and Applied Chemistry (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. The Royal Society of Chemistry. p. 133. doi:10.1039/9781849733069. ISBN 978-0-85404-182-4.
The saturated unbranched acyclic hydrocarbons C2H6, C3H8, and C4H10 have the retained names ethane, propane, and butane, respectively.
- ↑ IUPAC 2014, p. 4. "Similarly, the retained names 'ethane', 'propane', and 'butane' were never replaced by systematic names 'dicarbane', 'tricarbane', and 'tetracarbane' as recommended for analogues of silane, 'disilane'; phosphane, 'triphosphane'; and sulfane, 'tetrasulfane'."
- ↑ "Ethane – Compound Summary". PubChem Compound. USA: National Center for Biotechnology Information. 16 September 2004. Retrieved 7 December 2011.
- ↑ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. p. 8.88. ISBN 0-8493-0486-5.
- ↑ Faraday, Michael (1834). "Experimental researches in electricity: Seventh series". Philosophical Transactions. 124: 77–122. Bibcode:1834RSPT..124...77F. doi:10.1098/rstl.1834.0008. S2CID 116224057.
- ↑ Frankland, Edward (1850). "On the isolation of the organic radicals". Journal of the Chemical Society. 2 (3): 263–296. doi:10.1039/QJ8500200263.
- ↑ Kolbe, Hermann; Frankland, Edward (1849). "On the products of the action of potassium on cyanide of ethyl". Journal of the Chemical Society. 1: 60–74. doi:10.1039/QJ8490100060.
- ↑ Schorlemmer, Carl (1864). "Ueber die Identität des Aethylwasserstoffs und des Methyls". Annalen der Chemie und Pharmacie. 132 (2): 234–238. doi:10.1002/jlac.18641320217.
- ↑ Roscoe, H.E.; Schorlemmer, C. (1881). रसायन विज्ञान पर ग्रंथ. Vol. 3. Macmillan. pp. 144–145.
- ↑ Watts, H. (1868). रसायन विज्ञान का शब्दकोश. Vol. 4. p. 385.
- ↑ Van Nes, G.J.H.; Vos, A. (1978). "ईथेन, एथिलीन और एसिटिलीन की एकल-क्रिस्टल संरचनाएं और इलेक्ट्रॉन घनत्व वितरण। I. ईथेन के दो संशोधनों के सिंगल-क्रिस्टल एक्स-रे संरचना निर्धारण" (PDF). Acta Crystallographica Section B. 34 (6): 1947. doi:10.1107/S0567740878007037. S2CID 55183235.
- ↑ "ईथेन एक ठोस के रूप में". Retrieved 2019-12-10.
- ↑ Harmony, Marlin D. (1990-11-15). "The equilibrium carbon–carbon single‐bond length in ethane". The Journal of Chemical Physics (in English). 93 (10): 7522–7523. Bibcode:1990JChPh..93.7522H. doi:10.1063/1.459380. ISSN 0021-9606.
- ↑ Trace gases (archived). Atmosphere.mpg.de. Retrieved on 2011-12-08.
- ↑ 15.0 15.1 Simpson, Isobel J.; Sulbaek Andersen, Mads P.; Meinardi, Simone; Bruhwiler, Lori; Blake, Nicola J.; Helmig, Detlev; Rowland, F. Sherwood; Blake, Donald R. (2012). "वैश्विक वायुमंडलीय ईथेन सांद्रता में दीर्घकालिक गिरावट और मीथेन के लिए निहितार्थ". Nature. 488 (7412): 490–494. Bibcode:2012Natur.488..490S. doi:10.1038/nature11342. PMID 22914166. S2CID 4373714.
- ↑ Kort, E. A.; Smith, M. L.; Murray, L. T.; Gvakharia, A.; Brandt, A. R.; Peischl, J.; Ryerson, T. B.; Sweeney, C.; Travis, K. (2016). "बकेन शेल से भगोड़ा उत्सर्जन वैश्विक ईथेन शिफ्ट में शेल उत्पादन की भूमिका को दर्शाता है". Geophysical Research Letters. 43 (9): 4617–4623. Bibcode:2016GeoRL..43.4617K. doi:10.1002/2016GL068703.
- ↑ "वैश्विक ईथेन गैस वृद्धि में एक तेल क्षेत्र एक प्रमुख अपराधी है". University of Michigan. April 26, 2016.
- ↑ 18.0 18.1 Aydin, Kamil Murat; Williams, M.B. and Saltzman, E.S.; ‘Feasibility of reconstructing paleoatmospheric records of selected alkanes, methyl halides, and sulfur gases from Greenland ice cores’; Journal of Geophysical Research; volume 112, D07312
- ↑ Hodnebrog, Øivind; Dalsøren, Stig B. and Myrhe, Gunnar; ‘Lifetimes, direct and indirect radiative forcing, and globalwarming potentials of ethane (C2H6), propane (C3H8),and butane (C4H10)’; Atmospheric Science Letters; 2018;19:e804
- ↑ Brown, Bob; et al. (2008). "नासा ने शनि चंद्रमा पर तरल झील की पुष्टि की". NASA Jet Propulsion Laboratory.
- ↑ Brown, R. H.; Soderblom, L. A.; Soderblom, J. M.; Clark, R. N.; Jaumann, R.; Barnes, J. W.; Sotin, C.; Buratti, B.; et al. (2008). "टाइटन के ओंटारियो लैकस में तरल ईथेन की पहचान". Nature. 454 (7204): 607–10. Bibcode:2008Natur.454..607B. doi:10.1038/nature07100. PMID 18668101. S2CID 4398324.
- ↑ Mumma, Michael J.; et al. (1996). "Detection of Abundant Ethane and Methane, Along with Carbon Monoxide and Water, in Comet C/1996 B2 Hyakutake: Evidence for Interstellar Origin". Science. 272 (5266): 1310–1314. Bibcode:1996Sci...272.1310M. doi:10.1126/science.272.5266.1310. PMID 8650540. S2CID 27362518.
- ↑ Stern, A. (November 1, 2006). "Making Old Horizons New". The PI's Perspective. Johns Hopkins University Applied Physics Laboratory. Archived from the original on August 28, 2008. Retrieved 2007-02-12.
- ↑ J, McMurry (2012). कार्बनिक रसायन विज्ञान (8 ed.). Belmont, CA: Brooks. p. 95. ISBN 9780840054449.
- ↑ Kemp, J. D.; Pitzer, Kenneth S. (1937). "ईथेन की एन्ट्रापी और ऊष्मप्रवैगिकी का तीसरा नियम। मिथाइल समूहों का हिंडर्ड रोटेशन". Journal of the American Chemical Society. 59 (2): 276. doi:10.1021/ja01281a014.
- ↑ Ercolani, G. (2005). "कंपन स्पेक्ट्रोस्कोपी और सांख्यिकीय ऊष्मप्रवैगिकी द्वारा ईथेन में घूर्णी बैरियर का निर्धारण". J. Chem. Educ. 82 (11): 1703–1708. Bibcode:2005JChEd..82.1703E. doi:10.1021/ed082p1703.
- ↑ Pitzer, R.M. (1983). "ईथेन में आंतरिक रोटेशन के लिए बैरियर". Acc. Chem. Res. 16 (6): 207–210. doi:10.1021/ar00090a004.
- ↑ Mo, Y.; Wu, W.; Song, L.; Lin, M.; Zhang, Q.; Gao, J. (2004). "The Magnitude of Hyperconjugation in Ethane: A Perspective from Ab Initio Valence Bond Theory". Angew. Chem. Int. Ed. 43 (15): 1986–1990. doi:10.1002/anie.200352931. PMID 15065281.
- ↑ Pophristic, V.; Goodman, L. (2001). "अतिसंयुग्मन नहीं त्रिविम प्रतिकर्षण ईथेन की कंपित संरचना की ओर जाता है". Nature. 411 (6837): 565–8. Bibcode:2001Natur.411..565P. doi:10.1038/35079036. PMID 11385566. S2CID 205017635.
- ↑ Schreiner, P. R. (2002). "Teaching the right reasons: Lessons from the mistaken origin of the rotational barrier in ethane". Angewandte Chemie International Edition. 41 (19): 3579–81, 3513. doi:10.1002/1521-3773(20021004)41:19<3579::AID-ANIE3579>3.0.CO;2-S. PMID 12370897.
- ↑ Bischoff, CA (1890). "एकल रूप से जुड़े कार्बन परमाणुओं के मुक्त घूर्णन को समाप्त करने पर". Chem. Ber. 23: 623. doi:10.1002/cber.18900230197.
- ↑ Bischoff, CA (1891). "Theoretische Ergebnisse der Studien in der Bernsteinsäuregruppe". Chem. Ber. 24: 1074–1085. doi:10.1002/cber.189102401195.
- ↑ Bischoff, CA (1891). "Die dynamische Hypothese in ihrer Anwendung auf die Bernsteinsäuregruppe". Chem. Ber. 24: 1085–1095. doi:10.1002/cber.189102401196.
- ↑ Bischoff, C.A.; Walden, P. (1893). "Die Anwendung der dynamischen Hypothese auf Ketonsäurederivate". Berichte der Deutschen Chemischen Gesellschaft. 26 (2): 1452. doi:10.1002/cber.18930260254.
- ↑ Vallero, Daniel (June 7, 2010). "Cancer Slope Factors". Environmental Biotechnology: A Biosystems Approach. Academic Press. p. 641. doi:10.1016/B978-0-12-375089-1.10014-5. ISBN 9780123750891.